衰老的II型肺細胞與電離輻射誘導的放射性肺炎小鼠持續性肺纖維化的相關性研究
譚化,季輝,李娜,張秀敬,賈營
(1.石家莊市第三醫院干部保健科,河北 石家莊 050051;2.滄州中西醫結合醫院肺病科,河北 滄州 061000)
肺纖維化是一種進行性肺病,其特征在于功能性肺泡上皮細胞的嚴重損傷和細胞外基質蛋白的過量產生[1]。隨著與纖維化相關的分子事件的研究進展,出現了許多新的治療方法,其涉及細胞因子,生長因子和生化信號傳導途徑[2]。但目前還沒有有效的治療方法來逆轉或延緩這種疾病的進程[3]。肺纖維化的發病機制仍然難以捉摸。然而,II型肺泡上皮細胞(type II alveolar epithelial cells,AEC II)的氧化應激、增生、剝脫和凋亡可能是這種情況下的重要早期特征[4-6]。越來越多的證據表明氧化應激參與肺纖維化的發病機制。本研究對電離輻射誘導的小鼠進行AEC II衰老細胞測定,發現接受射線誘變、誘變時間可以增加衰老細胞的含量。易受氧化應激影響的AEC II細胞產生并分泌表面活性蛋白、肺泡上皮細胞功能的標志物,以便保持肺組織的形態組織、生物物理功能、生化組成和免疫功能[7]。細胞衰老是一種穩定的細胞周期停滯的條件,涉及多種生理過程,包括胚胎發育、腫瘤抑制、組織修復和有機體衰老[8]。由慢性和重復性微損傷引起的上皮缺損被認為是IPF患者嚴重纖維化的關鍵機制[9]。肌纖維母細胞的激活、遷移和侵襲,及細胞外基質的沉積,被提議作為這種自我維持和潛在的炎癥非依賴性疾病的后續結果[10]。本研究發現局灶性上皮破壞和AEC II凋亡的發生被是持續性肺纖維化的關鍵標志,其中還原性輔酶II是重要的中介物質。
1 資料與方法
1.1 一般資料
1.1.1 實驗大鼠 使用10周齡的雌性C57Bl / 6NCr小鼠,根據要求將實驗小鼠置于飼養籠中喂養并觀察小鼠的健康狀況,保證能自由攝取食物和水,環境溫度23 ℃ 恒溫,空氣濕度50%,交替12 h給予光照條件。飼養至實驗處理期間沒有出現小鼠死亡顯現,有3只小鼠精神比較萎靡,剔除實驗過程。
1.1.2 小鼠及原代培養肺細胞電離輻射誘導放射性肺炎模型 將10周齡的雌性C57BL/ 6NCr小鼠限制用于胸腔照射,鉛屏蔽身體的其余部分。用X-RAD 320以2.61Gy /min的2.0-mm Al過濾(300 kV峰)遞送輻射。根據實驗要求對不同組的小鼠給予不同劑量的射線處理,分別為0 Gy,5 Gy,17.5 Gy,持續15周。同時,對小鼠的原代培養肺細胞進行不同劑量的射線處理。在磷酸鹽緩沖鹽水或載體中用二苯基碘鎓1 mg/kg處理單獨的一組小鼠(6只),在照射后立即通過皮下注射遞送(17.5 Gy),每周5 d,持續16周。
1.1.3 實驗分組 根據實驗需求,將實驗小鼠隨機分為3組:對照組(每次射線劑量為0 Gy,n=6);5 Gy組(每次射線劑量為5 Gy,n=6);17.5 Gy(每次射線劑量為17.5 Gy,n=6);根據不同劑量的射線,將小鼠原代培養肺細胞分為原代細胞對照組、5 Gy+原代細胞組、17.5 Gy+原代細胞組、17.5 Gy+DPI+原代細胞組。在第3周和10周麻醉處死小鼠,解剖后將充氣的肺組織包埋在最佳切割溫度化合物,福爾馬林固定和石蠟包埋,然后快速冷凍并儲存在-80℃直至使用。
1.1.4 醫學倫理學問題 所有實驗程序均經動物保護和使用委員會批準,并根據實驗動物護理和使用指南進行實驗。
1.2 實驗方法
1.2.1 TUNEL測定AEC II細胞凋亡情況 根據制造商的方案進行TUNEL測定(原位凋亡檢測試劑盒;瑞士巴塞爾霍夫曼拉羅什有限公司)。使用辣根過氧化物酶介導的二氨基聯苯胺反應顯現TUNEL陽性信號。細胞核用蘇木精溶液復染。將整個幻燈片劃分為9個區域,并選擇5個區域,包括每個角落和中心區域,以測量細胞凋亡指數。然后以400倍的放大率拍攝每個視野。包含非實質結構的區域,如大型氣道或血管,被丟棄。對于每個顯微照片,手動計數總肺泡間隔細胞的數量和測試為TUNEL陽性的肺泡隔膜細胞的數量。計算每個圖像的陽性肺泡隔膜細胞相對于肺泡隔膜細胞總數的百分比,并獲得每只小鼠的平均值。在每只小鼠的5個20×場上計數衰老,DHE陽性或TUNEL陽性細胞的數量,并表示為總AEC II的百分比。具有褐色染色細胞核的細胞被認為是凋亡細胞。
1.2.2 定量實時PCR分析 通過實時聚合酶鏈反應檢查肺組織中相關基因表達。收集實驗組中小鼠切除肺并使用TRIzol勻漿,并根據制造商的方案分離總RNA。用oligo dT和Moloney鼠白血病病毒逆轉錄酶(賽默飛世爾科技)在42 ℃逆轉錄RNA 45 min。根據制造商的方案,使用Platinum Taq DNA聚合酶(賽默飛世爾科技),用引物擴增cDNA。聚合酶鏈反應產物在含有溴化乙錠的1.20%瓊脂糖凝膠中電泳,并用紫外發光器(Kodak)數字顯色。 使用計算機軟件(Quantity One)對帶強度進行半定量。
1.2.3 Western Blotting 使用購自Cell Signaling Technology(CST#9662,丹麥丹佛斯,美國)的抗體通過蛋白質印跡分析檢測肺組織中β-gal表達。在不同劑量的射線處理后,收集右上肺葉樣品并在組織裂解物中勻漿。通過BCA方法測定每個樣品中的總蛋白質含量。通過SDS-PAGE分離細胞溶質級分,轉移并固定在硝酸纖維素膜上。通過在室溫下與PBS中的5%脫脂奶粉一起溫育2 h來封閉膜,與抗蛋白酶-3一起溫育。然后,將膜在含有吐溫20(PBST)的PBS中洗滌3次。在室溫下使用抗兔辣根過氧化物酶二抗(1∶15 000;中國上海阿布瑪)2 h,用ECL化學發光系統檢測免疫復合物。將來自光密度測定法的β-gal水平標準化為GAPDH水平。
1.2.4 組織染色和膠原蛋白測定 通過Masson三色技術(西格瑪奧德里奇)評估纖維化,對于免疫組織化學(在補充方法中描述,在線獲得),對去石蠟切片進行抗原修復,阻斷和一抗孵育。針對前表面活性劑C,p21和NOX4的抗體獲自艾博抗貿易有限公司,針對8-OHdG的抗體獲自Genox。通過ImmPRESS / ImmPACT組織化學(加利福尼亞州伯林蓋姆矢量實驗室)使用核快速紅染色顯現免疫反應性。
1.2.5 β-gal活性檢測 用市售測定法評估衰老相關的β-半乳糖苷酶(β-gal)活性。將冷凍切片與10 μM二氫乙錠(DHE;紐約格蘭德島生命科技公司)在光保護的加濕室中于37 ℃溫育30 min。
2 結果
2.1 各組實驗小鼠中AEC II細胞凋亡率比較
TUNEL染色并對在對電離輻射處理的第3周、10周小鼠進行AECII細胞凋亡率的測定,結果發現17.5 Gy組、5 Gy組較對照組AECII細胞凋亡率升高,差異有統計學意義(P<0.05)。第3周時,17.5 Gy組的AECII細胞凋亡率與同期的對照組相比更高,差異有統計學意義(P<0.01)。對3組小鼠輻射誘導肺纖維化比較,5 Gy組、17.5 Gy組較對照組肺組織的纖維化程度加重(P<0.05)。見圖1及表1。


表1 AEC II細胞凋亡率比較
2.2 小鼠肺組織中相關炎癥因子mRNA表達情況
通過實時PCR擴增,對不同方法處理的3周和10周小鼠進行TNF-α、Caspase-3的mRNA表達情況,結果發現與對照組相比,5 Gy組、17.5 Gy組TNF-α、Caspase-3的mRNA表達上升,細胞炎癥凋亡情況加重,差異有統計學意義(P<0.05)。與5 Gy組相比,17.5 Gy組中TNF-α、Caspase-3的mRNA表達上升,差異有統計學意義(P<0.05)。見圖2及表2。

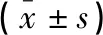
表2 小鼠肺組織炎癥因子mRNA表達情況
2.3 各組實驗小鼠中衰老AEC II細胞含量
對各實驗組小鼠的肺組織進行AEC II衰老細胞檢測,結果發現,對照組與5 Gy組在AEC II衰老細胞方面比較,差異無統計學意義(P>0.05)。而17.5 Gy組較5 Gy組和對照組,AEC II衰老細胞含量升高,差異有統計學意義(P<0.05)。這說明加大輻射劑量和延長輻射時間可以加大小鼠肺組織中AEC II衰老細胞的含量。見表3。

表3 AEC II衰老細胞含量
2.4 實驗第5周肺組織β-gal蛋白表達情況
蛋白印記分析小鼠組織中β-gal蛋白表達,第5周對3組實驗小鼠進行β-gal進行蛋白質印記分析測定,結果發現17.5 Gy組較5 Gy組、5 Gy組含量相對升高,差異有統計學意義(P<0.05)。見表4。
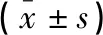
表4 小鼠β-半乳糖苷酶含量測定
2.5 小鼠原代肺細胞中DHE氧化情況測定
在小鼠原代肺細胞培養的第5天,在不同條件的處理基礎上對各組細胞進行二氫乙錠(DHE)氧化性檢測,同時細胞進行β-gal活性染色。結果發現,17.5 Gy+原代細胞組與5 Gy+原代細胞組、原代細胞對照組相比,細胞DHE染色率及β-gal染色率升高,差異有統計學意義(P<0.05);17.5 Gy+原代細胞組與17.5 Gy+DPI+原代細胞組相比,細胞DHE染色率及β-gal染色率升高,差異有統計學意義(P<0.05)。見表5。

表5 AEC II衰老細胞含量
2.6 小鼠原代培養細胞纖維細胞增殖及及膠原蛋白含量
在小鼠原代肺細胞培養的第5天,在不同條件的處理基礎上對各組細胞進行二氫乙錠(DHE)氧化性檢測,同時細胞進行β-gal活性染色。結果發現,17.5 Gy+原代細胞組與5 Gy+原代細胞組、原代細胞對照組相比,細胞DHE染色率及β-gal染色率升高,差異有統計學意義(P<0.05);17.5 Gy+原代細胞組與17.5 Gy+DPI+原代細胞組相比,細胞DHE染色率及β-gal染色率升高,差異有統計學意義(P<0.05)。見表6。

表6 各原代培養細胞中纖維細胞增殖及膠原蛋白含量
3 討論
目前,輻射誘發肺纖維化的病因仍存在爭議,但已報道肺細胞損傷是其他病因纖維化的主要因素。有研究[11-12]假設AEC II凋亡消失是無效肺泡修復的主要原因,導致上皮應激和纖維增生;但實際上,AEC II的靶向消耗導致快速進行性纖維化。相反,輻射后肺細胞有絲分裂原的遞送在晚期時間點恢復上皮完整性并減少纖維化。據研究[13]報道,輻射后細胞凋亡會導致肺細胞丟失。本研究在非纖維化和纖維化輻射后觀察到相當的AEC II凋亡,表明單獨的AEC II凋亡不足以引起纖維化。此外,在暴露于5 Gy后觀察到AEC II計數的逐漸恢復,但在暴露于纖維化劑量后未觀察到。這表明再生能力可能是劑量敏感的,并且與急性細胞毒性無關。在特發性肺纖維化患者的肺部和博來霉素誘導的肺纖維化動物模型中觀察到上皮細胞衰老。支持肺細胞復制潛力在肺纖維化中的重要性,端粒酶逆轉錄酶TER和端粒酶的RNA組分TERC的突變已被確定為遺傳性特發性肺纖維化的原因[14-15]。本研究假設AEC II耗竭是由衰老引起的干細胞功能喪失引起的,在纖維化輻射后觀察到AEC II衰老和氧化應激的時間和劑量依賴性增加。這些發現與AEC II作為肺泡干細胞的作用一致,因此復制的潛能喪失容易導致AEC II消耗并導致肺纖維化[16-19]。實際上,衰老程度而非細胞凋亡與AEC II耗竭的嚴重程度相關。
衰老的細胞在照射后的正常組織損傷中具有重要作用[20-21]。使用通過細胞毒性處理增強衰老的試劑可能無意中增強輻射毒性。已知活性氧物質誘導細胞衰老并在肺損傷和纖維化的實驗模型中升高。超氧化物是由還原性輔酶II同種型產生的潛在的有毒的活性氧物質。在博來霉素暴露后,還原性輔酶II4與上皮細胞凋亡有關,并且已被描述為輻射肺中氧化應激和細胞凋亡的來源。本研究發現抑制還原性輔酶II足以阻止AEC II衰老。衰老的肺細胞刺激成纖維細胞增殖和膠原蛋白分泌,這種作用被還原性輔酶II抑制阻斷。這些發現表明,衰老的肺細胞通過還原性輔酶II直接刺激纖維化。雖然這些數據強烈表明衰老在輻射誘發肺纖維化中起作用,并且氧化應激是該過程的關鍵,但本研究存在局限性。雖然這些數據表明輻射誘發肺纖維化衰老的作用,但定義致病作用將需要評估衰老衰老小鼠對纖維化的抵抗力。本研究使用的動物模型被廣泛用于輻射誘發肺纖維化的研究,但評估人體組織中的衰老對于理解該過程在人體輻射損傷中的重要性以及確定這些數據是否適用于患者都是至關重要的。研究患者的衰老和輻射損傷具有挑戰性,并受到受傷部位缺乏冷凍組織的限制。冷凍組織的收集是驗證這些發現的重中之重。最后,應該指出本研究并未評估衰老在其他經歷輻射損傷的器官中的重要性。
綜上,本研究將AEC II衰老鑒定為輻射誘發肺纖維化和還原型輔酶II作為治療靶標的新機制。最重要的是,這些研究數據表明晚期輻射損傷可能是由于慢性氧化應激導致組織“老化”和加速干細胞衰老,這一發現可能對接受放射治療的患者產生重要影響。

