血清脂質過氧化物水平在冠心病合并糖尿病介入治療后的變化
楊宏飛,鄢高亮
冠狀動脈粥樣硬化性心臟病簡稱冠心病,是由于冠狀動脈出現粥樣硬化病變引起血管狹窄,造成心肌缺血、缺氧而導致的心臟病[1]。糖尿病并發冠心病發病率逐年上升,超過4/5的糖尿病病人是因并發心血管疾病最終導致死亡,冠心病病死率約為非糖尿病病人的3倍[2-3]。目前對糖尿病導致冠狀動脈血管的損傷機制仍不是十分清楚,有研究認為[4],胰島素抵抗在心血管疾病發病中起著重要作用,且可以很好地解釋兩者之間關系,已被廣泛認可。研究表明,氧自由基參與冠脈血管病變的整個過程,其參與脂質過氧化反應引起的血管內皮損傷,是動脈粥樣化的主要原因[5]。對比單純冠心病病人,合并糖尿病者冠狀動脈病變更為嚴重,通常是多支血管同時性損害,并且在每支血管中呈彌漫性損傷[6]。國內目前關于冠心病合并糖尿病病人血管病變脂質過氧化損傷的報道已有許多,但檢索發現,探究介入治療前后糖尿病對血清脂質過氧化物水平影響的文獻尚且不多[7]。本研究旨在探究血清脂質過氧化物水平在冠心病合并糖尿病介入治療后的變化規律,報告如下。
1 資料與方法
1.1 一般資料選取2017年1月至2018年1月東南大學附屬中大醫院江北院區收治的行經皮冠狀動脈介入治療的冠心病病人94例作為研究對象,將其中單純冠心病病人41例分為對照組,冠心病合并糖尿病病人53例分為觀察組。對照組男26例,女15例;年齡范圍為48~84歲,年齡為(60.57±9.57)歲;病程范圍為6~19 d,病程為(11.46±3.58)d;Gensini評分范圍為38~62分,評分為(51.37±8.53)分。觀察組男31例,女22例;年齡范圍為46~82歲,年齡為(60.52±9.63)歲;病程范圍為 4~17 d,病程為(10.84±3.76)d;Gensini評分范圍為39~64分,評分為(51.24±8.38)分。兩組一般資料的差異無統計學意義(P>0.05)。本研究符合《世界醫學協會赫爾辛基宣言》相關要求。
1.2 入選標準經檢查確診為冠心病病人(有典型胸痛癥狀,輔助檢查發現心肌缺血或冠脈阻塞,心肌損傷標志物判定有心肌壞死);意識及精神狀態均正常,配合治療;病人及其家屬簽署知情同意書。
1.3 排除標準伴有嚴重肝、腎等臟器功能障礙;合并良、惡性腫瘤;微生物感染;腦血管疾病;血液、免疫系統障礙;既往有PCI手術史、心力衰竭病史;造血功能障礙;伴有嚴重感染或風濕免疫疾病;使用維生素、谷胱甘肽等抗氧化藥物。
1.4 分組標準將空腹血糖≥7.0 mmol/L,和(或)餐后2 h血糖≥11.1 mmol/L者分為觀察組,其余為對照組。
1.5 方法兩組在介入手術前根據各自病情進行擴血管(硝酸酯類)、抗血小板(阿司匹林)、調脂(他汀類)治療,同時給予β腎上腺素受體阻滯藥物口服。觀察組在此基礎上同時進行降糖治療即予以胰島素調節治療。兩組均在介入手術前及術后30 min、1 h、12 h、24 h、3 d抽取外周靜脈血,再加入30μL濃度為2 g/L的EDTA-Na和40μL抑肽酶,搖晃均勻,以3 000 r/min的轉速離心10 min,分離上層血清,置于-80℃待檢。丙二醛(MDA)水平采用巴比妥酸比色法測定,超氧化物歧化酶(SOD)水平采用黃嘌呤氧化法測定,操作過程嚴格按照試劑說明書進行。
1.5.1血清MAD水平測定 采用巴比妥酸比色法檢測MAD含量。實驗原理:MDA可與硫代巴比妥酸(TBA)縮合形成三甲雙酮,這種物質呈紫紅色,分光光度計下最大吸收峰為532 nm。研究采用752型分光光度計,測定(532 nm處)三甲雙酮吸光光度值,然后根據公式計算MAD水平。
1.5.2血清SOD水平測定 采用黃嘌呤氧化法檢測SOD含量。實驗原理:SOD可產生超氧陰離子自由基,胺化后會生成亞硫酸鹽(酸酐為二氧化硫SO2),與顯色劑反應呈紫紅色。當樣品中含有SOD時標本中的SOD能消除酸酐中的O2-,從而減少亞硝酸鹽生成量,降低吸光值,在紫外線可見分光光度計下測定(550 nm處)吸光光度值,然后根據公式計算SOD活力水平。
1.5.3不良事件發生率 通過門診、電話隨訪等統計并記錄術后6個月內兩組出現冠脈再狹窄、急性心肌梗死、卒中及死亡病人例數,分別計算發生率,進行比較分析。
1.6 統計學方法用SPSS 20.0進行數據分析。血清MAD、SOD水平資料均為多時點重復觀測數據,均用±s表示,行兩因素重復測量方差分析+組間LSD-t檢驗+組內差值t檢驗。兩組不良事件發生率用n(%)表示,行χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組手術前后血清MAD水平比較整體比較(兩因素重復測量方差分析)知:組間、時間及交互作用均差異有統計學意義(P<0.05)。兩兩精細比較并結合主要數據分析:觀察組術后30 min、1 h、12 h、24 h、3 d的MDA水平均低于對照組(P<0.05)。兩組術后血清MAD均持續下降,24 h后到達最低值,隨后上升;對照組術后12、24 h血清MAD水平、觀察組術后各時間段血清MAD水平與兩組術前相比差異有統計學意義(P<0.05)。見表1。
2.2 兩組手術前后血清SOD水平比較整體比較知:組間、時間及交互作用均差異有統計學意義(P<0.05)。兩兩精細比較并結合主要數據分析:觀察組術后30 min、1 h、12 h、24 h、3 d的SOD水平均高于對照組(P<0.05)。兩組術后1 h血清SOD均達到最高值,隨后逐漸下降;兩組術后各時間段的血清SOD水平與術前相比,差異有統計學意義(P<0.05)。見表1。
表1 經皮冠狀動脈介入治療的冠心病病人94例介入治療前后血清MAD及SOD水平比較/±s
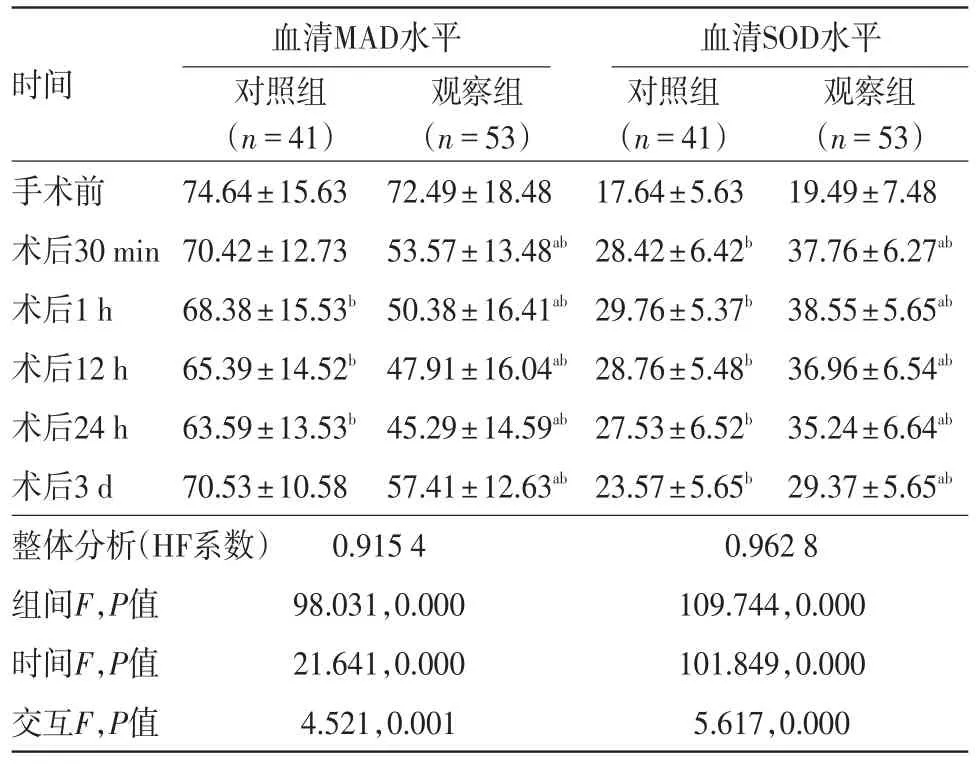
表1 經皮冠狀動脈介入治療的冠心病病人94例介入治療前后血清MAD及SOD水平比較/±s
注:整體分析為兩因素重復測量方差分析,資料球型性校正采用HF系數法。組間精細比較為LSD-t檢驗,顯著性標記a為兩組同時點相比P<0.05。時間精細比較為差值t檢驗,顯著性標記b為和組內手術前比較P<0.05,MDA為丙二醛,SOD為超氧化物歧化酶
血清MAD水平 血清SOD水平時間手術前術后30 min術后1 h術后12 h術后24 h術后3 d整體分析(HF系數)組間F,P值時間F,P值交互F,P值對照組(n=41)74.64±15.63 70.42±12.73 68.38±15.53b 65.39±14.52b 63.59±13.53b 70.53±10.58觀察組(n=53)72.49±18.48 53.57±13.48ab 50.38±16.41ab 47.91±16.04ab 45.29±14.59ab 57.41±12.63ab對照組(n=41)17.64±5.63 28.42±6.42b 29.76±5.37b 28.76±5.48b 27.53±6.52b 23.57±5.65b 0.962 8 109.744,0.000 101.849,0.000 5.617,0.000觀察組(n=53)19.49±7.48 37.76±6.27ab 38.55±5.65ab 36.96±6.54ab 35.24±6.64ab 29.37±5.65ab 0.915 4 98.031,0.000 21.641,0.000 4.521,0.001
2.3 兩組術后6個月不良事件發生率比較觀察組冠脈再狹窄、急性心肌梗死、卒中及死亡率均高于對照組(P<0.05)。見表2。
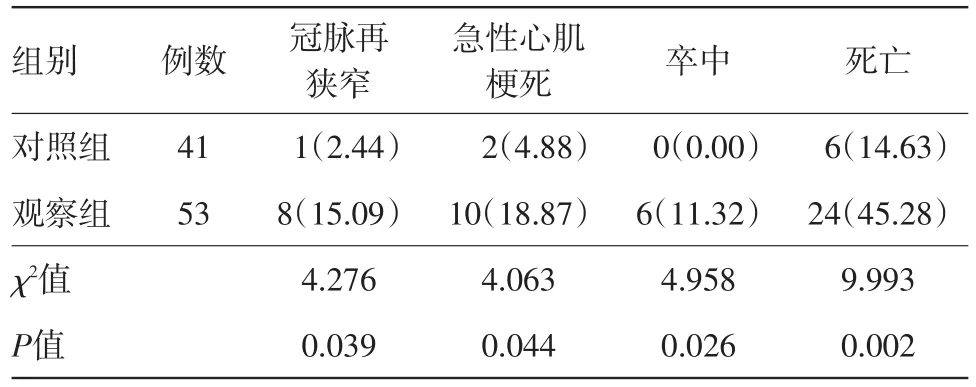
表2 經皮冠狀動脈介入治療的冠心病病人94例介入治療術后6個月不良事件發生率比較/例(%)
3 討論
糖尿病是冠心病最為重要的危險因素,統計表明[8],糖尿病病人心血管病發生率高達40%,由此造成的死亡率更是超過了總死亡率的6成以上。持續性的高濃度血糖是冠狀動脈損傷且惡化的重要原因,一旦糖基化血紅蛋白增多,打破血管舒張平衡,加之脂質過氧化作用便極易導致冠脈彌漫性狹窄[9]。金鵬等[10]通過檢測冠脈嚴重病變需植入支架治療病人手術前后MDA、D-二聚體的變化,證實介入手術會導致脂質過氧化物水平上升,雖然是暫時的。馬建林等[11]研究發現,冠心病病人經介入治療后會出現脂質過氧化損害,研究中兩組病人MDA、SOD水平均較術前均變化明顯,且血管內皮功能指標變化顯著,實驗組更為表現突出,持續時間在1周左右。
近年來,隨著血運重建技術不斷更新和心肌再灌注損傷研究的深入,臨床上對自由基團損傷血管及動脈粥樣化導致的脂質過氧化反應動脈斑塊形成機制亦有了新的認識,自由基的產生與消除是相互影響的,若機體的氧化代謝效率高,那么其抗氧化能力也會同樣強,而當這種平衡關系遭到被破壞后,便會產生氧化應激反應[12]。在本次研究中,觀察組術后30 min、1 h、12 h、24 h、3 d的MDA水平均低于對照組(P<0.05),SOD水平均高于對照組(P<0.05)。說明冠心病合并糖尿病病人介入治療后血清脂質過氧化物水平會出現明顯變化,且持續時間較長。同時觀察到,兩組術后血清MAD均持續下降,24 h后到達最低,隨后回升,而SOD則在術后1 h上升至頂峰,后逐漸下降,經統計發現,觀察組術后3 d血清MAD、SOD水平變化較對照組更為明顯,說明介入治療對冠心病合并糖尿病病人更能發揮其降低氧化應激反應的作用。MDA和SOD均是抗氧化的重要物質,其通過中和超氧陰離子自由基,以降低活性氧含量,起主要的拮抗作用[13]。眾所周知,血脂異常(尤其是低密度脂蛋白水平上升)是動脈粥樣化的重要因素,而氧化后的脂蛋白致病作用更強,有研究表明[14],病變血管中可檢測出自由基的抗原決定簇,兩者結合后會導致局部炎癥因子大量釋放、活化血小板,刺激細胞外基質過度增生,以促進斑塊形成。MDA是脂質氧化反應的終極產物,可通過降低相關酶活性(主要是線粒體呼吸)干涉代謝,對細胞具有一定毒害作用,臨床上常根據MDA的檢測水平來判斷脂質過氧化程度[15]。而SOD作用則與MAD相反,它主要是清除自由基,當SOD含量減少時,自然其對自由基的清除效用便會降低,病人便容易致病,在心血管病變中體現為阻礙低密度脂蛋白氧化的能力降低,導致血管脂質毒性增加[16]。
Smirnova等[17]通過觀察介入治療后冠心病病人主要發生的心血管事件,發現合并糖尿病者心肌梗死及死亡率上均明顯高于其他冠心病病人。在本次研究中,觀察組冠脈再狹窄、急性心肌梗死、卒中及死亡率均高于對照組(P<0.05)。與上述報道結果相似。考慮可能病人是介入治療后缺血再灌注損傷再次刺激了自由基含量上升,從而加重脂質過氧化損傷[18]。因此冠心病病人經介入手術治療后,伴有糖代謝異常者需合理控制血糖,穩定在正常范圍內,對改善疾病預后有重要作用。此外,同時重視他汀類藥物的使用,以減輕脂質過氧化作用,降低不良事件發生率。
綜上所述,冠心病合并糖尿病病人介入治療后血清脂質過氧化物水平出現明顯變化,且持續時間較長,糖尿病或起到一定催化作用。

