睡眠剝奪對抑郁癥模型大鼠海馬、前額葉皮質腦源性神經營養因子表達的影響
趙穎琳 許崇濤
(汕頭大學精神衛生中心心身醫學科,廣東 汕頭 515061)
抑郁癥是全球性的社會問題,是最常見的精神障礙之一,世界衛生組織現已將其列為醫療負擔最重的疾病〔1〕。多種抗抑郁藥物的研制與使用已幫助抑郁癥患者癥狀大大改善,但這些抗抑郁藥物的使用存在明顯起效遲緩現象,多數患者需要長時間用藥并有各種副作用產生,這不僅降低了患者依從性,還提高了抑郁癥自殺率,使藥物治療的安全性與有效性備受質疑〔2,3〕。睡眠剝奪是已知的起效最快的抗抑郁治療手段之一,可在24 h內發揮抗抑郁效果,相較于其他任何有效的抗抑郁藥物,其起效時間顯著縮短,且無明顯副反應與禁忌證,安全性好〔4〕。有研究報道,40%~60%的抑郁癥患者在接受睡眠剝奪治療后,抑郁狀態得到快速緩解〔5〕。盡管睡眠剝奪產生的抗抑郁效果短暫,限制了其在臨床上的應用,但因其為無法耐受抗抑郁藥物毒副作用的抑郁癥患者提供了有效的替代治療,并提高了難治性抑郁癥治療效果,對推動抑郁癥治療的進展有著重要意義〔6,7〕。本研究旨在對比分析抑郁癥大鼠與正常大鼠腦區腦源性神經營養因子(BDNF)水平表達的差異,明確BDNF與抑郁癥發病間聯系,為抑郁癥的早期診斷與合理治療提供可靠的生物學指標。
1 材料與方法
1.1動物 由中山大學動物中心購入35只成年雄性Sprague Dawley(SD)大鼠,均為清潔級。在實驗開始前將大鼠放在汕頭大學精神衛生中心動物房內進行為期1 w的合籠飼養,5只/籠,鼠籠的體積為70 cm×60 cm×60 cm,對每只大鼠每日進行1次觸摸,每次觸摸時間約為2 min,確保大鼠對實驗人員的操作適應。飼養1 w后開始進行試驗,確保動物房內通風良好,室溫調整為22℃,保證大鼠的自由光照、進食及飲水。
1.2動物分組 隨機分為正常對照組與應激造模組,測試每只大鼠的自發活動行為。正常對照組納入5只大鼠,除了開場實驗、蔗糖水消耗實驗與墊料定期更換外,不給予其他外在的刺激。應激造模組大鼠在慢性輕度且不可預見性應激刺激后按照自發行為實驗的結果,選擇活動量減少至少30%的具有明顯抑郁行為的大鼠納入后序實驗;采用隨機法再將其分為抑郁模型組、睡眠剝奪組(抑郁模型+72 h快眼動睡眠剝奪,使用小平臺水環境法保證抑郁模型大鼠無法進入自主睡眠狀態)及水環境對照組。抑郁模型結合大平臺對照組,使用大平臺水環境法設置作為睡眠剝奪環境對照組,裝置與小水平臺水環境法基本一致,但平臺直徑確保為18 cm,以保證抑郁模型大鼠能夠自主睡眠。3組各10只大鼠。
1.3實驗流程 在動物房適應性飼養結束后開始第一次開場實驗與蔗糖水消耗實驗,將實驗大鼠分組后,給予應激造模組大鼠連續3 w的慢性輕度不可預見性應激,隨后正常對照組與應激造模組均接受第二次開場實驗與蔗糖水消耗實驗,并根據開場實驗與蔗糖水消耗實驗所得的結果,選擇有明顯抑郁樣行為的大鼠作為成功模型納入后續實驗,隨機分組后,將正常對照組與抑郁模型組大鼠在第二場開場實驗及蔗糖水消耗實驗后即刻斷頭取出腦組織,其他2組大鼠繼續接受72 h快眼動睡眠剝奪,72 h后對這兩大鼠展開第三次開場試驗,實驗結束后即刻斷頭并將腦組織取出,使用Western印跡法測定并對比各組大鼠海馬區、前額葉皮質BDNF表達水平。慢性輕度不可預見性應激模型建立主要步驟:大鼠行為束縛限制120 min,在4℃的冰水里游泳5 min,禁食1 d,禁水1 d,夾尾1 min,明暗顛倒1 d,傾斜鼠籠45°1 d,潮濕墊料10 h,空瓶放置5 h及40℃高溫下震蕩10 min,隨機安排上述刺激,實驗持續21 d,每天給予1種刺激,在實驗中每種刺激至少出現2次,但不可連續出現,以確保大鼠無法預料刺激發生。開場實驗步驟:使用上海吉良公司提供的DigBehv動物自發活動行為視頻跟蹤分析系統檢測,保證房間內隔音、隔光,有空調,保證室溫在所需范圍內,每只大鼠觀察5 min,將敞箱徹底清潔后再觀察下一只大鼠情況。蔗糖水消耗實驗步驟:在進行實驗前首先訓練大鼠的適應與蔗糖水偏愛,實驗前1個24 h內,同時將2個裝有蔗糖水的瓶子放于飼養籠內,確保大鼠飲用;第2個24 h將飼養籠內放置一瓶1%蔗糖水,一瓶純凈水,讓大鼠自行飲水;在實驗第3個24 h內先禁食禁水21 h,然后同時給予大鼠一瓶蔗糖水、一瓶純凈水,在3 h后將水瓶取走并稱重,計算液體消耗量、蔗糖消耗量與蔗糖水比例。
1.4相關指標檢測 實驗結束后將各組大鼠斷頭處死,開顱,取腦,迅速游離出前額葉皮質與左側海馬,置于-80℃保存待檢,采用Western印跡方法測定各組大鼠海馬和前額葉皮質腦區BDNF表達水平。(1)主要儀器與試劑:常州國華電器有限公司提供的SHZ-82型恒溫震蕩器、澳大利亞Tencan公司提供的GENIOS型多功能酶標儀、美國Bio-RAD公司提供的電泳槽、轉移槽及影像掃描儀、Cell Signaling BDNF抗體試劑盒、上海碧云天生物技術公司提供β-actin抗體、國產分析純、裂解液蛋白濃度檢測試劑盒等。(2)蛋白樣品制備:將低溫冰箱內海馬與前額葉皮質取出置于離心管內,根據1∶10體積比加入裂解液勻漿后置于冰上,重復碾壓碾碎裂解30 min,高速離心取上清液。取蛋白標準配置液充分溶解配置蛋白標準溶液,然后取適量溶液使用0.9%氯化鈉稀釋,根據樣品數量配置工作液,混勻后按照不同比例分別加入標準品孔內,同時補充0.9%氯化鈉至一定量,適當加入樣品并稀釋,60℃靜置半小時,使用多功能酶標儀觀察吸光度值,取各組數據并制作曲線保存,計算蛋白濃度。(3)電泳條件:按照樣品濃度計算溶液體積上樣,取上樣樣品離心后加入上樣緩沖液,上樣前煮沸確保蛋白變性,電泳條件:80 V 15 min,100 V 40 min。(4)轉膜:蛋白樣品分離后轉移至聚偏氟乙烯(PVDF)膜上,加入轉移緩沖液后降溫,冰浴轉膜,轉移60 min,300 mA電流,轉移完成后轉染,并使用清水將未染色染液沖洗干凈以觀察膜上蛋白。上述步驟結束后進行免疫反應、化學發光、顯影、定影及凝膠成像分析。
1.5觀察指標 (1)對比正常大鼠與應激造模組大鼠應激前及應激后的自發活動情況,包括總路程、中央路程、周邊路程;(2)抑郁模型大鼠建立成功后,記錄并比較睡眠剝奪前、睡眠剝奪后各組大鼠自發活動情況,包括總路程、中央路程及周邊路程;(3)分別于應激前、應激后記錄并對比正常對照組與應激造模組大鼠蔗糖水消耗情況,包括消耗量與消耗百分比;(4)對比各組大鼠海馬與前額葉皮質BDNF表達水平。
1.6統計學方法 應用SPSS20.0軟件進行單因素方差分析及LSD-t檢驗。
2 結 果
2.1自發活動比較 應激后,應激造模組總路程、中央路程、周邊路程均明顯小于正常對照組,差異有統計學意義(P<0.05)。見表1。睡眠剝奪后,睡眠剝奪組總路程、中央路程、周邊路程均明顯高于水環境對照組,差異有統計學意義(P<0.05)。見表2。
2.2正常對照組與應激造模組蔗糖水消耗情況比較 應激后,應激造模組大鼠蔗糖水消耗量、蔗糖水消耗百分比均少于正常對照組大鼠,差異有統計學意義(P<0.05)。見表3。
2.3各組大鼠海馬、前額葉皮質BDNF表達水平比較 4組中,睡眠剝奪組海馬、前額葉皮質BDNF表達水平最高,然后由高至低依次為水環境對照組、抑郁模型組、正常對照組,其中,正常對照組與抑郁模型組比較無顯著差異(P>0.05),抑郁模型組與水環境對照組比較無顯著差異(P>0.05),其他組間比較差異有統計學意義(P<0.05)。見表4。

表1 正常對照組大鼠與應激造模組大鼠應激前后自發活動比較
與應激前比較:1)P<0.05;表2、3同

表2 睡眠剝奪組與水環境對照組大鼠睡眠剝奪前后自發活動比較
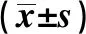
表3 正常對照組與應激造模組大鼠蔗糖水消耗情況比較

表4 各組大鼠海馬、前額葉皮質BDNF表達水平比較
與正常對照組比較:1)P<0.05;與抑郁模型組比較:2)P<0.05;與睡眠剝奪組比較:3)P<0.05
3 討 論
抑郁癥帶來的精神殘疾不僅給患者帶來沉重負擔,同時還會加重家庭與社會負擔,而患者在疾病支配下出現的自殺、自殘、擴大性自殺等暴力行為,更危及社會公共安全〔8,9〕。一直以來,臨床未停止對抑郁癥患病機制的研究,但該病明確的病理機制仍未有較多收獲,主要認為低水平、慢性的、長時間的應激源可能是誘發抑郁或導致抑郁病情加重的主要因素,但該應激源存在不可預見性與多變性,故在抑郁癥的預防與治療方面仍無明顯突破〔10〕。
不可預見的慢性輕度應激抑郁模型是現有的動物實驗中討論抑郁癥發病機制及治療應用廣泛的動物模型,本研究采用該模型進行實驗,造成的動物抑郁狀態能夠維持幾個月,建模高效,與抑郁模型建立要求相符〔11〕。自發活動是動物活動度及其對新鮮環境好奇程度的直觀反映,蔗糖水消耗量及消耗比例則是用于快感缺乏評價的客觀指標,上述結果均提示大鼠模型在接受21 d慢性不可預見應激后已經出現明顯的抑郁樣行為,對周圍環境的興趣喪失且缺乏快感,這與抑郁癥患者表現出的興趣缺乏、心境低落、樂趣喪失等核心癥狀極其相似,可見以該方式創建的抑郁模型有著相當高度的有效率。睡眠剝奪能有效改善抑郁情緒,起效迅速是其主要特點,但值得注意的是,該治療方案在結束后的恢復性睡眠將會對睡眠剝奪抗抑郁效應產生逆轉〔12,13〕。一般來說,睡眠剝奪治療時間多為24 h,但為減少因恢復性睡眠帶來的抗抑郁逆轉效應,本研究結果顯示,睡眠剝奪組大鼠自發活動顯著增加,有接近70%的大鼠其抑郁行為得到顯著改善,提示排除活動限制、應激、平臺環境等因素造成的影響,睡眠剝奪本身可通過延長剝奪時間逆轉大鼠抑郁樣行為。
海馬還是成年大腦內細胞增生與分化的主要腦區,隨著人們對情感障礙研究的深入,抑郁癥患病機制及治療機制的研究重點現已聚集到腦區重要組織〔14〕。近年學者認為抑郁癥的發生發展可能與因神經營養因子水平表達下降引起神經元萎縮,導致海馬神經出現膠質細胞缺失引起,而抗抑郁藥物的使用能夠逆轉或阻斷神經營養因子缺失,進而產生逆轉細胞萎縮與缺失的效果,進一步改善抑郁相關行為〔15,16〕。在神經元網絡的形成及可塑性中,神經營養因子起到關鍵作用,BDNF作為重要的神經營養因子家族成員之一,是目前抑郁癥神經營養因子假說研究的焦點,其可經與高親和力受體相結合,對下游磷脂酰肌醇-3激酶-Akt、Ras-分裂原活化蛋白激酶及其他相關信號通路產生激活之效,不僅能加速未成熟神經元生長及發育,還能夠對成年腦神經元的可塑性及結構產生調節之效〔16~18〕。本研究結果,與王建〔19〕的報道基本一致,提示抑郁癥的產生可能不是BDNF信號通路單獨損傷導致,還可能與其他通路損傷有關,但受研究條件的限制,本此研究并未對此進行分析,還應在未來展開相關的研究加以驗證。本研究結果提示抑郁模型大鼠海馬、前額葉皮質BDNF水平升高可能參加了睡眠剝奪迅速抗抑郁的發生,究其原因,BDNF對細胞長期存活有重要作用,對調節神經遞質的釋放與突觸可塑性均有理想的急性效應。上述結果也從側面反映了提高抑郁癥患者可塑性相關蛋白表達,能夠產生快速抗抑郁之效。本研究結果提示,抑郁模型大鼠腦內BDNF與抑郁癥發生間并非簡單因果聯系, BDNF表達可能參與了睡眠剝奪快速抗抑郁機制,但該結果的真實性及其發生的具體機制仍需要在未來展開相關研究加以驗證。
綜上所述,睡眠剝奪可能通過提高抑郁模型大鼠腦內BDNF表達來促進抑郁模型大鼠行為的改善,調節腦內BDNF表達在未來可能成為抑郁癥治療的新思路及新靶點。

