大鼠局灶性腦缺血再灌注損傷后MBP、MAGLingo-1的表達及丁苯酞對其的影響
白小梅,李正儀
缺血再灌注損傷在腦梗死發展過程中占有重要的地位[1],其病理生理過程較復雜,是一個多因素多環節相互作用的過程[2]。如何減輕這一損傷一直是國內外學者研究的重要方面,而髓鞘的受損、修復、再生情況成為近年來的研究熱點。髓鞘堿性蛋白(myelin basic protein,MBP)、髓鞘相關糖蛋白(myelin associated glycoprotein,MAG)及含有亮氨酸重復序列及免疫球蛋白結構域的Nogo受體作用蛋白-1(leucine-rich repeat sequence and Ig domain-containing,Nogo recepter-interacting protein-1,Lingo-1)是與中樞神經系統髓鞘相關的3種蛋白。
丁苯酞(dl-3n-butylphthalide,NBP)是一種廣泛應用于缺血性卒中患者的神經保護藥物,可在腦梗死的多個環節起作用[3],但目前的相關研究大部分集中于NBP對神經元的保護,對髓鞘的研究相對較少。本實驗采用線栓法阻塞S-D大鼠大腦中動脈建立局灶性腦缺血再灌注模型,通過免疫組化染色的方法測定腦組織皮質區MBP、MAG、Lingo-1的動態表達,探討腦缺血再灌注損傷后神經纖維髓鞘的受損情況及NBP對受損髓鞘的影響。
1 材料和方法
1.1 動物和分組 健康、清潔級S-D雄性大鼠72只,體重范圍在250 g~280 g之間(由西安交通大學醫學院實驗動物中心提供)。將大鼠隨機分為3組:對照組、模型組和藥物組,每組24只。每組按大鼠腦缺血再灌注時間點不同分為1 d、3 d、5 d、7 d 4個不同亞組,每個亞組6只大鼠。
1.2 試劑及藥物 兔抗大鼠MBP、MAG、Lingo-1多克隆抗體及SP-0023免疫組化染色試劑盒(北京博奧森生物技術有限公司);DAB顯色劑試劑盒(武漢博士德生物工程有限公司);丁苯酞原液(石藥集團恩必普藥業有限公司)溶于0.5%的吐溫80溶液中配成濃度為20 mg/ml的丁苯酞溶液。
1.3 模型制備 本實驗采用線栓法建立大腦中動脈阻塞(MCAO)模型。術前大鼠禁食12 h,10%水合氯醛溶液(0.35 ml/100 g)腹腔麻醉大鼠,消毒后將大鼠頸部正中皮膚切開,分別結扎頸外動脈及頸總動脈,在距離頸總動脈分叉處約4 mm的近心端剪一V型切口,將栓線插至頸內動脈約18~20 mm處,成功建立MCAO模型。常規消毒縫合切口。2 h后拔除栓線實現腦缺血再灌注。對照組只將栓線插至左頸總動脈分叉處,其余步驟均與模型組相同。藥物組大鼠建立模型后腹腔注射丁苯酞溶液[20 mg/(kg·次)、2次/d]。對照組和模型組大鼠腹腔注射生理鹽水[1 ml/(kg·次)、2 次/d]。術后大鼠單籠飼養,自由進食及飲水。
1.4 神經功能評分 使用Zea-Longa的5級4分法對MCAO模型大鼠進行神經功能缺損程度評分:無神經功能缺損癥狀0分;提尾時病灶對側前肢不能完全伸展1分;向病灶對側轉圈2分;向病灶對側傾倒3分;無自發活動,意識水平下降4分。選取評分為2分和3分的大鼠為模型組、藥物組。
1.5 取材及切片制備 缺血再灌注1 d、3 d、5 d、7 d時麻醉各組大鼠,分別用0.9%氯化鈉溶液、4%多聚甲醛溶液進行心臟灌注、固定并迅速斷頭,將腦組織完整取出后固定48 h至沉底。將左側大腦以視交叉為中心切取其前后2 mm冠狀切片組織,常規進行梯度酒精脫水、二甲苯透明、浸蠟、包埋并制備厚度為5 μm的切片用于免疫組化染色。
1.6 免疫組化染色 使用SP法,依次對腦組織切片脫蠟、水化,pH 6.0、0.01 mol/L檸檬酸緩沖液抗原修復,3% H2O2阻斷內源性過氧化物酶活性,滴加封閉用正常山羊血清工作液,放37 ℃恒溫箱20 min后取出,在各組切片上分別滴加一抗(MBP稀釋比例1∶200、MAG稀釋比例1∶100、Lingo-1稀釋比例1∶100),4 ℃冰箱過夜,室溫30 min,PBS緩沖液沖洗3次,滴加二抗、PBS緩沖液沖洗后進行DAB顯色、蘇木精復染、脫水、透明及封片,光鏡下觀察。使用LEICAQ550CW圖像采集及分析系統在×200倍光鏡下對MBP、MAG及Lingo-1的免疫組化染色結果進行圖像采集,并對其陽性染色程度進行灰度值測定。測定灰度值時,分別取每組每只大鼠的腦組織切片2張,每張切片均在皮質區既定部位隨機選取3個視野測定的灰度值,然后求平均數。
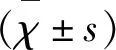
2 結 果
2.1 MBP 對照組大鼠皮質區MBP陽性表達,髓鞘呈棕褐色、魚骨刺樣緊密排列,隨再灌注時間點推移表達強度無明顯變化(P>0.05)。模型組、藥物組MBP均在再灌注1 d時開始減少,3 d時最少,隨后逐漸增多,差異具有統計學意義(P<0.05)。模型組、藥物組MBP比同時間點對照組減少(P<0.05)。藥物組MBP比模型組5 d、7 d時增多,差異具有統計學意義(P<0.05)(見表1、圖1)。
2.2 MAG 對照組大鼠皮質區MAG陽性表達,主要為少突膠質細胞及少量皮質纖維呈棕黃色,隨再灌注時間點推移表達強度無明顯變化(P>0.05)。模型組、藥物組MAG再灌注3 d時明顯增多,隨后逐漸減少,差異具有統計學意義(P<0.05)。模型組、藥物組MAG較對照組1 d時無統計學差異(P>0.05);3 d、5 d、7 d時增多(P<0.05)。藥物組MAG比模型組5 d時減少,差異具有統計學意義(P<0.05)(見表2、圖2)。
2.3 Lingo-1 對照組皮質區Lingo-1陽性表達,主要為神經元及少突膠質細胞棕黃色,表達強度隨再灌注時間點推移無明顯變化(P>0.05)。模型組、藥物組皮質區Lingo-1再灌注1 d時明顯增多,隨后逐漸減少,差異具有統計學意義(P<0.05)。模型組、藥物組皮質區Lingo-1較同時間點對照組均增多(P<0.05)。藥物組Lingo-1較模型組無統計學差異(P>0.05)(見表3、圖3)。
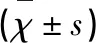
表1 各組大鼠皮質MBP陽性表達灰度值比較
與對照組比較*P<0.05;與模型組比較#P<0.05
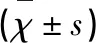
表2 各組大鼠皮質MAG陽性表達灰度值比較
與對照組比較*P<0.05;與模型組比較#P<0.05
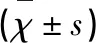
表3 各組大鼠皮質Lingo-1陽性表達灰度值比較
與對照組比較*P<0.05
3 討 論
腦缺血再灌注損傷會引起神經的一系列炎性反應,破壞腦屏障完整性,最終導致神經細胞死亡[4]。髓鞘是包裹在有髓神經纖維軸突周圍的管狀外膜,由蛋白質和鞘磷脂構成,具有絕緣和提高神經傳導速度的作用[5]。MBP定位于有髓神經的髓鞘漿膜面,是髓鞘中含量最高的蛋白,具有中樞神經系統特異性,與少突膠質細胞(oligodendrocytes,OLGs)分化、髓鞘形成關系密切,對維持髓鞘穩定性起著重要作用,是中樞神經系統受損的標志物[6~8]。本實驗中,模型組較對照組MBP減少,提示MBP與缺血再灌注損傷相關,再灌注3 d時表達最少,則提示此時髓鞘損傷最嚴重,這與國內外學者的研究結果基本一致[9~11]。MBP表達下降原因可能是腦缺血再灌注過程中大量自由基釋放,導致與膜結構相結合的蛋白質穩定性下降,同時鈣離子內流進入髓鞘包繞的軸突,激活鈣依賴性蛋白酶使MBP水解;其次,髓磷脂中的不飽和鍵易被自由基氧化,易使MBP與脂質脫失,造成MBP下降;此外大量炎性因子釋放后損傷成熟OLGs,使MBP釋放或漏出至胞外,進一步導致MBP表達減少。也有學者將MBP作為恢復少突膠質細胞分化和髓鞘形成的動態觀察指標[12]。本實驗中藥物組較模型組的MBP表達有所增加,但用藥5 d、7 d時差異才具有統計學意義,這提示丁苯酞對髓鞘損傷有一定緩解作用,且用藥達到一定時長后作用比較明顯。
MAG也是一種髓鞘特異蛋白,與MBP不同的是它定位于髓鞘最里層,與軸突直接接觸,是組成髓鞘的重要成分之一,主要參與髓鞘的形成、調節髓鞘與軸突間的作用、維持髓鞘結構的完整性等[13,14]。在神經發育過程、髓鞘形成的早期階段MAG具有促進作用,在成熟神經系統和髓鞘形成晚期則發揮著抑制作用[15]。本實驗中,模型組、藥物組MAG表達先升高,隨后逐漸降低,這與國內學者觀察到大鼠腦缺血再灌注損傷后腦組織中MAG表達情況相吻合[16]。早期MAG逐漸升高,可能與MAG在腦損傷早期階段應激性發揮抵抗興奮性氨基酸毒性相關。隨后MAG表達降低可能是對缺血缺氧敏感,缺血再灌注后功能受損或凋亡使其數量下降。但與對照組相比,此時模型組MAG的表達仍然是增多的,可能與殘留的受損髓鞘引發MAG作為髓鞘相關抑制因子在腦缺血后發揮軸突抑制功能相關。研究[17]顯示MAG通過與髓鞘相關抑制因子的共同受體NgR相結合,并在P75NTR的參與下,激活RhoA即小鳥嘌呤核苷三磷酸酶,最終發揮抑制作用。有學者認為在腦缺血過程中,MAG介導了髓鞘的疏松、解離,致使少突膠質細胞和髓鞘的損傷早于神經元病變[18]。這與本實驗同時觀察到大鼠皮質區MBP表達降低相吻合。藥物組大鼠MAG的表達比模型組降低,提示丁苯酞在腦缺血再灌注損傷過程中對腦皮質有保護作用,可能通過保護線粒體、改善腦組織能量代謝及局部微循環等[3]保護神經髓鞘。
Lingo-1是一種跨膜蛋白質,選擇性表達于中樞神經系統的OLGs和神經元,具有中樞神經系統特異性,主要功能是負性調節OLGs的分化、髓鞘形成、神經元存活及軸突再生等過程[19]。成年大鼠Lingo-1的表達水平在大腦皮質最高[20]。本實驗中,模型組Lingo-1表達1 d時顯著升高,隨時間推移有所下降,再灌注7 d時仍高于對照組。Lingo-1表達升高可能是機體在腦缺血再灌注后的一種應答反應,且Lingo-1對于強化軸突抑制因子的抑制功能有促進作用,這也可以解釋MAG作為髓鞘抑制因子之一在本實驗中的表達是升高的。藥物組Lingo-1與模型組相比有所降低但差異無統計學意義,可能與本實驗觀察時間較短有關。研究證明[21]Lingo-1在不依賴LRRs的情況下能抑制髓鞘堿性蛋白MBP的表達,這與本實驗同時觀察到MBP表達降低也是相一致的。此外,有學者[22]曾對局灶性腦梗死大鼠的Lingo-1表達情況進行研究,發現Lingo-1 mRNA及Lingo-1在腦缺血后1 d時達到高峰,在21 d時仍然高于假手術組。這與本實驗模型組1 d時Lingo-1的表達明顯增多相吻合,不同的是本實驗未能觀察到7 d以后各組Lingo-1的表達程度和變化趨勢,還有待于今后進一步研究。此外,藥物組較模型組Lingo-1表達無統計學差異也可能是本實驗觀察時間較短。為了減輕Lingo-1的髓鞘抑制作用,有學者[23]使用Lingo-1抗體來拮抗Lingo-1的抑制性作用,發現Lingo-1拮抗劑可以改善小鼠髓鞘損傷和空間記憶缺陷。另有研究表明抑制Lingo-1可以促進脊髓脫髓鞘后的功能恢復[19]。目前Lingo-1拮抗劑在神經系統髓鞘相關疾病如多發性硬化的治療中已有所應用。
綜上所述,本實驗對大鼠腦缺血再灌注損傷后髓鞘相關的3種蛋白進行了觀察,結果顯示MBP表達減少,MAG及Lingo-1表達增多,提示大鼠腦缺血再灌注過程誘發髓鞘損傷,丁苯酞對受損髓鞘有一定保護作用。但腦缺血再灌注損傷后MBP、MAG和Lingo-1更具體的表達規律、相互間的關聯、丁苯酞對受損髓鞘的影響機制還需今后進一步的研究。

圖1 大鼠局灶性腦缺血再灌注損傷后術側皮質區MBP表達(SP 法,×200)(a、b、c-再灌注3 d對照組、模型組、藥物組)

圖2 大鼠局灶性腦缺血再灌注損傷后術側皮質區MAG表達(SP 法,×200)(a、b、c-再灌注3 d對照組、模型組、藥物組)

圖3 大鼠局灶性腦缺血再灌注損傷后術側皮質區Lingo-1表達(SP 法,×200)(a、b、c-再灌注1 d對照組、模型組、藥物組)

