妊娠期糖尿病對成年子代小鼠糖脂代謝的影響及機制研究
蔣 南,曾瑞霞
1.錦州醫科大學附屬第一醫院產科(錦州121000);2.錦州醫科大學基礎醫學院(錦州121000)
妊娠期糖尿病(GDM)屬于臨床上特發于妊娠期女性的一種疾病,相關調查數據顯示,世界范圍內GDM的發病率高達17.8%,會對母嬰的生命健康安全造成嚴重影響[1]。隨著近年來相關研究的不斷深入,GDM患者不僅自身血糖水平顯著升高,且循環中的血脂以及氨基酸水平亦存在明顯的升高,從而可能對宮內環境造成不利影響[2]。而胎兒會獲取過多的營養,從而促進其胰腺以及肝臟分泌較多的胰島素以及胰島素樣生長因子-1,進一步增加了高出生體重新生兒的發生。目前,普遍認為GDM是未來子代發生肥胖以及糖尿病的高危因素。其中肥胖主要是因長期能量攝入過多,使得剩余能量轉化為脂肪并存儲于體內的一種狀態,其可能引發糖尿病、高血壓以及心腦血管疾病等,已成為全球性健康問題之一[3]。且有研究報道顯示,糖脂代謝紊亂所引起的一系列慢性疾病會對患者的自身生活質量造成極大影響,同時亦會給患者家庭以及社會造成極大的經濟負擔[4]。鑒于此,本文通過研究GDM小鼠對成年子代小鼠糖脂代謝的作用機制,旨在為臨床糖脂代謝紊亂的早期預防提供參考依據,現報告如下。
材料與方法
1 實驗材料 選取20只8周齡的SPF級C57BL/6雌鼠,均購上海斯萊克實驗動物有限責任公司,動物許可證號為SCXK(滬)2017-0005,體重均為19~21g。所有小鼠均飼養于溫度20~24℃,濕度40%~60%的環境下,并將其與健康雄性C57BL/6小鼠交配。通過陰栓檢測法和陰道精子檢測法明確小鼠是否受孕。隨后將受孕小鼠按照隨機抽簽法等分成觀察組及對照組,每組10只。
2 試劑和儀器 鏈脲霉素(購自美國Sigma公司),血糖儀(購自強生醫療器械有限公司),酶聯免疫吸附測定試劑盒(購自上海酶聯生物科技有限公司),miRNA RT-PCR試劑盒(購自上海生工生物),人胰島素注射液(購自諾和諾德制藥有限公司)。
3 實驗方法 ①GDM小鼠模型建立:將研究組小鼠在妊娠后第1天即通過腹腔注射40 mg/kg劑量的鏈脲霉素干預,對照組小鼠則予以腹腔注射等量的檸檬酸檸檬酸鈉緩沖液干預。研究組分別于妊娠后第5、12、19天以及分娩后第7天采集尾尖靜脈血,通過血糖儀檢測血糖水平,若血糖水平均>15 mmol/L,即為GDM造模成功。②通過酶聯免疫吸附法檢測血清瘦素水平,以全自動生化分析儀檢測血脂指標水平,主要囊括總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)。③葡萄糖耐量(GTT)試驗:子代小鼠禁食前稱重,經腹腔注射20%葡萄糖(2 g/kg體重),分別在給糖后0、30、60、90、120 min測血糖。④胰島素耐量(ITT)實驗:子代小鼠禁食稱重,經皮下注射1 IU/kg人胰島素,分別在給藥后0、30、60、90、120 min從小鼠尾靜脈采集血液標本,并應用血糖儀檢測血糖值。⑤子代小鼠肝臟相關基因表達情況:分別處死兩組子代小鼠,迅速獲取肝臟,提取RNA,通過實施熒光定量PCR法完成過氧化物酶體增殖物激活受體(PPARα)、肉毒堿棕櫚酰基轉移酶1α(CPT1α)、羥基酰基輔酶A脫氫酶(Ehhadh)、長鏈酯酰輔酶A合成酶3(ACSL3)相對表達量。

結 果
1 兩組子代小鼠的出生體重、空腹血糖、血漿瘦素水平對比 觀察組子代小鼠的出生體重、空腹血糖均高于對照組,而血漿瘦素水平低于對照組(均P<0.05),見表1。
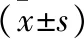
表1 兩組子代小鼠的出生體重、空腹血糖、血漿瘦素水平對比
注:與對照組相比,*P<0.05
2 分娩后20周兩組成年子代小鼠GTT實驗血糖水平對比 分娩后20周觀察組GTT實驗30、60、90 min時成年子代小鼠的血糖水平高于對照組(均P<0.05),見表2。
3 分娩后20周兩組成年子代小鼠血脂指標水平對比 分娩后20周觀察組成年子代小鼠TC、TG、LDL-C水平均高于對照組,而HDL-C水平低于對照組(均P<0.05),見表3。
4 分娩后20周兩組成年子代小鼠ITT實驗結果對比 分娩后20周觀察組成年子代小鼠ITT實驗30、60、90 min時的血糖水平高于對照組(均P<0.05),見表4。

表2 分娩后20周兩組成年子代小鼠GTT實驗血糖水平對比(mmol/L)
注:與對照組相比,*P<0.05

表3 分娩后20周兩組成年子代小鼠血脂指標水平對比(mmol/L)
注:與對照組相比,*P<0.05

表4 分娩后20周兩組成年子代小鼠ITT實驗結果對比(mmol/L)
注:與對照組相比,*P<0.05
5 兩組成年子代小鼠肝臟相關基因表達情況對比 觀察組成年子代小鼠PPARα、CPT1α、Ehhadh相對表達量均高于對照組,而ACSL3相對表達量低于對照組(均P<0.05),見表5。

表5 兩組成年子代小鼠肝臟相關基因相對表達量對比(%)
注:與對照組相比,*P<0.05
討 論
目前,臨床上已有大量文獻證實,圍妊娠期的飲食、生活習慣是決定母親和子代健康的重要因素[5]。另有相關研究亦證實了妊娠期若攝入過多的營養或(繼而)血糖異常升高,會在一定程度上增加子代相關疾病發生的風險[6]。既往,傳統的觀念認為,成人慢性疾病主要是于多基因遺傳易感性的基礎上,因不良生活方式和飲食習慣等因素所誘發。而近年來所開展的胎兒編程假說提出,宮內環境的異常可能直接關系到個體生命的成長、遠期疾病的發生風險甚至子孫后代的生命健康[7]。其中妊娠期和哺乳期過量的營養攝入可增加高出生體重發生幾率,同時亦會在一定程度上增加子代成年后肥胖、糖尿病和心血管疾病的發病率[8]。相關流行病學研究證實:生命早期的生長模式和其成年后高血壓、葡萄糖耐受性受損、胰島素抵抗和肥胖的風險存在密切相關[9]。GDM作為妊娠期孕產婦較為常見的代謝紊亂性疾病之一,患者主要臨床表現囊括血糖水平異常升高、脂肪代謝紊亂以及機體代謝紊亂。GDM會導致產婦宮內環境發生明顯改變,繼而可能對子代的糖脂代謝產生一定的影響[10]。
本文結果發現,觀察組子代小鼠的出生體重、空腹血糖均高于對照組,而血漿瘦素水平低于對照組(均P<0.05)。這表明GDM小鼠可顯著增加子代小鼠的出生體重,同時可提高血糖水平,降低瘦素水平。分析原因,筆者認為可能是GDM小鼠的宮內環境發生改變,從而使得胎兒的營養攝入過多,繼而促進了其生長迅速,增加了出生體重。與此同時,GDM會引起子代小鼠出現瘦素抵抗,進一步引起瘦素水平的降低。此外,分娩后20周觀察組GTT、ITT實驗30、60、90 min時成年子代小鼠的血糖水平高于對照組(均P<0.05),這提示了GDM小鼠會引起子代小鼠成年后糖代謝紊亂。究其原因,筆者認為胎兒主要是通過臍靜脈進行母血營養物質的吸收,因胎盤屏障的存在,從而使得葡萄糖可通過胎盤屏障,而胰島素與以高血糖素無法通過胎盤屏障。因此,在胎兒通過臍靜脈吸收GDM母親含有高血糖的血液時,會刺激胎兒胰島細胞的增殖以及胰島素分泌的增加,最終引起糖代謝紊亂[11-12]。另外,分娩后20周觀察組成年子代小鼠TC、TG、LDL-C水平均高于對照組,而HDL-C水平低于對照組(均P<0.05)。這與既往研究結果高度一致[13],表明了GDM小鼠會引起子代成年后脂代謝的紊亂。其中主要原因可能在于:子代小鼠的高水平胰島素無法發揮正常的生理功能,從而對正常的脂肪-胰島素軸的反饋作用造成破壞,繼而對TC的合成和分解代謝造成影響,最終導致脂質代謝出現紊亂[14]。本文結果還顯示了觀察組成年子代小鼠PPARα、CPT1α、Ehhadh相對表達量均高于對照組,而ASL3相對比表達量低于對照組(均P<0.05)。提示了GDM小鼠對成年子代小鼠糖脂代謝的影響作用機制可能與肝臟相關基因表達異常有關。分析原因,PPARα與CPT1α表達的降低會導致線粒體β的氧化能力,繼而增加脂代謝疾病的易感性;Ehhadh表達的增加會促進脂肪酸β的氧化,進一步降低肝內脂肪酸含量;ACSL3的過表達會刺激細胞攝取脂肪酸,繼而在脂質合成的調控過程中起著至關重要的作用[15-16]。
綜上所述,GDM小鼠會導致子代成年后出現糖脂代謝紊亂,其主要作用機制可能與肝臟相關基因表達異常有關,值得臨床重點關注。

