硫酸介質中具表面活性噻唑衍生物的緩蝕性能研究
陳肖杰,胡志勇,朱海林,馬雪梅,王京寶,萬祎,李軍,曹端林
(中北大學 化學工程與技術學院,山西 太原 030051)
酸洗是工業(yè)領域用于設備除垢的一種經濟有效的方法,但是酸洗過程會發(fā)生氫脆現(xiàn)象[1]。因此,在酸洗時要加入緩蝕劑。苯并噻唑類緩蝕劑是一類陰極型緩蝕劑[2-3],能抑制反應析氫,對于各個工業(yè)部門中設備的水垢清洗具有重要意義。文獻研究表明[4],改善緩蝕劑在金屬表面的吸附性能,可以提高其對金屬的緩蝕性能。基于此,本文對2-巰基苯并噻唑(MBT)進行改性使其具有表面活性,能夠在碳鋼界面定向吸附成膜,繼而提高其對碳鋼的緩蝕作用。
1 實驗部分
1.1 試劑與儀器
具表面活性噻唑衍生物(BTC6T),實驗室自制[5];濃硫酸,分析純;45#碳鋼(元素組成(質量分數(shù)%):0.5 C,0.37 Si,0.8 Mn,0.04 P,0.045 S,0.25 Cr,0.25 Ni,0.25 Cu,其余為Fe),由揚州市祥瑋機械有限公司提供。
AL204電子天平;K100全自動表面張力儀;IM6/IM6E電化學工作站。
1.2 實驗方法
1.2.1 表面張力測定 配制一系列不同濃度的BTC6T的硫酸溶液,利用全自動表面張力儀測定20 ℃時各溶液的表面張力γ,繪制γ-logC曲線。
1.2.2 靜態(tài)失重 本實驗所用45#碳鋼試片規(guī)格為20 mm×10 mm×2 mm,腐蝕介質為 0.5 mol/L H2SO4溶液。分別在20,30,40 ℃的恒溫條件下,將準備好的碳鋼片懸掛在含不同濃度的緩蝕劑溶液中48 h,取出試片后用丙酮、無水乙醇清洗,冷風干燥后用電子天平稱重,根據(jù)試片的失重計算其腐蝕速率及緩蝕率。
(1)
(2)
式中M0和M——分別表示腐蝕前后金屬試片的重量,g;
A——試片的表面積,m2;
t——測試時間,h;
V0和V——分別表示碳鋼在不添加緩蝕劑和添加不同濃度緩蝕劑的腐蝕液中的腐蝕速率,g/(m2·h);
η——緩蝕率,%。
1.2.3 電化學實驗 電化學測試設備采用電化學工作站,采用傳統(tǒng)的三電極體系,工作電極為45#碳鋼(工作面積為1 cm2,其余部分用環(huán)氧樹脂封裝),參比電極為飽和甘汞電極(SCE),輔助電極為鉑電極。
1.2.3.1 電化學阻抗譜掃描 測試前電極表面用水相砂紙(150#、400#、600#、800#、1 000#)將45#碳鋼逐級打磨拋光至光亮,用丙酮、無水乙醇清洗后干燥,保鮮膜密封待用。開始阻抗譜掃描之前,先將工作電極放入測試電解液中進行開路電壓掃描,待開路電壓穩(wěn)定后,外加振幅 5 mV 的正弦微擾電壓信號,相對開路電位在 35 mHz~10 kHz 頻率范圍內自低頻向高頻掃描,測試溫度為20 ℃。
1.2.3.2 動電位極化曲線掃描 極化曲線實驗測試溫度為20 ℃,掃描速率是 1 mV/s,掃描范圍是相對開路電壓-0.7~0.4 V。測定0.5 mol/L H2SO4溶液中含不同濃度緩蝕劑的45#碳鋼的極化曲線,通過電化學工作站進行數(shù)據(jù)擬合得到電極反應的動力學參數(shù)。
2 結果與討論
2.1 表面活性
通過表面張力測定方法研究2-巰基苯并噻唑衍生物(BTC6T)的表面活性,其在硫酸溶液中的表面張力隨濃度的變化曲線γ-logC見圖1。
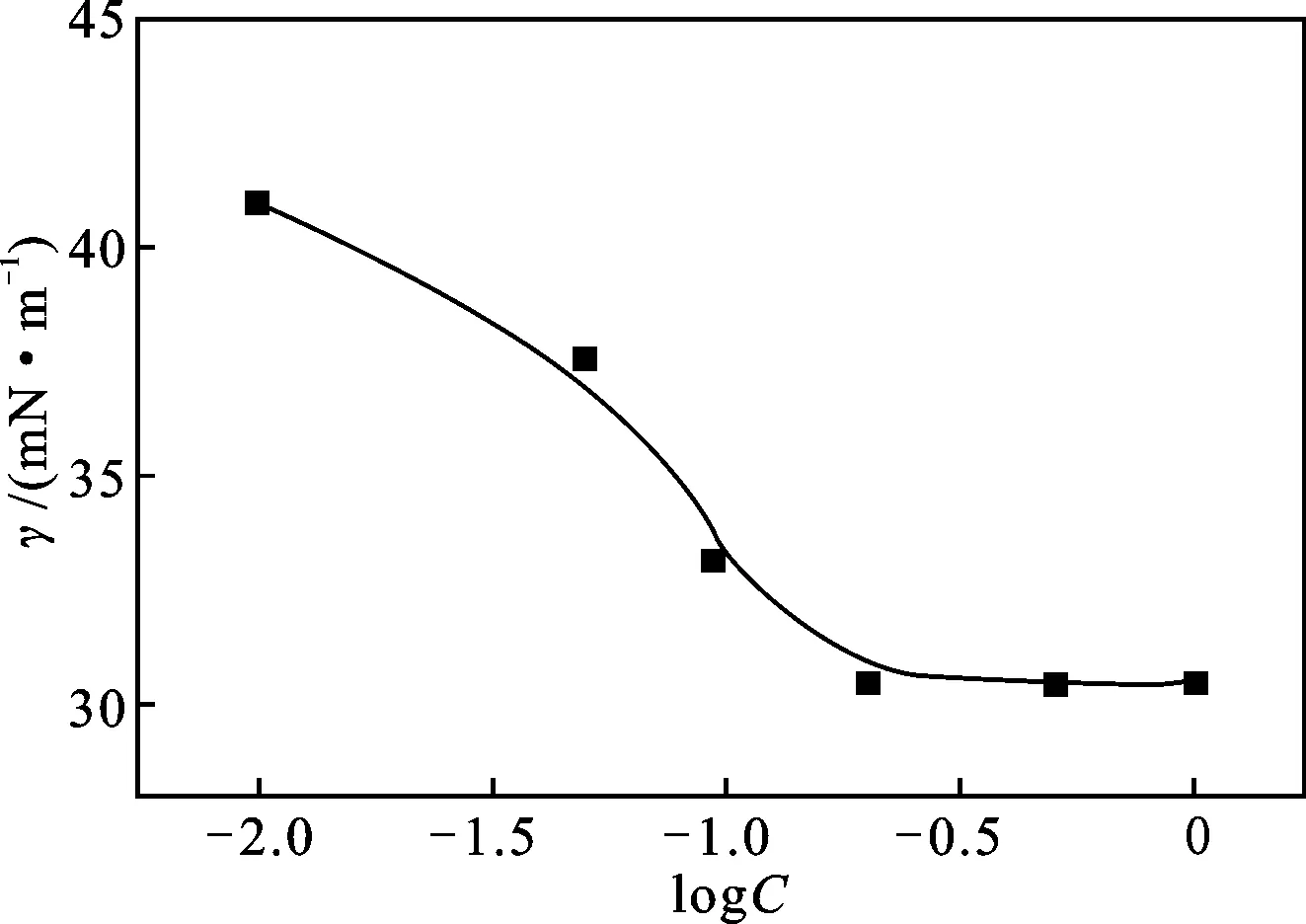
圖1 BTC6T的γ-logC曲線(20 ℃)Fig.1 γ-logC curve of BTC6T at 20 ℃
由圖1可知,隨著BTC6T濃度的增大,其在硫酸溶液的表面張力先是顯著下降而后基本保持不變,這主要是由于在BTC6T濃度較低時,隨著BTC6T濃度的增加,其在溶液表面的聚集增加,溶液的表面張力驟減,而隨著濃度的進一步增加,溶液表面聚集的分子越來越密集,表面張力降低越來越慢,當聚集達到飽和以后,表面張力降至最低,此時再增加BTC6T濃度,溶液表面張力將不再隨其變化。表面張力達到最低時,溶液的濃度即為臨界膠束濃度(cmc)。由圖1可以得到,20 ℃時,BTC6T在0.5 mol/L 硫酸中的臨界膠束濃度為0.22 mol/L,最低表面張力γcmc為30.45 mN/m。
2.2 靜態(tài)失重
靜態(tài)失重實驗結果見圖2。
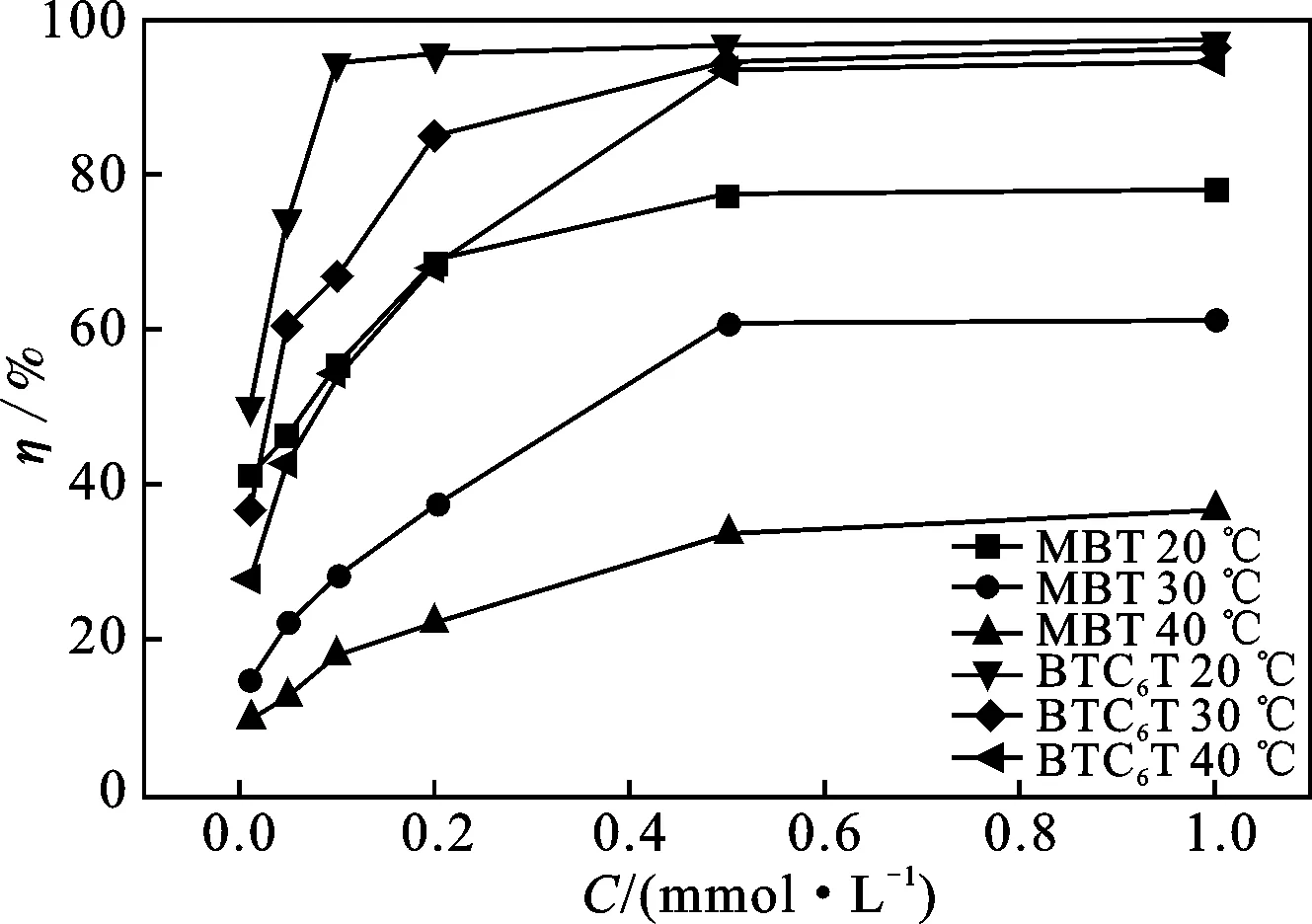
圖2 不同溫度條件下緩蝕率隨MBT與BTC6T濃度的變化曲線Fig.2 Corrosion inhibition efficiency curves of MBT and BTC6T at different temperatures
由圖2可知,MBT與BTC6T的緩蝕率均隨著濃度的增加而增加,這主要是由于緩蝕劑在碳鋼表面吸附形成致密的有機膜,隨著緩蝕劑的用量增大,緩蝕劑分子在碳鋼表面的覆蓋度增加[6]。當兩種緩蝕劑用量為0.50 mmol/L時,繼續(xù)增加緩蝕劑的用量,緩蝕率不再有明顯提升,這可能是由于碳鋼表面具有有限的吸附量,當緩蝕劑用量達到一定程度時,緩蝕劑在碳鋼表面的吸附趨于飽和[7]。因此,兩個緩蝕劑最佳用量均為0.50 mmol/L。
由圖2可知,MBT與BTC6T的緩蝕率均隨著溫度的升高而降低,這表明這兩種緩蝕劑是溫度依賴性緩蝕劑,這可能是由于溫度升高導致分子熱運動加劇[8],吸附的緩蝕劑從碳鋼表面解吸,膜的致密性下降,導致緩蝕率減小。由此說明這兩種緩蝕劑與碳鋼表面之間存在物理吸附[6,9]。此外,BTC6T對硫酸介質中碳鋼的緩蝕率受溫度的影響比MBT小,說明BTC6T對熱的穩(wěn)定性優(yōu)于MBT。
由圖2還可知,以45#碳鋼為試樣,當腐蝕溫度及緩蝕劑的用量一定時,BTC6T的緩蝕率遠遠高于MBT。這可能是由于在硫酸溶液中添加BTC6T后,硫酸溶液的界面張力得到顯著的降低,從而促進了緩蝕劑在金屬與溶液界面間的吸附。
2.3 電化學實驗數(shù)據(jù)
2.3.1 電化學阻抗譜掃描 碳鋼電極在添加不同濃度 MBT、BTC6T 的 0.5 mol/L 硫酸溶液中的電化學阻抗譜以 Nyquist 圖的形式在圖3中示出。
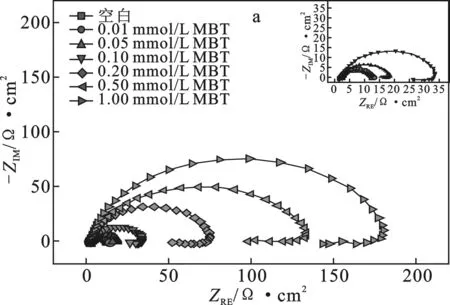
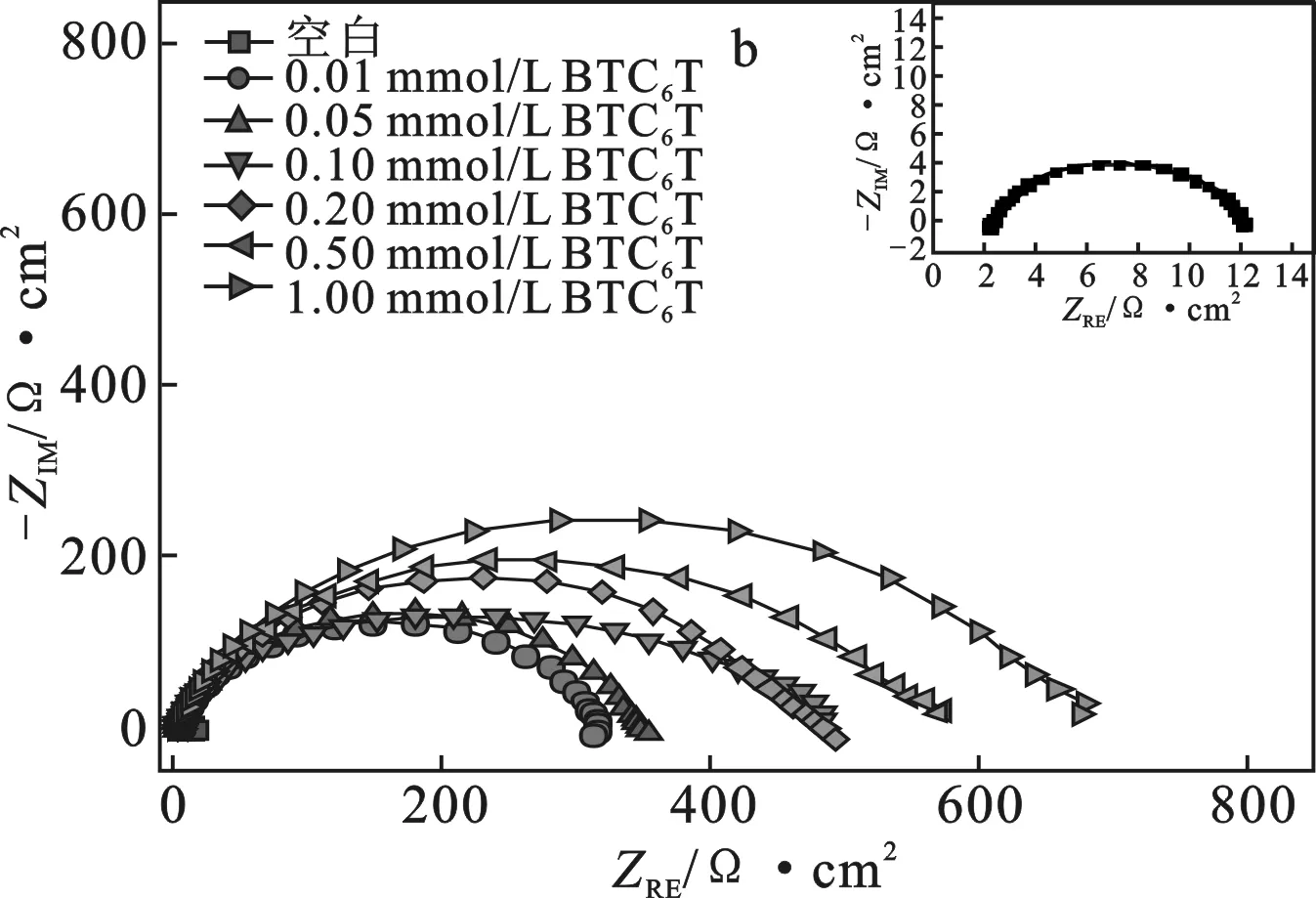
圖3 碳鋼電極在添加不同濃度MBT(a)及BTC6T(b) 的0.5 mol/L硫酸溶液中的電化學阻抗譜圖Fig.3 Electrochemical impedance spectra of carbon steel electrode were added with different concentrations of MBT(a) and BTC6T(b) in 0.5 mol/L sulfuric acid solution
由圖3可知,這兩個 Nyquist 圖在高頻時都表現(xiàn)為一個近似半圓的容抗弧,且隨著緩蝕劑濃度的增加,容抗弧的直徑增大[10]。這可能是由于緩蝕劑分子能夠吸附在碳鋼電極表面,且隨著濃度的增加,電極表面上吸附的緩蝕劑增多,導致腐蝕反應的阻力增大[11]。此外,兩個 Nyquist 圖在高頻時不是完美的半圓,而是呈現(xiàn)凹陷的半圓形式,這主要歸因于碳鋼電極表面的不均勻性。
由圖3a可知,添加緩蝕劑 MBT 后,腐蝕體系的界面阻抗特征發(fā)生明顯變化,在低頻端即將結束時又出現(xiàn)一個不明顯的弧(感抗弧),這可能與碳鋼電極表面吸附物質的弛豫過程有關[12],也可能是由于碳鋼電極在低頻下發(fā)生再溶解過程[13]。由圖3b可知,添加緩蝕劑 BTC6T 后,腐蝕體系的界面阻抗特征并未發(fā)生明顯變化[14-15],僅僅在高頻處呈現(xiàn)一個凹陷的半圓(容抗弧)。
結合圖3a和圖3b發(fā)現(xiàn),當兩個緩蝕劑的添加量相同時,BTC6T 高頻弧的直徑明顯大于 MBT,說明 BTC6T 的緩蝕效果優(yōu)于 MBT,這與靜態(tài)失重法測試結果一致。
2.3.2 動電位極化曲線 圖4為碳鋼電極在添加不同濃度 MBT(a) 及 BTC6T(b) 的 0.5 mol/L 硫酸溶液中的極化曲線。對應的擬合參數(shù)包括自腐蝕電位Ecorr、腐蝕電流密度Icorr、陰、陽極Tafel斜率(bc、ba)列于表1。
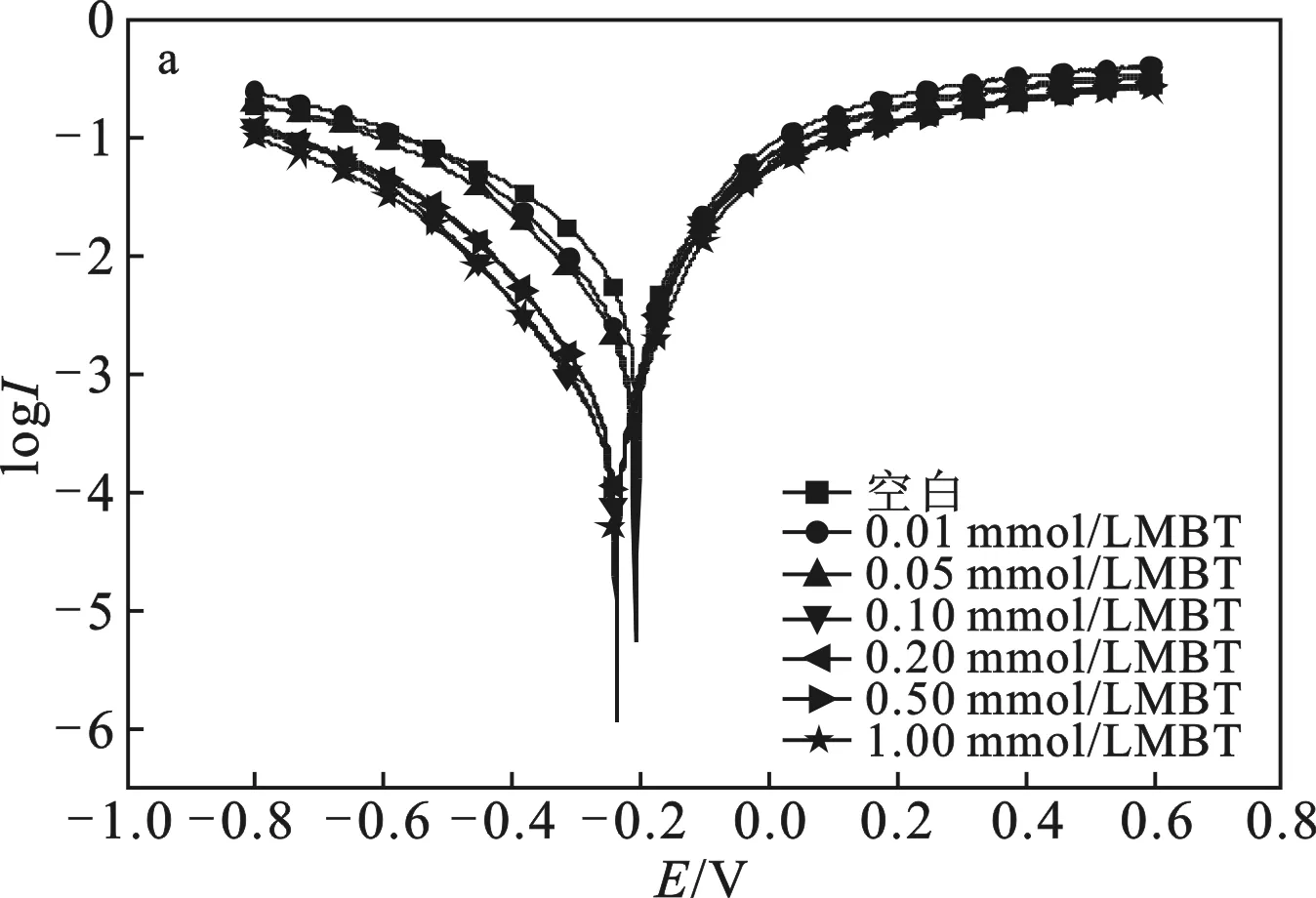
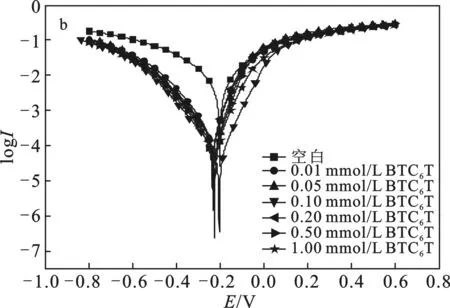
圖4 碳鋼電極在添加不同濃度MBT(a)及BTC6T(b) 的0.5 mol/L硫酸溶液中的極化曲線Fig.4 Polarization curves of carbon steel electrode were added with different concentrations of MBT(a) and BTC6T(b) in 0.5 mol/L sulfuric acid solution
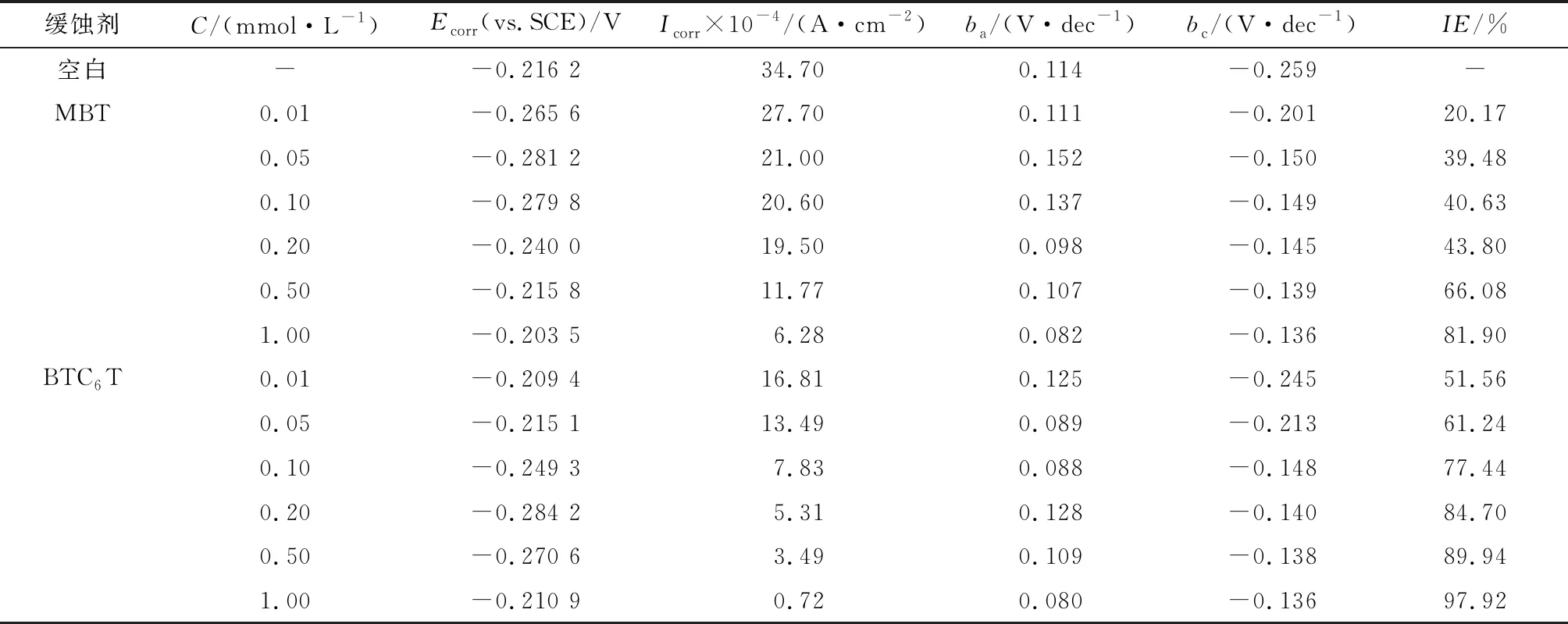
表1 MBT與BTC6T極化曲線擬合數(shù)據(jù)Table 1 Fitting data of MBT and BTC6T polarization curve
由圖4和表1可知,隨著緩蝕劑 BTC6T 和 MBT 濃度的增大,體系的腐蝕電流密度均逐漸減小,緩蝕率增加,這可能是由于隨著緩蝕劑濃度的增大,緩蝕劑分子在金屬表面所形成的吸附膜越來越致密,保護金屬表面不受腐蝕,從而提高緩蝕效果[16]。
由表1可知,添加緩蝕劑BTC6T和MBT后,腐蝕電位的最大位移值<85 mV,說明 BTC6T和MBT是混合型緩蝕劑[17]。由圖4可知,BTC6T和MBT降低陰極腐蝕電流密度的趨勢更明顯,BTC6T和MBT是以陰極為主的混合型緩蝕劑[5]。此外,添加MBT后,陽極腐蝕電流密度增大,金屬溶解反應加速,在硫酸介質中是一種危險的金屬緩蝕劑;而對于BTC6T,陰、陽極腐蝕電流密度均減小,且 BTC6T 降低腐蝕電流密度的趨勢更明顯,說明BTC6T緩蝕效果比MBT好,這與靜態(tài)失重及電化學阻抗譜測試結果一致。這可能是由于緩蝕劑BTC6T具有表面活性,利用其在碳鋼表面的定向吸附,親水基團與碳鋼表面發(fā)生物理吸附或化學吸附,非極性基團在水溶液中起到疏水作用,因而提高了緩蝕效果[18]。
3 結論
通過表面張力測定研究了BTC6T在硫酸溶液中的表面活性,研究發(fā)現(xiàn)20 ℃時,BTC6T在0.5 mol/L 硫酸中的臨界膠束濃度為0.22 mol/L,最低表面張力γcmc為30.45 mN/m。
通過緩蝕劑性能評價常用方法(靜態(tài)失重、動電位極化曲線、交流阻抗譜)研究MBT與BTC6T在0.5 mol/L H2SO4溶液中對45#碳鋼的緩蝕效果,所得結論如下。
(1)MBT和BTC6T對硫酸介質中碳鋼的緩蝕率均隨著濃度的增大而增大,且BTC6T對碳鋼的緩蝕效果顯著優(yōu)于MBT。當BTC6T添加量為0.50 mmol/L,在腐蝕時間48 h、溫度20 ℃的實驗條件下,緩蝕率可達96.84%。
(2)MBT和BTC6T對硫酸介質中碳鋼的緩蝕率隨著溫度的升高而降低,但BTC6T對熱的穩(wěn)定性優(yōu)于MBT。
(3)MBT 和 BTC6T 是以陰極為主的混合型緩蝕劑。MBT 在酸性介質中是一種危險的金屬緩蝕劑,而BTC6T 可以在金屬表面發(fā)生定向吸附,從而提高緩蝕作用。

