大鼠邊緣下區H2S/CBS在條件性恐懼消退保持中的作用及機制研究
黃德亮,蔣淑君,于臘梅,施 真,潘 虹,劉紅霞
(濱州醫學院 1. 內科護理學教研室, 2. 濱州醫學院生理學教研室, 山東 煙臺 264003)
創傷后應激障礙(posttraumatic stress disorder,PTSD)是指異乎尋常的威脅性或災難性心理創傷導致的延遲出現和(或)長期持續存在的精神障礙。PTSD發病機制復雜多樣[1],其神經機制的研究發現,內側前額葉皮層(medial prefrontal cortex,mPFC)的邊緣下區(infralimbic,IL)、海馬和杏仁核在PTSD相關癥狀的發生機制中有重要作用,其中邊緣下區與恐懼記憶的消退密切相關[2-3]。研究顯示,神經系統存在的硫化氫(hydrogen sulfide,H2S)主要由胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)催化產生,小腦、海馬、皮質等腦組織部位有大量CBS分布[4]。生理濃度的H2S易化海馬長時程增強[5],參與學習記憶和情緒調節[6]。本研究旨在觀察大鼠條件性恐懼訓練和消退訓練后邊緣下區CBS/H2S 體系含量變化,外源性補充H2S對大鼠恐懼消退行為影響以及H2S對邊緣下區神經元放電影響。為進一步揭示PTSD的發病機制及尋找治療靶點提供實驗依據。
1 材料與方法
1.1 實驗動物健康成年♂ Wistar大鼠,體質量(200~300) g,由青島市藥檢所動物中心提供(合格證號:SCXK(魯)2014 0007)。動物飼養于專用動物房(濕度60%,溫度24 ℃,照度 220 lux ),保持光照/黑暗12 h恒定循環,自由活動、進食、飲水。實驗前將大鼠置于條件恐懼箱或高架十字迷宮中10 min,記錄其僵立行為基礎值和焦慮水平的基礎值,選擇各項行為學得分相近大鼠隨機分組并進行后續實驗。實驗前每只大鼠每天在條件恐懼箱中適應5 min ,共6 d,所有行為實驗均在8 ∶30~17 ∶30進行。
1.2 主要藥品和儀器條件恐懼箱(型號:MED-VFC-OPTO-M/R)購自美國Med Associates公司,Micro1401數據采集系統(Micro1401)和Spike2數據分析系統(Spike2)購自英國CED公司,CBS抗體(sc-67154)購自Sant Cruz公司,NaHS(161527)和滂胺天藍(C8679)購自美國Sigma公司。
1.3 分組及給藥正常對照組(Naive),大鼠置于條件恐懼箱中,不給予任何處理;恐懼對照組(Control),給予條件恐懼不給予消退訓練,腹腔注射等量生理鹽水;恐懼消退組(Extinction),給予條件恐懼和消退訓練,在消退訓練前后腹腔注射等量生理鹽水;NaHS組,給予條件恐懼和消退訓練,在消退訓練前30 min和消退訓練后4 h分別腹腔注射NaHS(5.6 mg·kg-1)各1次。
1.4 行為學實驗
1.4.1條件性恐懼模型 實驗系統由測試盒、電擊刺激控制系統、聲音刺激控制系統、紅外視頻跟蹤和記錄系統以及動物行為分析系統5 部分組成。大鼠置于條件恐懼箱中熟悉環境3 min,之后給予聲音信號(4.5 kHz,80 dB,30 s)提示的不可逃避足底電擊(0.6 mA,5 s)10次,使大鼠產生條件恐懼,兩次間隔1~4 min。條件刺激結束后繼續在該箱中停留3 min,然后放回日常飼養籠。
1.4.2條件性恐懼消退訓練 將已建立條件性恐懼的大鼠(條件恐懼建立24 h后)重新置于條件恐懼箱,僅給予連續30次與建模時同樣的聲音條件刺激,而不再給予非條件刺激(足底電擊)。兩次間隔1~2 min,連續4次聲音信號后無僵立行為出現則視為完全消退。
1.4.3消退保持測試 各組大鼠消退訓練后當日(extinction-0d)、消退訓練后d 1、3、7進行僵立行為測定。大鼠置于條件恐懼箱中,僅給予5次建模時的聲音信號,兩次間隔1~2 min,記錄大鼠連續10 min內僵立時間百分比。
1.5 亞甲藍法[7]檢測腦組織H2S含量為防止玻璃與H2S結合,整個檢測過程容器均采用高質量的聚丙烯塑料管。消退訓練24 h后,大鼠麻醉后斷頭取腦,冰上分離雙側內側前額葉,勻漿裂解時每mg腦組織加10 μL磷酸氫鉀緩沖液。取上清(200 μL)與10 g·L-1醋酸鋅混合,生成硫化鋅沉淀后,20 000×g高速離心15 min,用溶于7.2 mol·L-1鹽酸的N,N-二甲基-對苯二胺硫酸鹽(20 mmol·L-1)150 μL和溶于1.2 mol·L-1鹽酸的FeCl3(30 mmol·L-1)100 μL液體溶解沉淀。靜置15 min后,取200 μL液體至96孔板,用670 nm波長進行吸光度檢測。根據NaHS標準曲線計算樣品中H2S含量。
1.6 Western blot方法檢測腦組織CBS蛋白的表達消退訓練24 h后,大鼠麻醉后斷頭取腦,于冰上分離雙側內側前額葉,勻漿時每10 mg腦組織加入100 μL裂解液,4 ℃,12 000 r·min-1離心10 min,取上清,BCA 法行蛋白定量。常規方法電泳轉膜,加一抗 (CBS polyclonal Antibody) 1 ∶2 000和二抗 (goat anti-rabbit IgG, HRP conjugate)1 ∶2 000。用Image J軟件進行分析各條帶的灰度值。
1.7 電生理學方法大鼠腹腔注射20%氨基甲酸乙酯(1 g·kg-1)進行麻醉,腦立體定位儀俯臥位固定后,定位內側前額葉區(參照大鼠腦圖譜(Paxinos and Watson,2005)。顱骨硬腦膜打開后,微電極(記錄電極管內注入2%滂胺天藍,其余兩管注入相應藥物)尖端用液壓推進器緩慢送至內側前額葉區,觀察細胞平穩放電至少5 min,利用PM2000B壓力注射儀將藥物注射到神經元表面,用Micro1401數據采集系統顯示細胞放電曲線,用Spike2數據分析系統對細胞放電頻率進行分析。以加藥前120 s內平均每秒放電頻率為對照,將加藥后反應高峰50 s內平均每秒放電頻率作為藥物的效應,放電頻率超過2倍標準差認為具有統計學意義。

2 結果
2.1 消退訓練對條件恐懼大鼠僵立行為的影響取消退訓練后第1天測定的僵立行為數據進行分析,與正常對照組(Naive)相比較,恐懼對照組(Control)大鼠的僵立行為明顯加重(P<0.01);與恐懼對照組(Control)相比,恐懼消退組(Extinction)大鼠的僵立行為有所減輕(P<0.01),但較正常對照組(Naive)大鼠的僵立行為嚴重(P<0.01)。見Fig 1。

Fig 1 Freezing behavior in conditioned

**P<0.01vsnaive group;##P<0.01vscontrol group.
2.2 消退訓練對條件恐懼大鼠內側前額葉腦區H2S含量的影響亞甲基藍法檢測結果如Fig 2所示,與正常對照組(Naive)相比,條件恐懼大鼠(Control)內側前額葉腦區H2S含量明顯降低(P<0.01),與恐懼對照組相比,恐懼消退組大鼠(Extinction)內側前額葉腦區H2S 含量有所回升(P<0.01),但較正常對照組(Naive)相比仍有所降低(P<0.01)。

Fig 2 H2S level of medial prefrontal cortex tissuesin na?ve, control and extinction n=10)
**P<0.01vsnaive group;##P<0.01vscontrol group.
2.3 消退訓練對條件恐懼大鼠內側前額葉腦區CBS含量的影響大鼠與人的腦組織中H2S主要依賴CBS 產生,Fig 2實驗結果顯示各組大鼠內側前額葉腦區腦組織H2S水平發生變化,我們用Western blot方法檢測CBS蛋白表達情況以明確CBS蛋白變化趨勢是否與H2S變化趨勢一致。如Fig 3所示,與正常對照組(Naive)相比,條件恐懼大鼠(Control)內側前額葉腦區腦組織CBS含量明顯降低(P<0.01),與恐懼對照組相比,消退訓練大鼠(Extinction)內側前額葉腦區CBS含量有所回升(P<0.05),但較正常對照組(Naive)相比仍有所降低(P<0.01)。

Fig 3 CBS level of medial prefrontal cortex tissuesin na?ve, control and extinction n=4)
**P<0.01vsnaive group;#P<0.05vscontrol group.
2.4 H2S供體NaHS可改善消退訓練大鼠的僵立行為上述結果顯示條件恐懼大鼠內側前額葉腦區CBS/H2S 體系減少,消退訓練大鼠內側前額葉腦區CBS/H2S 有所回升,所以我們考慮補充外源性H2S有可能改善消退訓練大鼠的僵立行為。如Fig 4結果顯示,與恐懼消退組(Extinction)相比,NaHS組大鼠消退訓練后0、1、3、7 d的僵立行為明顯低于恐懼消退組(Extinction)大鼠在相同時間點的僵立行為(P<0.01)。

Fig 4 Interference of H2S on freezing behavior at differenttime points in conditioned fear n=8)
**P<0.01vsextinction group.
2.5 H2S供體L-cysteine對正常大鼠海馬神經元細胞外放電的影響為了探討L-cysteine對整體狀態下大鼠內側前額葉神經元的電生理效應,我們利用多管微電極進行細胞外電生理記錄,觀察L-cysteine對神經元放電頻率的影響。如Fig 5所示,微量壓力注射無菌生理鹽水前后內側前額葉腦區神經元的放電頻率差別無統計學意義(P>0.05);微量壓力注射L-cysteine使內側前額葉腦區神經元自發放電頻率升高(P<0.01)。
3 討論
本研究觀察到大鼠條件性恐懼訓練后內側前額葉皮層的邊緣下區CBS/H2S 體系含量減少,僵立行為加重;而消退訓練后邊緣下區CBS/H2S 體系含量有所回升,僵立行為有所減輕;且外源性補充H2S后可改善消退訓練大鼠的僵立行為,這些結果表明,內側前額葉皮層的邊緣下區CBS/H2S調節恐懼記憶的消退過程。為了探討邊緣下區H2S調節恐懼記憶消退過程的機制,我們又觀察了外源性補充H2S對整體狀態下大鼠邊緣下區神經元的自發放電的影響,結果顯示,外源性補充H2S能明顯升高神經元自發放電頻率,表明邊緣下區CBS/H2S調節恐懼記憶的消退過程與其能增高該區神經元自發放電頻率有關。
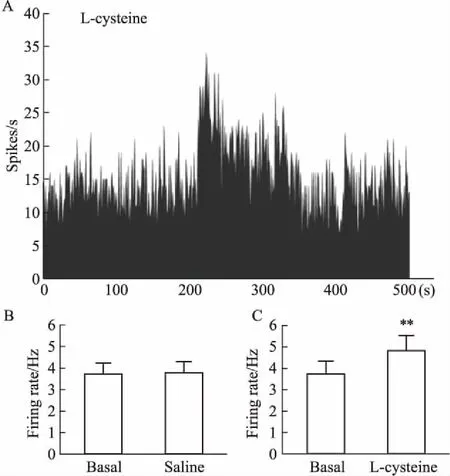
Fig 5 Effect of H2S system on frequencyof spontaneous discharges of medial prefrontal

A:Initial graph of the frequency of spontaneous discharges of medial prefrontal cortex neurons. B,C: Histogram of the frequency of spontaneous discharges of medial prefrontal cortex neurons before and after administration.**P<0.01vsbasal.
內側前額葉皮層邊緣下區與恐懼記憶的消退密切相關[2-3]。杏仁體在條件恐懼的形成和表達中起關鍵作用,在解剖學上,邊緣下區有密集的纖維投射到杏仁核外側部;當條件刺激呈現時,mPFC對杏仁體中央核的抑制可使動物表現出恐懼記憶的抑制或者恐懼消退[2];丘腦內側背部-mPFC通路和海馬-mPFC通路誘發的長時程增強與恐懼記憶消退的保持有關[8];vmPFC損毀只損害恐懼記憶的消退過程[9];PTSD患者內側前額葉皮層活動下降[10]。可見,mPFC完整的結構和功能,以及mPFC對杏仁核的正常抑制在創傷性記憶消退的過程中至關重要。神經系統內H2S主要由CBS催化產生,小腦、海馬、皮質等部位有大量CBS分布, H2S在大腦內含量相對較高(50~160 μM)[2]。H2S通過抗炎、抗氧化和抗凋亡等多途徑調節神經系統功能并保護神經元[4],其中生理濃度的H2S易化海馬神經元長時程增強[5],調節突觸可塑性,參與學習記憶和情緒調節[6]。我們既往研究也表明海馬杏仁核CBS/H2S通過調節神經元自發放電頻率調控創傷后應激障礙模型大鼠學習記憶及情緒行為[11-12]。本研究進一步檢測了條件恐懼訓練及消退訓練大鼠內側前額葉皮層邊緣下區CBS/H2S水平以及外源性補充H2S對恐懼消退的影響。結果顯示條件性恐懼訓練后內側前額葉皮層的邊緣下區CBS/H2S體系含量減少,消退訓練后邊緣下區CBS/H2S 體系含量有所回升;且外源性補充H2S后可改善消退訓練大鼠的僵立行為。這些結果表明內側前額葉皮層的邊緣下區CBS/H2S調節恐懼記憶的消退過程。這與我們以往研究[11-12]及侯曉怡[13]報道的外源性補充H2S可改善不同應激模型大鼠學習記憶能力和抑郁樣行為相一致。
腦內H2S可抑制興奮性氨基酸的釋放,易化海馬神經元長時程增強[5],并促進星形膠質細胞攝取谷氨酸,清除突觸間隙中過多的谷氨酸,維持正常的突觸傳遞功能。研究進一步證實,H2S選擇性增強海馬區和杏仁核區N-甲基-D-天冬氨酸 (N-methyl-D-aspartic acid, NMDA) 受體的電流并影響NMDA受體依賴的動物學習記憶能力和大鼠情感記憶[14]。以上研究表明,硫化氫可以調節神經元的電生理特性進而影響大鼠的學習記憶和情感記憶。研究還發現,丘腦內側背部-mPFC通路在消退訓練后1~7 d的長時程增強有所增加;海馬-mPFC通路上誘發的長時程增強也是在消退訓練后發生的[8]。Milad和Quirk發現vmPFC的IL區神經元在條件恐懼消退訓練24h后的消退回憶時可記錄到神經元放電和短時間放電增強現象,這說明IL區放電變化參與消退回憶的調節,并且Anthony等[15]采用多導電生理記錄方法證明了NMDA受體依賴的IL區神經元的簇狀放電是消退鞏固所必需的。以上研究揭示了mPFC產生的突觸可塑性以及放電情況與消退的保持有關。本研究利用在體細胞外電生理記錄法,觀察外源性H2S供體L-cysteine對大鼠邊緣下區神經元電生理特性的影響。與以上文獻[8,14,15]報道一致,L-cysteine可以影響神經元的電生理特性,主要表現為L-cysteine對邊緣下區神經元產生興奮效應,使邊緣下區神經元放電頻率升高。這與我們以往的研究[11-12]相似。綜合文獻及實驗結果我們分析,H2S增強條件恐懼消退行為的機制之一可能是增加了邊緣下區神經元放電頻率和興奮性。
PTSD發病機制多樣,至今不是十分清楚,本研究證實邊緣下區CBS/H2S體系的含量參與調節恐懼記憶的消退過程,外源性增加H2S含量可增強條件恐懼消退行為,該作用可能與其增加邊緣下區神經元放電頻率和興奮性有關。該研究對揭示PTSD神經生物學機制,尋找防治創傷后應激障礙靶點提供新思路和實驗依據。本研究僅針對邊緣下區H2S含量變化及對恐懼消退和神經元的影響進行了研究,關于H2S增加邊緣下區神經元放電頻率和興奮性的分子機制、信號通路有待于進一步研究闡明。