一體化18F-FDG PET/MR評估缺血性腦血管病
缺血性腦血管病具有高患病率、高致殘率、高死亡率及高復發率的特點[1-2]。頸內動脈(internal carotid artery, ICA)和/或大腦中動脈(middle cerebral artery, MCA)粥樣硬化性狹窄、閉塞是引起缺血性腦血管病的最主要原因[3-4]。一體化PET/MR具有同步掃描的獨特優勢,一次掃描可同時獲得PET和MR圖像,兼具MR空間分辨率高、軟組織對比度佳和PET檢查獲取分子生物學信息的優勢,通過自動圖像精確配準融合可實現腦結構、功能、代謝在時間和空間的最佳配準。本研究探討一體化18F-FDG PET/MR在缺血性腦血管病中的應用價值。
1 資料與方法
1.1 一般資料 選取2018年5月—2018年11月17例就診于首都醫科大學宣武醫院的慢性缺血性腦血管病患者,男15例,女2例;年齡35~71歲,平均(53.0±9.1)歲,均經血管造影診斷為單側ICA或MCA閉塞,且病程超過1個月;排除MR檢查禁忌證及由于頭部移動等原因嚴重影響圖像質量者。同期選取10名成年健康志愿者作為對照,男4例,女6例,年齡31~61歲,平均(45.3±9.3)歲;均無精神疾病病史,并經頭顱MR檢查證實腦部無異常改變、MRA證實無顱內及頸動脈血管病變。本研究經醫學倫理委員會批準,受檢者檢查前均簽署知情同意書。
1.2 儀器與方法 采用GE 一體化Signa TOF-PET/MR掃描儀,19通道頭頸聯合線圈;顯像劑為自行制備的18F-FDG,放化純度>98%。檢查前囑受檢者禁食6 h以上,期間不飲用含糖的水,并于檢查前1天禁酒、禁劇烈及長時間運動,在注射示蹤劑前將血糖濃度控制在正常范圍。18F-FDG注射劑量為3.7 MBq/kg體質量,注射后50 min開始一體化18F-FDG PET/MR檢查。圖像采集過程中,囑受檢者平臥、閉眼、放松、靜止不動,盡量避免任何思維活動。PET掃描參數:PET圖像采集時間10 min,采用飛行時間(time of flight, TOF)技術+點擴散函數(point-spread function, PSF)技術,視野35 cm×35 cm,迭代次數8,有效子集32,矩陣192×192。MR掃描參數:①T1WI,TR 3 545 ms,TE 24 ms,層厚3.0 mm,層間距1.0 mm,視野24 cm×24 cm,矩陣288×256,掃描時間1 min 55 s;②T2WI,TR 6 278 ms,TE 102 ms,層厚3.0 mm,層間距1.0 mm,視野24 cm×24 cm,矩陣 288×288,掃描時間59 s;③Flair序列,TR 11 000 ms,TE 145 ms,層厚3.0mm,層間距1.0 mm,視野24 cm×24 cm,矩陣256×256,掃描時間2 min 56 s;④DWI,TR 6 212 ms,TE 74.9 ms,層厚3.0 mm,層間距1.0 mm,視野24 cm×24 cm,矩陣128×128,掃描時間50 s;⑤3D-TOF-MRA,TR 25 ms,TE 3.7 ms,層厚1.4 mm,重疊0.7 mm,視野22 cm×22 cm,矩陣320×256,掃描時間14 min 34 s。其中T1W、T2W、Flair序列及DWI的掃描范圍覆蓋從顱底至顱頂全部腦組織,3D-TOF-MRA掃描范圍覆蓋頸部和顱內血管。
1.3 一體化18F-FDG PET/MR圖像后處理與分析
1.3.1 健康志愿者PET/MRI定性和定量分析 定性分析:由1名資深核醫學科醫師和1名高年資放射科醫師共同完成,意見不同時經協商決定。定量分析:采用AW 4.7工作站對DWI圖像進行后處理獲得ADC圖,分別選取雙側額葉、頂葉、顳葉、枕葉為ROI,定量測量其平均ADC值(mean ADC value, ADCmean)、平均標準化攝取值(mean standardized uptake value, SUVmean)及最大標準化攝取值(maximum standardized uptake value, SUVmax)。
1.3.2 慢性缺血性腦血管病患者PET/MR圖像定性和定量分析 定性分析方法同前,觀察圖像中有無腦梗死灶,并觀察患者18F-FDG腦代謝情況以確定異常代謝區。定量分析:采用AW 4.7工作站圖像后處理軟件,在Flair序列圖像中勾畫腦梗死灶、梗死周圍區作為ROI,每個區域連續勾畫3個層面,將其復制到ADC圖及PET圖像中,分別測量ADCmean、SUVmean及SUVmax,并以鏡像法獲得ROI對側相應區域的ADCmean、SUVmean及SUVmax。
1.4 統計學分析 采用SPSS 19.0統計軟件對數據進行統計學分析。計量資料以±s表示,采用配對t檢驗比較健康志愿者左側與右側對稱腦區間及慢性缺血性腦血管病患者病變側與對側相應區域間ADCmean、SUVmean及SUVmax差異。P<0.05為差異有統計學意義。
2 結果
2.1 健康志愿者一體化18F-FDG PET/MR表現 10名健康志愿者MRI均未見異常表現;18F-FDG腦代謝圖均顯像清晰,雙側額葉、頂葉、顳葉、枕葉區域放射性分布對稱,見圖1;左側與右側額葉、頂葉、顳葉、枕葉ADCmean、SUVmean及SUVmax差異均無統計學意義(P均>0.05),見表1。
2.2 慢性缺血性腦血管病患者一體化18F-FDG PET/MR表現 17例中,5例為左側ICA閉塞,7例為右側ICA閉塞,4例左側MCA閉塞,1例為右側MCA閉塞;DWI、ADC圖顯示腦梗死區呈低信號,ADCmean明顯高于對側相應區域(P<0.01),梗死周圍區未見異常信號,但ADCmean仍高于對側相應區域(P<0.01),見圖2;腦梗死區18F-FDG腦代謝均明顯減低,SUVmean、SUVmax與對側相應區域比較均明顯減低(P均<0.01),腦梗死周圍區18F-FDG腦代謝輕度減低,但低于對側相應區域(P均<0.01),見表2。
表1 10名健康志愿者不同腦區左側與右側間ADCmean、SUVmean及SUVmax比較(±s)

表1 10名健康志愿者不同腦區左側與右側間ADCmean、SUVmean及SUVmax比較(±s)
側別額葉ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)頂葉ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)左側0.90±0.108.23±1.5813.53±2.410.93±0.108.61±1.6113.17±2.55右側0.88±0.098.42±1.5813.59±2.410.94±0.118.61±1.4913.09±2.44t值1.822-1.846-0.328-0.4351.0540.781P值0.0790.0750.7450.6670.3010.441側別顳葉ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)枕葉ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)左側0.83±0.067.18±1.3111.63±2.130.83±0.047.90±1.3312.92±2.34右側0.83±0.507.23±1.2011.37±1.890.83±0.048.07±1.5012.77±2.42t值-0.114-0.4901.6020.176-1.6601.001P值0.9100.6280.1200.8620.1080.325

圖1 健康志愿者,男,49歲,一體化18F-FDG PET/MR表現 T1WI(A)、T2WI(B)、Flair圖像(C)、DWI(D)、ADC圖(E)均未見異常信號,3D-TOF-MRA(F)未見血管狹窄、閉塞;18F-FDG腦代謝圖(G)、18F-FDG PET/MR融合圖像(H)顯示雙側大腦半球均未見明確代謝異常
3 討論
MR為腦缺血性病變最敏感的影像學檢查方法,聯合應用多參數序列成像可充分反映顱內解剖結構,有效評價顱內血管及病灶。PET是以代謝顯像為基礎,可反映人體生理、生化、化學傳遞的分子水平的影像診斷方法。一體化18F-FDG PET/MR實現了功能與解剖結構信息的同步獲取,與單純PET及MR檢查相比,可通過提供“一站式”診斷來增強便利性,縮短掃描時間,一次掃描收集多種生理信息(如灌注、代謝、氧合等),為臨床提供更加全面、細致的影像學診斷依據[5]。
腦缺血機制研究[6-7]發現,腦缺血時,最先發生的改變為腦血流減少和能量衰竭。本研究通過T1WI、T2WI、Flair序列、DWI及3D-TOF-MRA圖像獲取血管及顱內組織結構信息,其中MRA主要用以觀察顱內血管狹窄、閉塞范圍,有無代償增生血管、是否合并動脈瘤等;T1W、T2W、DWI及Flair序列主要用于分析顱內病變性質,判斷腦梗死部位及范圍。DWI對于在布朗運動中的水分子擴散過程敏感,已廣泛用于監測超急性期和急性期腦梗死的診斷及治療過程,可在卒中發生的數分鐘內可靠地檢出嚴重受損的缺血組織[8-9]。此外,基于DWI圖像可生成ADC圖并通過ADC值描述組織中水分子彌散速度,腦梗死急性期ADC值降低,而慢性期ADC值升高。Marks等[10]報道,慢性腦梗死區ADCmean值為(1.59±0.84)×10-3mm2/s。本研究慢性缺血性腦血管病患者均為單側ICA或MCA閉塞,且病程>1個月,病灶DWI表現為低信號,ADC圖中呈高信號,ADCmean為(1.44±0.44)×10-3mm2/s。
表2 慢性缺血性腦血管病(單側ICA或MCA閉塞)患者18F-FDG腦梗死區及腦梗死周圍區患側與對側相應區域間ADCmean、SUVmean及SUVmax比較(±s)
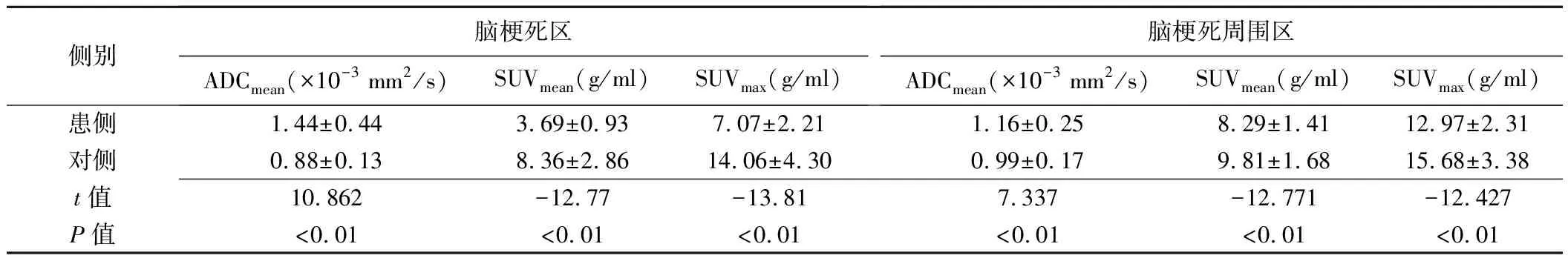
表2 慢性缺血性腦血管病(單側ICA或MCA閉塞)患者18F-FDG腦梗死區及腦梗死周圍區患側與對側相應區域間ADCmean、SUVmean及SUVmax比較(±s)
側別腦梗死區ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)腦梗死周圍區ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)患側1.44±0.443.69±0.937.07±2.211.16±0.258.29±1.4112.97±2.31對側0.88±0.138.36±2.8614.06±4.300.99±0.179.81±1.6815.68±3.38t值10.862-12.77-13.817.337-12.771-12.427P值<0.01<0.01<0.01<0.01<0.01<0.01
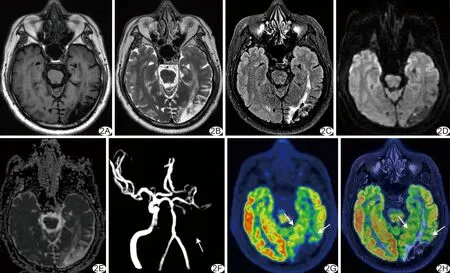
圖2 患者男,35歲,左側ICA閉塞,一體化18F-FDG PET/MR表現 T1WI(A)示左側顳枕葉低信號梗死灶,T2WI(B)、Flair圖(C)呈高或等信號,DWI(D)呈低信號,ADC圖(E)呈高信號,ADCmean為1.72×10-3 mm2/s,3D-TOF-MRA(F)顯示左側ICA閉塞(紅箭);18F-FDG 腦代謝圖(G)、18F-FDG PET/MR融合圖像(H)顯示腦梗死灶代謝明顯減低,SUVmean、SUVmax分別為4.97 g/ml和9.09 g/ml,梗死灶周圍區代謝輕度減低(白箭),SUVmean、SUVmax值分別為6.05 g/ml和10.74 g/ml
腦葡萄糖代謝是反映大腦供血及生理情況的有效指標,葡萄糖約占大腦能量來源的20%。18F-FDG與葡萄糖類似,可被大腦組織細胞吸收并轉化為6-磷酸-FDG滯留在細胞內,反映腦組織葡萄糖利用率和代謝情況。正常生理情況下,大腦各部位葡萄糖代謝呈對稱分布,13N-氨水定量腦血流量與18F-FDG反映的葡萄糖代謝均有很好的對稱性[11]。本組10名健康志愿者顱腦MRI均未見明顯異常表現,18F-FDG腦代謝顯像大腦不同腦區左側與右側代謝分布基本對稱,定量分析也顯示左側與右側間ADCmean、SUVmean及SUVmax差異均無統計學意義。研究[12]報道,發生腦梗死后梗死區域葡萄糖利用率明顯減低。腦梗死灶周圍區雖未發生形態、結構改變,但亦存在腦血流灌注減低,是發生腦梗死的高危區域[13]。腦血管狹窄、閉塞時,其供血區血流灌注減低,早期表現為輕度腦血流量降低,及時救治可避免腦梗死發生;出現腦血流量嚴重減低時,則進展為不可逆性腦梗死[14-15]。有學者[16]將MR檢查呈陰性但PET檢查呈陽性的區域定義為“貧乏灌注”區域,該區域腦組織尚未發生梗死,但如腦供血進一步下降將會引起不可逆腦梗死[17]。本研究分析17例單側ICA或MCA閉塞患者的一體化18F-FDG PET/MR圖像,發現MRI均顯示有明確梗死灶,且腦梗死區葡萄糖代謝明顯減低;同時梗死灶周圍區MRI雖未見明顯異常,但18F-FDG腦代謝定量分析顯示SUVmean及SUVmax均較對側相應區域代謝減低,提示需臨床干預。除SUVmean及SUVmax外,本組慢性缺血性腦梗死患者患側ADCmeam亦較對側相應區域明顯增高,可能為缺血導致微循環障礙、通透性增高、細胞外水分增多等原因所致,有待進一步研究。
綜上所述,一體化18F-FDG PET/MR可為診斷和評估慢性缺血性腦血管病提供全面、客觀的影像學依據,有助于臨床合理治療。

