VASH1和VASH2表達對食管鱗狀細胞癌患者預后的影響
程誠,鄭瑞峰,王彥威
武警河南省總隊醫院腫瘤內科,鄭州 450000
食管癌是中國常見的惡性腫瘤,與其他胃腸道腫瘤相比,食管癌的惡性程度較高,預后相對較差[1]。腫瘤新血管生成對腫瘤的生長、進展和遠處轉移均至關重要。因此,腫瘤新血管生成被認為是衡量腫瘤惡性程度的重要指標[2]。有研究顯示,腫瘤血管生成與食管癌的惡性程度呈正相關[3]。血管抑制蛋白(vasohibin,VASH)家族是一種新的血管生成負反饋調節因子,參與腫瘤的多種病理生理過程,主要由VASH1及其同系物VASH2兩個亞型組成,在血管生成的調節中具有重要作用,VASH1主要表達于血管內皮細胞,通過血管內皮生長因子(vascular endothelial growth factor,VEGF)和成纖維細胞生長因子2(fibroblast growth factor-2,FGF-2)等血管生成刺激因子誘導血管生成[4-5]。VASH2主要表達于腫瘤細胞和CD11b陽性單核細胞浸潤新生血管活躍的區域,有研究發現,VASH1、VASH2是與腫瘤血管生成、惡性腫瘤發生有關的預后因子[6-7],但關于其在食管鱗狀細胞癌(esophageal squamous cell carcinoma,ESCC)中作用的研究較少見。此外,關于ESCC組織中VASH1和VASH2表達的相關性及其與患者預后關系的研究較少見。本研究探討VASH1、VASH2表達與ESCC患者預后的關系,以期為ESCC患者預后的預測提供新的思路,現報道如下。
1 資料與方法
1.1 一般資料
選取2015年5月至2017年4月于武警河南省總隊醫院行根治性手術的ESCC患者。納入標準:符合《中國早期食管鱗狀細胞癌及癌前病變篩查與診治共識(2015年·北京)》[8]中的相關診斷標準,并經病理學檢查證實為ESCC;患者意識清晰,無聽力、認知及溝通障礙。排除標準:合并嚴重精神疾病;臨床資料不全;腫瘤已發生侵襲和轉移。根據納入和排除標準,本研究共納入209例ESCC患者,其年齡為42~69歲,平均年齡為(64.81±2.09)歲;男172例,女37例;腫瘤部位:上段21例,中段118例,下段70例;腫瘤直徑為23~64 mm,平均腫瘤直徑為(49.41±5.08)mm;分化程度:高分化65例,中分化100例,低分化44例;淋巴管侵犯:陰性45例,陽性164例;靜脈侵犯:陰性65例,陽性144例;浸潤性生長:a17例,b162例,c30例;pT分期:T1期85例,T2期37例,T3期87例;pN分期:N0期70例,N1期63例,N2期62例,N3期9例,N4期5例;淋巴結轉移枚數:2.71±0.62;pTNM分期:Ⅰ期46例,Ⅱ期76例,Ⅲ期82例,Ⅳ期5例;未接受過輔助化療者95例,接受過輔助化療者114例。所有患者均由同一組具備5年以上臨床經驗的醫師采用相同的手術方式進行治療,術后均行常規輔助治療。
1.2 免疫組織化學染色方法
手術標本采用10%甲醛溶液固定,石蠟包埋,蠟塊切成5 μm厚的切片。分離、水化后,120°C下蒸壓30 min,pH值為6.0。將樣品置于3%的氫過氧化物酶/甲醇中,阻斷內源性過氧化物酶的活性,室溫保存10 min。采用5%山羊血清于室溫下孵育10 min。抗VASH1抗體和抗VASH2抗體以1∶500稀釋和1∶100稀釋的抗CD34抗體為原始抗體,采用磷酸鹽緩沖液(phosphate buffered saline,PBS)洗滌后,4°C反應過夜,室溫下以組織纖維單色染色MAX(M)作為二抗,室溫下反應30 min。用3,3'-二氨基聯苯胺(diaminobenzidine,DAB)四鹽酸鹽和0.005%雙氧水在50 mmol/L的Tris-HCl緩沖液(pH7.5)中顯影,用蘇木精染色細胞核。用PBS代替原抗體作為CD34抗原、VASH1和VASH2的陰性對照。所有切片均進行HE染色。
1.3 MVD 計數標準
采用抗CD34抗體,使用免疫組化染色方法顯示腫瘤內微血管,對微血管密度最高的區域(熱點區域)進行低倍率(×40)掃視,選取5個微血管密度最高的熱點區域,用高放大倍率(×200,0.74 mm)計數5個區域染色的微血管數量,取其平均值表示MVD值,該熱點為VASH1陽性血管。MVD陽性表達定位于血管內皮細胞膜,呈棕褐色表達,陽性表達的單個內皮細胞或內皮細胞簇與鄰近血管、腫瘤細胞及其他結締組織成分清楚分開即為1個可計數的微血管,然后將每個熱點區域的血管數量轉換為每一平方毫米的數字,為微血管密度(microvessel density,MVD)值[9]。
1.4 染色結果判定標準
VASH1和VASH2陽性染色定位于細胞質,呈棕黃色顆粒沉淀,根據其陽性細胞所占百分比進行評分:陽性細胞所占百分比為0%計0分,1%~50%計1分,51%~100%計2分。
1.5 隨訪
每6個月對全部患者進行1次隨訪,隨訪截至2018年12月18日,隨訪內容包括內鏡、計算機斷層掃描(CT)、超聲檢查和血液檢測(檢測腫瘤標志物水平)。
1.6 統計學方法
采用SPSS 22.0軟件對數據進行統計分析,計數資料以例數和率(%)表示,組間比較采用χ2檢驗;計量資料以均數±標準差(±s)表示。采用Cox比例風險回歸模型對ESCC患者總生存期和無病生存期的影響因素進行單因素和多因素分析。以P<0.05為差異有統計學意義。
2 結果
2.1 ESCC 患者總生存期影響因素的單因素分析
單因素分析結果顯示,靜脈侵犯、pN分期、VASH1高表達和VASH2高表達均可能是ESCC患者總生存期的影響因素(P<0.05),而年齡、性別、腫瘤位置、腫瘤直徑、浸潤性生長情況、MVD值和輔助化療情況均可能與ESCC患者的總生存期無關(P>0.05)。(表1)
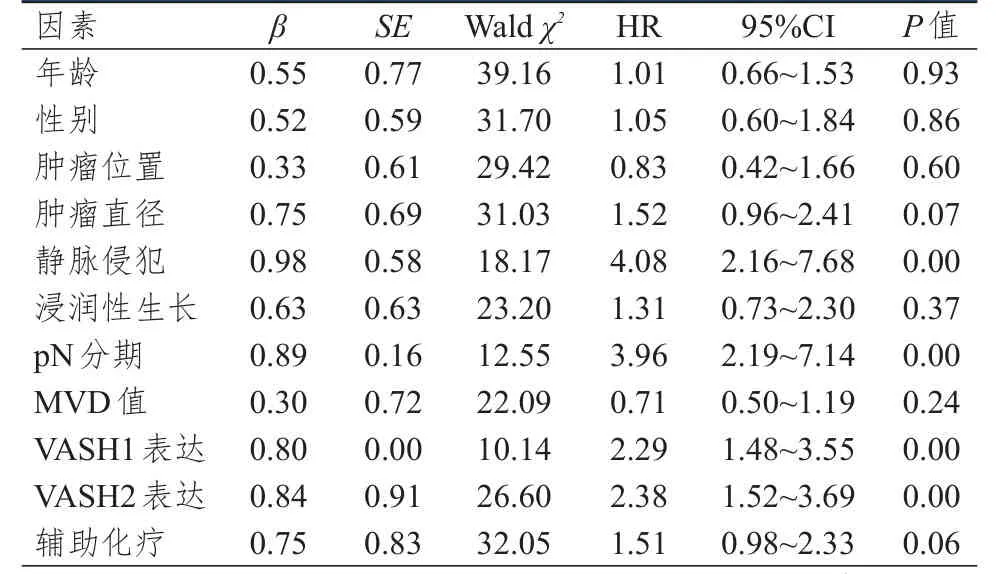
表1 ESCC患者總生存期影響因素的單因素分析
2.2 ESCC 患者總生存期影響因素的多因素分析
將單因素分析中差異有統計學意義的變量納入Cox比例風險回歸模型中進行多因素分析,結果顯示,靜脈侵犯陽性、pN分期為N1~4期、VASH1高表達和VASH2高表達均是ESCC患者總生存期的獨立危險因素(P<0.05)。(表2)
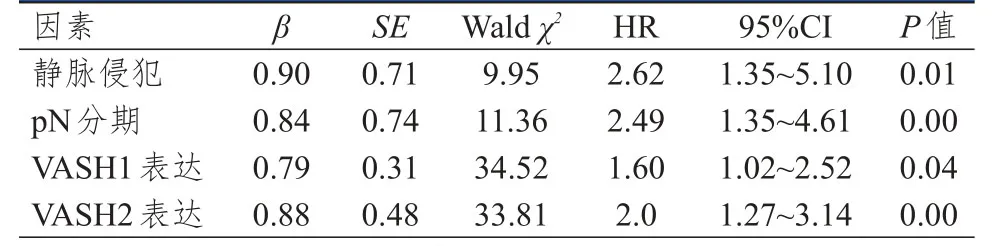
表2 ESCC患者總生存期影響因素的多因素分析
2.3 ESCC 患者無病生存期影響因素的單因素分析
單因素分析結果顯示,靜脈侵犯、pN分期和VASH1表達情況均可能是ESCC患者無病生存期的影響因素(P<0.05),年齡、性別、腫瘤位置、腫瘤直徑、浸潤性生長情況和MVD值均可能與ESCC患者的無病生存期無關(P>0.05)。(表3)
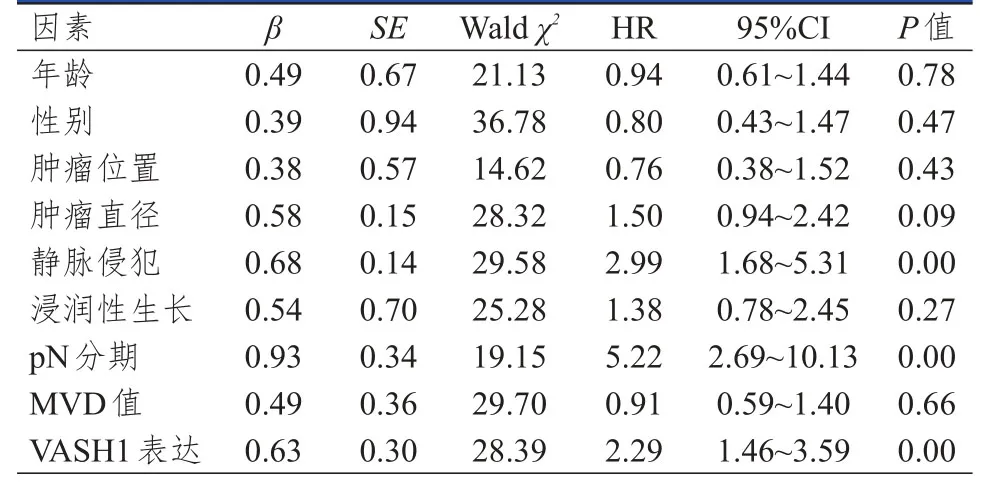
表3 ESCC患者無病生存期的單因素分析
2.4 ESCC患者無病生存期影響因素的多因素分析
將單因素分析中差異有統計學意義的變量納入Cox比例風險回歸模型中進行多因素分析,結果顯示,靜脈侵犯陽性、pN分期為N1~4期和VASH1高表達均是ESCC患者無病生存期的獨立危險因素(P<0.05)。(表4)
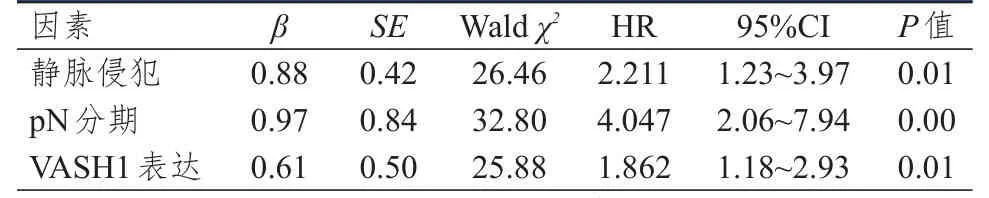
表4 ESCC患者無病生存期的多因素分析
3 討論
血管生成是指在現有血管的基礎上形成新的血管網絡的現象。腫瘤血管生成在腫瘤的發生發展和遠處轉移中起重要作用[10]。近年來,關于惡性腫瘤血管生成與患者預后的關系已有多篇報道,加速了血管生成抑制劑的發展和臨床應用。VASH1參與血管生成的抑制過程,有研究認為其不僅表達于生理性血管生成過程中,且表達于病理性血管生成的疾病中[11]。VASH1在乳腺癌、肝細胞癌、尿路上皮癌、前列腺癌、大腸癌、非小細胞肺癌、腎細胞癌和頭頸部鱗狀細胞癌等惡性腫瘤中均表達[12],VASH1高表達患者的預后較差。有研究顯示,VASH1蛋白陽性表達ESCC患者的中位生存時間明顯短于VASH1蛋白陰性表達患者,VASH1為ESCC患者預后的影響因素[13-14]。
本研究認為VASH1和VASH2表達可能能夠用于預測ESCC患者的預后。VASH1表達于血管生成部位的血管內皮細胞,CD34在新生和非新生的血管內皮細胞中均表達。基于此特點,可通過確定兩種血管類型的比例計算新生血管在所有血管中的比例,從而反映血管生成的活性。由于VASH1是一種血管生成抑制因子,高表達的VASH1可能能夠抑制血管的生成,從而改善患者預后。然而,亦有研究表明,VASH1過表達與患者的預后較差有關,這可能與VASH1是由VEGF和FGF-2誘導內皮細胞分泌的有關[15]。VASH1的強度與腫瘤細胞中VEGF的強度呈正相關,然而,VASH1在腫瘤微環境中分泌后會被降解和滅活。因此,VASH1在內皮細胞中的免疫組化染色結果可能并不能明確其抗血管生成的活性,而僅可反映內皮細胞對血管生成刺激的反應。基于此,VASH1高表達患者的抗血管生成活性高于VASH1低表達的患者。
VASH2是VASH1的同系物,是親血管生成因子。VASH2具有促進腫瘤血管生成和腫瘤生長的作用。VASH2高表達的胰腺導管腺癌患者的預后相對較差[16]。同樣,本研究中VASH2陽性表達ESCC患者的預后較差。關于VASH2在ESCC中的表達情況與預后關系的研究目前較少見[17],本研究為VASH2的研究提供了有價值參考依據。有研究發現,VASH2的自分泌和旁分泌作用模式可通過上調肝癌細胞中核因子-κB的表達從而促進FGF-2和VEGF的表達[18]。VASH2不僅可促進腫瘤血管的生成,還可促進腫瘤細胞的增殖。VASH2可通過調控轉化生長因子-β信號通路,促進腫瘤細胞發生上皮-間充質轉化,因此,VASH2還參與腫瘤細胞的侵襲和遷移等多種生物學行為,并影響患者的預后。有研究發現,ESCC組織中VASH1和VASH2的表達水平均未升高,惡性程度相對較低,患者預后較好[19-20]。
綜上所述,VASH1和VASH2高表達均是預測ESCC患者預后不良的獨立危險因素,聯合檢測VASH1和VASH2的表達情況有助于ESCC的臨床診治與預后預測。

