IVIM-DWI輔助DCE-MRI對良、惡性乳腺非腫塊樣強化病變的鑒別診斷價值
馬德晶,逯峰,鄒雪雪,陳亮,徐明露,范萬峰
動態增強磁共振成像(dynamic contrast enhanced magnetic imaging,DCE-MRI)是目前公認的診斷乳腺疾病的重要檢查手段,具有較高的診斷敏感性,但特異性相對較低[1]。擴散加權成像(DWI)技術作為一種輔助檢查手段,可以提高DCE-MRI對乳腺疾病的診斷特異性[2],但其參數(ADC)值包含了水分子擴散和微循環灌注信息,而體素內不相關運動擴散加權成像(intravoxel incoherent motion diffusion-weighted imaging,IVIM-DWI)技術可以分別反映水分子擴散及微循環灌注的信息[3]。既往有研究發現將IVIM-DWI作為一種輔助檢查手段,能夠較明顯地提高DCE-MRI對乳腺病變診斷的特異性,并且敏感性亦稍有提高 [4],但其未分析非腫塊樣強化病變的特點。本研究旨在探討IVIM-DWI作為一種輔助檢查手段在非腫塊樣強化的乳腺病變中對DCE-MRI診斷效能的影響。
材料與方法
1.臨床資料
回顧性分析2017年6月-2018年6月因乳腺病變在我院就診且MRI檢查顯示乳腺病變呈非腫塊樣強化的56例患者的影像學資料。均為女性患者,年齡21~65歲,平均(42.3±6.8)歲。納入標準:①MRI掃描前未行穿刺活檢或放化療等診療措施,并于MRI檢查后2周內行手術或穿刺活檢并獲得明確的病理結果;②乳腺內至少有一個病灶直徑大于1.0 cm。
最終入組的經病理證實的病灶共53個:良性病灶19個,惡性病灶34個。良性病變包括導管內乳頭狀瘤8個,肉芽腫性乳腺炎3個,漿細胞性乳腺炎和乳腺腺病4個;惡性病變包括浸潤性導管癌14個,導管原位癌13個,浸潤性小葉癌3個,浸潤性乳頭癌2個,基底樣癌腺和樣囊性癌各1個。
每例患者在檢查前簽署知情同意書,且本研究經我院醫學倫理委員會審查通過。
2.檢查方法
使用Siemens Magnetom Skyra 3.0T MR成像儀和4通道乳腺專用線圈。患者掃描時取俯臥位,雙乳自然下垂于線圈內。①常規掃描序列及參數:T1WI(TR 169 ms,TE 2.6 ms)、T2WI(TR 3500 ms,TE 69 ms)及脂肪抑制序列T2WI(TR 3200 ms,TE 69 ms),層厚4.0 mm,層間距0.4 mm,視野340 mm×340 mm,矩陣269×384,激勵次數2;②IVIM-DWI掃描:采用單次激發SE-EPI結合脂肪抑制技術,TR 6400 ms,TE 63 ms,層厚5 mm,層間距1 mm,視野340 mm×138 mm,矩陣192×78,選用12個b值(分別為0、50、100、150、200、250、300、400、600、800、1000和1200 s/mm2),在x、y、z軸3個方向上同時施擴散梯度,激勵次數分別為1、1、1、1、1、2、2、4、4、4、6和6,掃描時間13 min 40 s;③DCE-MRI掃描:采用梯度回波三維容積插值屏息掃描(volumetric interpolated breath-hold examination,VIBE)技術,共掃描8期(1期蒙片+7期增強),TR 4.49 ms,TE 1.68 ms,視野340 mm×340 mm,矩陣352×260,層厚1.2 mm,層間距0.24 mm,翻轉角10°,每期掃描時間約45 s;對比劑采用Gd-DTPA,流率2.5 mL/s,劑量0.2 mL/kg,然后以相同流率注射0.9%氯化鈉注射液20 mL沖管。
3.圖像分析和數據處理
所有圖像均由2位具有5年以上乳腺病變診斷經驗的放射科醫師采用雙盲法閱片,對兩位醫師的診斷結果(良、惡性的判別)進行一致性檢驗。為減少由于ROI選擇位置偏倚引起的測量誤差,所有數據均測量3次,取其平均值;ROI選取標準:盡量包括病灶所有的實質部分,并盡量避開病變內的囊變、壞死區。
利用MITK-Diffusion后處理軟件分析患者的IVIM-DWI數據,結合DCE-MRI在病灶內勾畫ROI(面積46.10~234.70 mm2),經MITK-Diffusion后處理軟件自動計算出ROI的灌注分數(f)、真擴散系數(D)值和假擴散系數(D*)值。
將DCE-MRI圖像傳至Syngo MMWP VE40B工作站。觀察病變的分布(線樣/葉段分布記為L1分,其它分別方式如局灶性、區域性、多區域性和彌漫性記為L0分)和強化方式(集叢樣或簇樣環形強化記為C1分,其它方式如均勻性或不均勻性強化記為C0分)。在病灶內選取ROI,面積5.00~10.00 mm2,利用Mean-Curve后處理軟件獲得ROI的時間-信號強度曲線(time-signal intensity curve,TIC)和最大增強斜率(maximum slope of increase,MSI),按照公式(1)或(2)計算MSI:

圖1 患者,女,49歲,左側乳腺導管原位癌。a)對比增強橫軸面抑脂T1WI,左乳外側份可見非腫塊樣不均勻強化病灶(箭),呈葉段分布;b)矢狀面抑脂T1WI動態增強圖像,顯示病灶位于乳腺偏上象限(箭),邊界不清,相鄰皮膚無明顯變化;c)TIC曲線呈平臺型(Ⅱ型);d)IVIM-DWI顯示病變呈稍高信號(箭);e)ADC圖示病灶呈等~稍低信號(箭);f)病理圖鏡下示腫瘤細胞增生局限于導管內,細胞形態較一致,腺泡外層的肌上皮細胞明顯,間質纖維細胞輕度增生(HE,×200)。
(1)

(2)
其中,SIpeak為增強后的最大信號強度;SI0為初始信號強度(即平掃SI),SIend及SIprior分別代表曲線上升段信號強度變化最大的兩個相鄰掃描時相的信號強度,Tend及Tprior分別表示相應的時間點[5]。
根據病灶的信號強化率(the slope of signal intensity,SIslope),將TIC分為3型:Ⅰ型為緩升型,SIslope>10%;Ⅱ型為平臺型,-10%≤SIslope≤10%;Ⅲ型為流出型,SIslope<-10%。本研究中將Ⅰ型TIC記為0分,Ⅱ型和Ⅲ型均記為1分。
4.統計分析
使用SPSS 19.0統計軟件,首先采用Kappa一致性檢驗分析兩位醫師診斷結果的一致性。其它定量參數均應用Shapiro-Wilktest法進行正態性檢驗,符合正態分布者以均數±標準差來描述,并采用兩獨立樣本t檢驗進行分析;不符合正態分布的定量資料,采用中位數和四分位數間距進行描述,組間比較采用Wilcoxon秩和檢驗;定性資料的統計描述采用例數(構成比)的方式進行,組間比較采用χ2檢驗。以P<0.05為差異具有統計學意義。然后采用Logistic回歸分析確定單獨應用DCE-MRI及DCE-MRI聯合IVIM-DWI對鑒別乳腺良惡性病變的獨立影響因素。以病理結果為金標準,繪制二者的ROC曲線,分析單獨應用DCE-MRI檢查、DCE-MRI與IVIM-DWI聯合應用對良、惡性乳腺病變的鑒別診斷效能。
結 果
1.兩位醫師診斷結果一致性
對兩位醫師診斷結果的一致性進行檢驗,詳細結果見表1。統計分析結果顯示:不論是單獨分析DCE-MRI圖像還是綜合分析DCE-MRI和IVIM-DWI圖像,兩位醫師診斷病變的良、惡性均具有較好的一致性(Kappa值分別為0.797和0.918)。
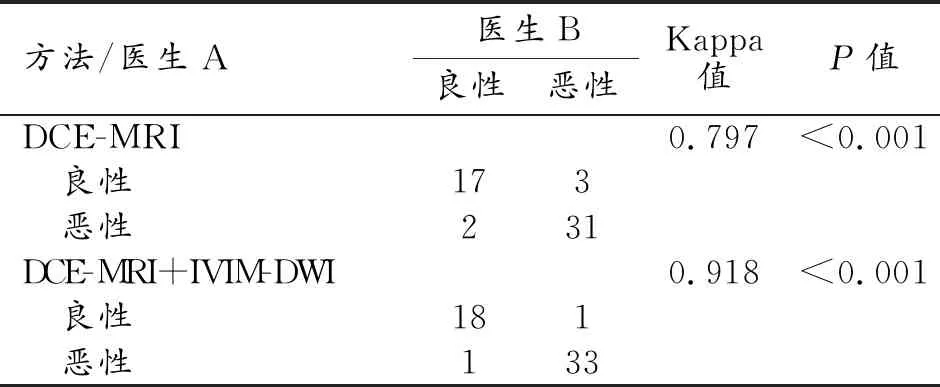
表1 兩位醫師診斷結果一致性分析 (個)
2.良惡性病變各指標的比較
良、惡性病變各征象的評估和各參數的測量值及統計分析結果見表2。
惡性組中乳腺病變呈線樣/葉段分布(圖1)和集叢樣/簇樣環形強化的出現率均明顯高于良性組,組間差異均有統計學意義(P<0.05)。良、惡性組間MSI的差異無統計學意義(P>0.05)。惡性組中TIC曲線以Ⅱ、Ⅲ型多見,良性組中Ⅰ型與Ⅱ、Ⅲ型(圖2)的出現率接近,良惡性組間TIC曲線類型的差異有統計學意義(P<0.05)。
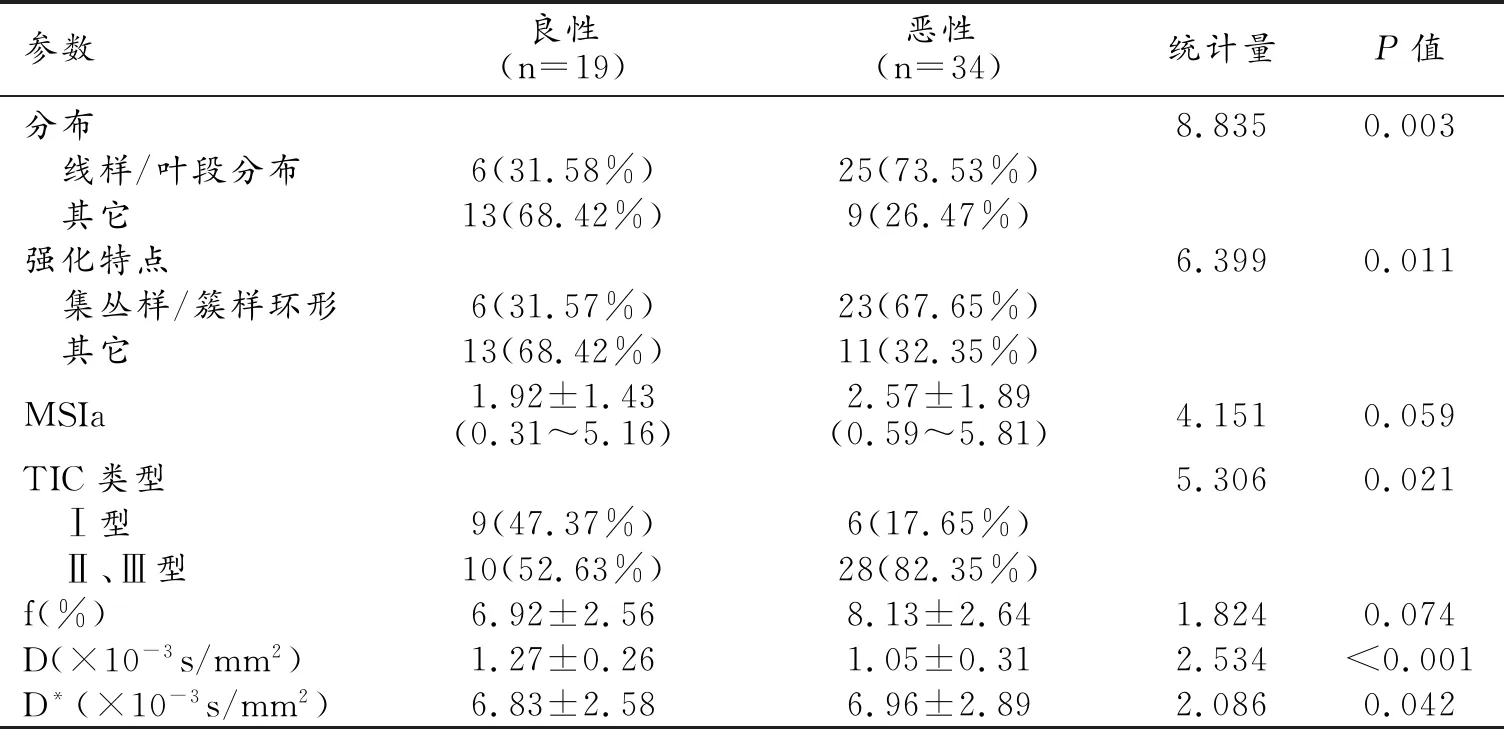
表2 良惡性病變DCE-MRI及IVIM-DWI各參數比較 (個)
注:a相應指標值采用中位數±四分位間距表示。

表3 兩種診斷方法的Logistic回歸方程的診斷效能

圖2 患者,女,27歲,左側乳腺肉芽腫性乳腺炎。a)對比增強橫軸面抑脂T1WI,顯示左乳內側非腫塊樣明顯強化灶(箭),呈區域分布,不均勻強化;b)對比增強矢狀面抑脂T1WI,顯示病灶位于乳腺偏下部,病灶邊緣不清(箭),左乳皮膚局部增厚并可見凹陷;c)TIC曲線呈流出型(Ⅲ型);d)IVIM-DWI顯示病灶呈較高信號(箭);e)ADC圖像顯示病變區呈較低信號(箭);f)病理圖鏡下示結節狀病灶內可見多量泡沫細胞及多核巨細胞,并伴有淋巴細胞和漿細胞浸潤(HE,×200)。
惡性組中乳腺病變的f值和D*值均高于良性組,兩組間D*值的差異有統計學意義(P<0.05),但f值的差異無統計學意義(P>0.05);惡性組中乳腺病變的D值低于良性組,差異有統計學意義(P<0.05)。
3.各方法的診斷效能
將良、惡性組間有統計學差異的指標納入Logis-tic回歸分析,分別建立DCE-MRI及DCE-MRI聯合IVIM-DWI診斷非腫塊樣強化乳腺良惡性病變的Logistic回歸方程(P3,P4),分別為:

圖3 DCE-MRI和DCE-MRI聯合IVIM-DWI診斷良、惡性乳腺病變的ROC曲線圖。
P3=-4.242+4.211×L+2.722×C+2.568×TIC類型
(3)
P4=2.946+1.190×L+0.591×C+2.582×TIC類型-2.938×D
(4)
當P>0.5時診斷為惡性病變,P≤0.5時診斷為良性病變。根據所建立的Logistic方程,兩種診斷方法的診斷效能相關指標值見表3。以建立的方程判斷乳腺良惡性病變的預測值來繪制ROC曲線,曲線下面積分別為0.783和0.824(圖3)。
討 論
2017年《乳腺磁共振檢查及診斷規范專家共識》指出,在臨床工作中對乳腺病變性質的判斷需要結合病變的形態、強化特點、MSI和TIC曲線等信息進行綜合分析[6]。2013年美國放射學會(American College of Radiology,ACR)修訂的BI-RADS MRI對NME病變的分布特征的描述分為局灶性、線樣、葉段性、區域性、多區域性及彌漫性分布6種類型;內部強化方式包括均勻性、不均勻、集叢樣及簇樣環形強化這4種類型。以往有研究顯示,非腫塊樣強化的病變中線樣及葉段型分布多見于惡性病變中,并且其對乳腺癌的診斷有較高的特異性[7]。本研究中,惡性病變組線樣/葉段分布的病例所占比例為73.53%、而良性組中其比例為31.58%,與以往的研究結果基本相符。以往有國外學者在對非腫塊樣強化病變的研究中發現63%的惡性病變中出現成簇小環形強化,其鑒別惡性腫瘤的特異度高達96%[8]。本研究中,34個惡性病變中23個(67.65%)出現集叢/簇環樣強化,而19個良性病變中僅6個(31.57%)出現這種強化方式,這種強化方式在惡性病變中出現比率與以往的研究結果基本相一致,但特異度較上述學者研究低[7-8]。分析原因是由于本組良性病變中出現集叢/簇環強化的比例較之前研究高,可能是由于本組非腫塊樣強化的良性病變中有較多肉芽腫性乳腺炎及漿細胞性乳腺炎的病例,其在膿腫形成時期易形成近似簇環形強化方式[9]。
Smith等[10]的研究結果顯示,TIC曲線具有較大的鑒別乳腺病變良、惡性的價值。本研究中惡性組TIC曲線以Ⅱ、Ⅲ型為主,比例達82.35%,這與以往的研究結論均相符[11-12]。但良性病變中Ⅱ、Ⅲ型TIC曲線的比例亦高達52.63%,分析原因可能是TIC曲線反映病變的血供情況,與病變微循環中血管密度、毛細血管壁的通透性及腫瘤間質的壓力等因素均有關,由于本組19個良性病例中乳腺炎病例有7個,其中包括漿細胞性乳腺炎及肉芽腫性乳腺炎,而炎性病變的實性部分血供較豐富,能夠呈現Ⅱ型甚至Ⅲ型TIC曲線,由此導致Ⅱ、Ⅲ型曲線類型在非腫塊樣強化的良性病變中所占比例亦較高。本研究中良惡性組間MSI的差異無統計學意義(P>0.05),分析原因可能是由于乳腺病灶增強速度與病變的血管化程度相關,部分血供豐富的乳腺良性腫瘤,信號增強上升顯著,與惡性病變之間存在重疊有關。
在IVIM-DWI參數方面,惡性乳腺病變組的D值低于良性組,f值、D*值高于良性病變,與Louisa等[13]報道的結果基本一致;且通常非腫塊樣強化的病灶,其D值較腫塊樣強化的病變偏高[14],分析原因可能是由于非腫塊樣強化的病變無明確的邊界,病變區域內有少許乳腺組織參雜其中,在選取ROI的時候,不可避免的會包括進去,導致所測量的ROI值并不如腫塊樣強化的病變準確。f值和D*值主要反映血流灌注信息,大部分惡性腫瘤的血流灌注較豐富,與良性病變組間存在差異,但是需要注意的是部分良性病變血流灌注亦可較豐富(如纖維腺瘤、炎性病變等),與惡性病變之間存在重疊。
Logistic回歸分析將病變的分布特征、強化特點、TIC類型均納入診斷乳腺良惡性病變的方程。由于本組病變中,線樣/葉段分布及集叢/簇樣強化對惡性病變的診斷特異度非常高,并且本組病例中浸潤性導管癌、導管原位癌所占比例較大,導致這種差異更加明顯,因此其均能被納入方程。TIC曲線被納入回歸方程的原因可能是良惡性病變血管系統相關結構存在差異[15],惡性腫瘤血管通透性高,存在動-靜脈分流,對比劑流經病灶進入間質的量少,經靜脈迅速流出的量多,TIC多為平臺型或流出型[10];而良性腫瘤血管發育相對成熟,對比劑進入間質的量多,經靜脈流出的量少,TIC多為緩升型。本研究中DCE-MRI的診斷敏感度、特異度、符合率、陽性和陰性預測值分別為88.24%、68.42%、81.13%、79.49%和80.75%;由此可見其敏感性較高,但特異性較低。
DCE-MRI與IVIM-DWI聯合鑒別診斷乳腺病變良惡性,納入Logistic回歸方程的獨立影響因素為病變分布、強化特點、TIC類型及D值,其診斷敏感度、特異度、準確率、陽性和陰性預測值分別為91.18%、73.68%、84.91%、83.35%和85.24%,較單獨應用DCE-MRI的診斷效能有提高,尤其是診斷特異度有明顯提高。由此可見在非腫塊樣強化的乳腺病變中IVIM-DWI也可為乳腺良惡性病變的鑒別診斷提供有價值的信息,臨床工作中可以將二者聯合應用于乳腺良、惡性病變的鑒別診斷中。

