不同入路腹腔鏡下腎部分切除術治療早期腎癌臨床對比研究*
韓生祿,劉海蓮,付德來,趙留存,楊 勇, 楊京可,周克斌,董小鑫
1.西安市第九醫院泌尿外科(西安 710054);2.西安市工會醫院兒科(西安710100);3.西安交通大學第二附屬醫院泌尿外科(西安710004)
腎癌是泌尿外科發病率僅次于膀胱癌的占位性病變,占常見惡性腫瘤的2%~3%[1]。腎癌在各個年齡段均有發生,嚴重威脅者患者生命安全[2]。近年來,隨著醫療器械的更新換代及診療技術的提高,約60%腎癌可在早期被確診[3]。腎癌病灶局部手術切除是早期腎癌推薦治療方案。傳統開腹式局部病灶切除術因創傷大,易發生切口感染等,導致其應用受限制[4]。隨著腔鏡器械的迅速發展,臨床醫師對腹腔鏡下手術操作越來越嫻熟,使得其在泌尿外科治療中的應用逐漸普及[5]。雖然腹腔鏡下腎部分切除術在早期腎癌治療中療效明確,但關于何種手術效果更佳目前尚無明確定論。本研究就經腹入路和后腹入路兩種腹腔鏡下腎部分切除術入路在直徑≤4 cm早期腎癌病灶清除中的可行性進行對比分析。現將分析結果報告如下。
資料與方法
1 一般資料 選擇2016年3月至2019年5月在西安交通大學第二附屬醫院和西安市第九醫院接受腎部分切除治療的早期腎癌患者40例為研究對象。納入標注:經B超、CT和病理學檢查確診為腎癌,TNM分期為T1N0M0;病灶直徑≤4 cm;術前血肌酐、尿素氮等腎功能指標正常;具有腹腔鏡下腎部分切除術適應證;術前未接受過放化療或其它腫瘤相關性治療。排除標準:TNM其它分期;影像學檢查存在明顯淋巴結遠處轉移;心、肝、肺功能嚴重異常;伴發其它臟器腫瘤;不愿參與研究,或中途退出研究。隨機抽簽法對納入者分組。后腹腔組20例中男13例,女7例;年齡23~77歲,平均(46.59±5.27)歲;發病部位:左腎14例、右腎6例;腫瘤類型:外生型腎周腫瘤13例、中央型7例;腫瘤直徑1.07~3.97 cm,平均(3.05±1.11)cm。經腹腔組20例中男15例,女5例;年齡25~75歲,平均(46.85±5.23)歲;發病部位:左腎11例、右腎9例;腫瘤類型:外生型腎周腫瘤14例、中央型6例;腫瘤直徑1.15~3.82 cm,平均(3.14±1.07)cm。兩組腫瘤患者上述基線資料間比較差異無統計學意義(P>0.05),具有可比性。
2 手術方法
2.1 后腹腔組:患者接受腹腔鏡下經后腹腔進入的腎部分切除手術。全身麻醉,氣管插管,麻醉成功后,導尿,取健側臥位,常規消毒鋪巾。在腋后線肋緣下做長度約2 cm的切口,使用血管鉗對腰背筋膜進行鈍性分離,手指擴張,置入氣囊,注入氣體約500 ml,置入10 mm Trocar,以觀察腹膜間隙的擴張情況;如筋膜間隙擴張充分,則分別在腋前線平髂嵴部位、腋前線肋緣下約2 cm和腋中線髂嵴上方約2 cm處穿刺,并分別置入10 m、5 mm和10 mm的Trocar;隨后沿腰大肌向頭側逐步分離,依次打開Gerota和腎周的脂肪囊;采用超聲刀對腎臟進行緩慢游離(注意保留腫瘤表面的脂肪),游離腎門部位的腎動靜脈及輸尿管,置入Bulldog夾,并通過Bulldog夾阻斷患者腎臟動脈血供,并開始計時,待腎實質顏色變淺,則使用超聲刀沿腫瘤外周0.5 cm處切除腫瘤組織。病灶切除后確定患者集合系統是否受損,若出現損傷,則需采用3-0可吸收縫合線對其進行縫合,淺表腎實質單獨采用2-0可吸收縫合線再連續縫合一層。松開腎臟動脈Bulldog夾,并計時,檢查有無明顯出血,去除腫瘤切除物,留置腹膜后引流管,并逐步關閉切口。
2.2 經腹腔組:患者接受腹腔鏡下經腹腔進入的腎部分切除手術。全身麻醉,氣管插管,麻醉成功后,導尿,取斜仰臥位,常規消毒鋪巾。在腹直肌旁切開皮膚約1 cm,穿刺置氣腹成功后(壓力15 mmHg),進入12 mm Trocar及腹腔鏡,監視下分別于腋前線臍上3 cm、鎖骨中線肋緣下、腋中線臍上4 cm處置入10 mm、5 mm、5 mm Trocar,置入相應腹腔鏡手術器械。切開升(降)結腸旁溝側腹膜,向下游離結腸和腸系膜,依次打開Gerota和腎周的脂肪囊;其余操作步驟與后腹組基本相同,不同之處僅在于游離腎蒂時,無需對腎動靜脈進行游離,只需在阻斷腎血管時,使用Satinsky鉗阻斷腎動靜脈即可。
3 觀察指標 ①記錄兩組術中熱缺血時間、術中失血量、手術時間、腫瘤重量、術后飲食恢復時間、住院時間及圍術期并發癥發生情況;②測定兩組術前和術后應激反應指標白細胞計數(WBC)、C反應蛋白(CRP)和皮質醇水平;③統計兩組術后腫瘤切緣組織冷凍切片和切除組織病理檢查結果、隨訪情況。

結 果
1 兩組腫瘤患者術中和術后基本情況比較 見表1。兩組腫瘤患者均順利完成腎部分切除手術治療。治療過程中,后腹腔組和經腹腔組熱缺血時間、術中失血量、腫瘤重量間比較差異無統計學意義(P>0.05);但后腹腔組手術時間、術后飲食恢復時間和住院時間明顯短于經腹腔組(P<0.05)。
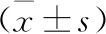
表1 兩組腫瘤患者術中和術后基本情況比較
注:與后腹腔組比,*P<0.05
2 兩組圍術期并發癥發生情況比較 后腹腔組術中1例發生腸梗阻,1例術后出現肋腹部神經痛,總并發癥發生率為10%;經腹腔組術中1例發生應激性潰瘍,并發癥發生率僅為5%。兩組圍術期并發癥發生率比較差異無統計學意義(P>0.05)。
3 兩組手術治療前后血清應激反應指標變化比較 見表2。術前,兩組腫瘤患者應激反應指標WBC、CRP和皮質醇水平間比較差異無統計學意義(P>0.05)。治療后,后腹腔組WBC、CRP和皮質醇水平均明顯低于經腹組(P<0.05)。
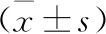
表2 兩組手術治療前后血清應激反應指標變化比較
注:與術前比,*P<0.05;與后腹組比,#P<0.05
4 兩組術后病理檢查及隨訪情況比較 后腹組術中切緣冷凍切片均為陰性。病理診斷結果:透明細胞癌11例、腎錯構癌4例、乳頭狀癌3例、嫌色細胞癌1例、集合管癌1例。術后隨訪5~37個月,術后24個月復查時1例影像學檢查顯示腫瘤復發,而接受腎癌根治治療,其余均無腫瘤復發,且腎功能檢查正常。經腹組術中切緣冷凍切片同樣均為陰性。病理診斷結果:透明細胞癌9例、腎錯構癌3例、乳頭狀癌5例、腎小細胞癌2例、嫌色細胞癌1例。術后隨訪8~36個月,隨訪期間均無腫瘤復發病例出現,且患者腎功能檢查無明顯異常。兩組術后隨訪腫瘤復發率間差異無統計學意義(P>0.05)。
討 論
腹腔鏡下手術切除治療已成為臨床治療腎癌的首選方案。大量臨床報道及臨床實踐證實,在直徑≤4 cm的腎癌手術治療中,腹腔鏡下腎部分切除術效果較開放式手術切除治療效果更優[6-8]。分析原因:腹腔鏡下操作,不僅可多角度觀察病灶,且腹腔鏡的放大功效,可使術中組織剝離及病灶切除更徹底準確,降低術中對病灶周圍組織及神經的損傷概率,減小術中并發癥發生率;同時,術中可使用超聲刀等醫療器械實現組織的快速剝離和病灶的快速切除、止血,從而縮短手術時間和術中出血量,有助于患者術后腸功能恢復及總體康復,提高患者生存質量,且患者無腫瘤生存期與傳統開放式手術相當。
腹腔鏡下腎部分切除術已成為保留腎單位的常規腎癌治療術式。然而,在實際手術操作過程中,常因腫瘤大小、位置、浸潤程度及操作者技能經驗等,選擇不同的手術入路[9-10]。經腹腔和經后腹腔是腎癌治療中常用的兩種手術入路。通常認為,經腹腔入路腎癌治療具有操作空間大、解剖學標志明確、立體感強、手術技巧容易掌握等優勢,但存在組織分離操作多,腹腔干擾大,術后易并發腹膜炎及各類腸道并發癥等缺點[11];經后腹腔入路可直接進入操作視野,腎動靜脈游離簡單,腹腔干擾少,引流物的局限性可避免腫瘤種植和腹腔污染,但也存在操作空間小,解剖學標志物缺乏立體感,手術技巧不易掌握等缺點[12]。然而無論是何種手術入路,其成功關鍵在于在有限的腎動靜脈血管阻斷時間內完成腎腫瘤的切除、縫合。以往有報道顯示,腹腔鏡下腎部分切除術中熱缺血時間>40 min,則患者術后腎小球濾過率明顯下降,腎功能損傷發生率明顯升高[13]。本研究結果顯示,兩組熱缺血時間、術中失血量、腫瘤重量間、圍術期并發癥及隨訪復發率方面比較差異無統計學意義(P>0.05),術后隨訪,切緣組織冷凍切片均為陰性。表明,兩種手術入路在腎部分切除治療中均具有可行性和安全性,該結果與趙軍等報道結果相吻合[14]。腎動靜脈的阻斷可為手術操作提供一個相對的無血環境,不僅有助于提高腫瘤切除的精確度和切緣陰性率,同時有助于腎實質的重建。然而,腎血管阻斷時間過長則會導致腎臟缺血再灌注損傷發生,甚至出現一側腎功能衰竭或腎萎縮。同時,本研究發現,后腹組手術時間、術后飲食恢復時間和住院時間明顯短于經腹組,患者術后血清WBC、CRP和皮質醇等應激反應指標表達水平明顯低于經腹組(P<0.05)。表明,在早期腎癌腎部分切除手術治療中,后腹腔入路具有在縮短手術時間、降低術中應激刺激,加速患者術后康復等方面更具優勢。分析其原因:經后腹腔入路手術操作過程中無需對側腹膜和后腹膜進行充分剝離即可直接進入術野,對臟器周圍組織的創傷和干擾相對較小,且本研究中進行經后腹腔手術入路腎部分切除手術操作的醫師均具有豐富的臨床經驗及扎實的腎臟解剖學基礎,因此術中操作時間短,且對機體應激刺激[15]和腸道刺激小,患者術后恢復快。
綜上所述,直徑≤4 cm的早期腎癌患者腹腔鏡下腎部分切除術治療中,后腹腔入路和經腹強入路均具有良好有效性和安全性,但經后腹腔入路手術時間短,機體應激刺激小,患者術后康復快。

