穗花狐尾藻對沉積物微生態受阿特拉津脅迫的緩解作用
瞿夢潔,李娜,劉廣龍,李慧冬,3,劉偉,朱端衛,2,*
1. 華中農業大學資源與環境學院生態與環境工程研究室,武漢 430070 2. 生豬健康養殖協同創新中心,武漢 430070 3. 山東省農業科學院農業質量標準與檢測技術研究所,濟南 250100 4. 齊魯工業大學(山東省科學院),山東省分析測試中心,山東省中藥質量控制技術重點實驗室,濟南 250014
阿特拉津是多種禾本科作物種植過程中廣泛使用的選擇性內吸傳導型除草劑[1]。約5%的阿特拉津會隨地表徑流進入水生系統[2-3],一旦其被水體沉積物吸附,就很難從中釋放[4]。美國Olentangy河流域沉積物中阿特拉津的半衰期最長可達6~7周,超過了該濕地的水力停留時間[5]。阿特拉津在被其污染的湖泊沉積物中降解半衰期達到14.3 d,稍高于濕地沉積物中阿特拉津半衰期9.72 d[4,6]。水生植物對阿特拉津具有一定抗性,菖蒲、千屈菜和水蔥能在阿特拉津濃度<8.0 mg·L-1的培養液中存活[7]。在根系分泌物的作用下,有機污染物在根際環境中的代謝行為不同于非根際環境[8]。沉積物中阿特拉津殘留可能會對根際微生物繁衍造成一定影響,其生態風險有待進一步評價。
微生物是污染土壤/沉積物生態環境的敏感指示物[9-10],在降解土壤/沉積物中污染物的同時,其本身生理生化活性、代謝過程和多樣性也受到不同程度的影響[11]。植物根系能促進微生物生長,產生特定的根際細菌群落,使得根際沉積物中微生物數量遠多于非根際沉積物[12-13]。對比空白土壤,種植了狼尾草土壤中阿特拉津和西瑪津的降解率更高,相關微生物生物量和脫氫酶活性與對照相比均呈顯著增長,其中,節細菌屬(Arthrobactersp.)-DNS10菌株被證明能有效地去除根際的阿特拉津[14-15]。因此,在阿特拉津脅迫下,研究沉水植物根際微環境變化并對相關細菌進行篩選與鑒定,可以為評估水體中阿特拉津的生態風險提供依據。
穗花狐尾藻是長江中下游湖泊中最常見的一種沉水植物,屬夏季優勢種[16]。本研究選擇穗花狐尾藻為供試植物,進行生物模擬實驗,試圖考察:(1) 阿特拉津對根際和非根際沉積物生理生化性質的影響;(2) 阿特拉津對沉水植物根際細菌數量的影響;(3) 在根際和非根際沉積物中阿特拉津降解菌的篩選與鑒定基礎上,測定其對阿特拉津的降解率。
1 材料與方法(Materials and methods)
1.1 供試材料
供試沉積物:采自武漢市洪山區南湖(30°28'23.52"N;114°22'9.81"E)。沉積物采回后過10目篩,以去除各種雜質,覆水靜置備用。沉積物pH值為7.47,有機質含量為54.91 g·kg-1,陽離子交換量為3.48 cmol·kg-1。
供試植物:沉水植物穗花狐尾藻采自武漢市植物園,將自來水經太陽暴曬30 min去除次氯酸對植物生長的影響,選用生長狀態良好的成熟植株放入水中馴化備用。
試驗培養箱:用345 mm×220 mm×60 mm (長×寬×高)的聚丙烯盆種植植物,再將盆置于550 mm×450 mm×350 mm (長×寬×高)的聚丙烯水箱模擬天然水體環境。
阿特拉津:標準品購于德國Dr. Ehrenstorfer公司,純度≥99.5%;稱取100 mg阿特拉津,溶于1 L甲醇,配制成100 mg·L-1的阿特拉津的甲醇溶液。
超凈工作臺:SW-CJ-2FD雙人單面凈化工作臺(中國智凈凈化設備有限公司)。
1.2 試驗設計
為使阿特拉津對微生物保持高濃度的逆境脅迫,定量得到微生物對阿特拉津的響應數據,配制100 mg·L-1的阿特拉津的甲醇溶液,取480 mL溶液至24 kg沉積物中,機械混合,使沉積物中阿特拉津濃度達到2.0 mg·kg-1。與此同時,取240 mL純甲醇溶液至12 kg沉積物中機械混合待用。模擬試驗采用如下3個處理:(1) 空白沉積物處理(空白處理,CK);(2) 沉積物中添加阿特拉津,未種植沉水植物(非根際沉積物處理,AT);(3) 沉積物中添加阿特拉津,種植穗花狐尾藻(根際沉積物處理,AT-P)。
取9個培養箱,每組處理設置3個平行培養箱。根據上述處理,分別在每個培養箱中放置4個塑料盆,每個塑料盆中加入1 kg沉積物,虹吸法加入50 L暴曬后的自來水進行培養,并定期補充上覆水抵消蒸發。AT處理的培養箱中所取沉積物視為非根際沉積物;AT-P處理培養箱中均勻種植60株株長20 cm的穗花狐尾藻,將其根系黏著沉積物視為根際沉積物。試驗運行60 d,每隔15 d取各自沉積物樣品。每次取樣后將取出的塑料盆中的沉積物和植物樣丟棄,不再放回培養箱。
1.3 測定方法
1.3.1 沉積物理化性狀測定
沉積物可溶性有機碳(DOC)測定釆用超純水浸提(m(土)∶m(水)=1∶5),25 ℃振蕩30 min后,在3 500 r·min-1下離心20 min,上清液過0.45 μm有機濾膜后用Varia TOC cube總有機碳分析儀(德國Elementar公司)進行測定[17]。沉積物可溶性硝態氮和銨態氮采用1 mol·L-1KCl浸提(m(土)∶m(水)=1∶5),25 ℃振蕩30 min后,在3 500 r·min-1下離心20 min,上清液過0.45 μm有機濾膜后用AA3全自動連續流動分析儀(德國SEAL Analytical GmbH公司)進行測定[18]。
1.3.2 沉積物中脫氫酶活性測定
稱取4 g沉積物于試管中,加入2 mL氯化三苯基四氮唑(TTC)溶液(體積分數為1%)和2 mL葡萄糖溶液(體積分數為1%)搖勻,同時每個處理用2 mL三羥甲基氨基甲烷緩沖液代替TTC作為對照。將試管于恒溫箱暗室37 ℃培養24 h,加甲醇20 mL,移入50 mL三角瓶振蕩1 h后過濾,取濾液測定脫氫酶活性(mg·(kg·d)-1)[19]。
1.3.3 沉積物中細菌數量測定
稱取2 g沉積物于滅菌離心管中,添加無菌水配制成稀釋度為10-1的懸液,于30 ℃下振蕩混勻1 h,再配制成稀釋度為10-2、10-3、10-4、10-5和10-6的系列懸浮液,移取0.1 mL接種于盛有滅菌培養基的培養皿中,涂布均勻。每個濃度梯度設置3個重復,于30 ℃培養。細菌的數量分別以每克沉積物中細菌數量的對數計[20]。
1.3.4 沉積物中阿特拉津降解菌篩選
稱取沉積物鮮樣5 g于含有45 mL無菌水的三角瓶中,在25 ℃、150 r·min-1轉速下振蕩1 h,吸取1 mL沉積物懸液用于梯度稀釋,涂布于基礎無機鹽培養基平板,該培養基以阿特拉津為唯一氮源。將平板放在25 ℃培養箱中培養至有菌落產生,挑取菌落在LB培養基上進行劃線純化,再將其轉接至液體無機鹽培養基中培養。
1.3.5 沉積物中阿特拉津降解菌的鑒定
以菌株基因組DNA為模板,對其16S rRNA基因進行克隆和分析。16S rRNA的PCR引物為:27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’),PCR擴增條件為:95 ℃預變性2 min,95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸90 s,共35個循環,最終72 ℃延伸10 min[21]。使用1%瓊脂糖凝膠電泳檢測擴增產物大小并用試劑盒純化PCR產物,純化后的產物送至上海美吉生物公司測定全長序列。序列在NCBI網站中的GeneBank數據庫比對,使用MEGA 6.0軟件中的Neighbor-Joining法對菌株的16S rRNA基因序列構建系統發育樹,并通過1 000次重抽樣(bootstrap)來評估所得結果的可靠性。
1.4 數據處理和分析
各項指標測定每處理重復3次。用OriginPro 8.5和SPSS 18.0軟件進行繪圖及統計分析,所有結果均表示為平均值±標準差(mean±SD),方差分析采用Tukey顯著性檢驗,當不同處理間有顯著差異時,先標注最小值,圖中誤差線表示標準差。
2 結果(Results)
2.1 沉積物中DOC含量變化
沉積物中DOC含量會隨培養時間的增加而變化,如圖1所示。在AT-P(根際)、CK(空白)和AT(非根際)處理中,第15天時DOC含量出現了明顯的下降,隨后呈上升趨勢。培養結束時,DOC含量與初始值相近。在培養第30天時,根際沉積物中DOC含量顯著高于未添加阿特拉津且未種植物的空白沉積物(P<0.05)。在第45天時,非根際、根際沉積物中DOC含量分別為(327.35±7.50) mg·kg-1和(304.18±8.32) mg·kg-1,差異顯著(P<0.05)。其他時間內,實驗處理中的DOC含量與對照處理中的DOC含量并無顯著差異(P>0.05)。

圖1 阿特拉津脅迫下AT-P(根際)和AT(非根際)沉積物中可溶性有機碳(DOC)含量比較注:AT-P表示添加阿特拉津且種植穗花狐尾藻的沉積物,CK表示未添加阿特拉津且未種植植物的沉積物,AT表示添加阿特拉津但未種植植物的沉積物;圖中不同小寫字母表示阿特拉津脅迫下2種處理沉積物中DOC含量差異顯著(P<0.05)。Fig. 1 The comparison of total dissolved organic carbon (DOC) concentrations in AT-P (rhizosphere) sediment and AT (non-rhizosphere) sediment after atrazine exposureNote: AT-P, CK and AT represent the sediment treated with atrazine and Myriophyllum spicatum, sediment treated without atrazine and M. spicatum, and sediment treated with atrazine but without M. spicatum, respectively; different lowercase letters represent significant differences among the concentrations of DOC in two treatment sediments after atrazine exposure (P<0.05).
2.2 沉積物中硝態氮和銨態氮含量變化
如表1所示,AT-P(根際)及AT(非根際)處理沉積物中硝態氮含量在培養第15天時顯著上升,分別達到(5.82±2.10) mg·kg-1和(19.51±16.75) mg·kg-1,隨后含量一直呈下降趨勢,在培養第60天時下降為(0.58±0.006) mg·kg-1和(0.61±0.07) mg·kg-1。在整個培養過程中,非根際處理中硝態氮含量均高于根際處理,CK(空白)沉積物中硝態氮含量呈緩慢下降趨勢。培養結束時,根際和非根際沉積物中硝態氮含量顯著低于CK(空白)沉積物;與此同時,根際和非根際沉積物銨態氮含量整體呈先增加再減少的趨勢。培養第15天時,AT-P(根際)處理和AT(非根際)處理沉積物中銨態氮含量都顯著增加達到最高值,分別為(247.54±14.56) mg·kg-1和(202.13±20.90) mg·kg-1。在培養30 d和45 d時,根際沉積物和非根際沉積物中銨態氮含量無顯著差異。在整個培養過程中,CK(空白)沉積物中銨態氮含量呈緩慢下降趨勢。
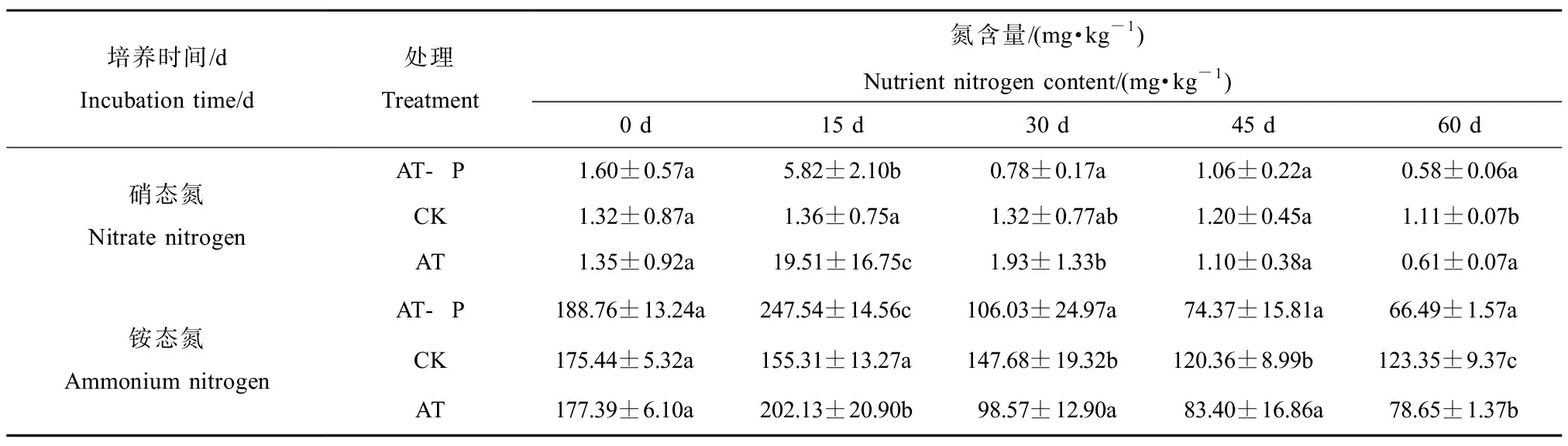
表1 沉積物中硝態氮和銨態氮含量的變化Table 1 The content variation of nitrate nitrogen and ammonium nitrogen in sediments
2.3 沉積物中脫氫酶活性變化
種植穗花狐尾藻后,在整個培養過程中,AT-P(根際)處理沉積物中脫氫酶活性一直顯著高于AT(非根際)處理和CK(空白)處理(P<0.05)。如圖2所示,第15天時,AT-P、CK和AT處理中脫氫酶活性分別達到(203.42±3.38)、(188.84±9.12)和(191.39±5.42) mg·(kg·d)-1。隨著培養時間增加,根際和非根際沉積物中脫氫酶活性也持續增加,CK(空白)沉積物中脫氫酶活性基本保持穩定。到實驗結束的第60天時,AT-P處理中脫氫酶活性為(253.50±7.82) mg·(kg·d)-1,AT處理中脫氫酶活性為(236.60±6.91) mg·(kg·d)-1,兩者比值約為1.07。
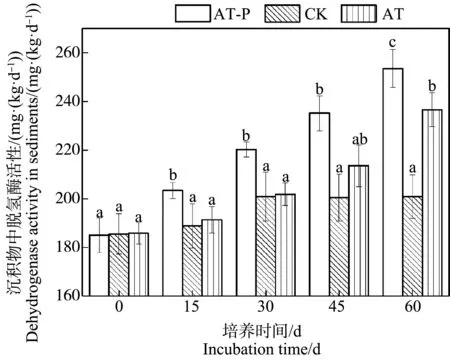
圖2 阿特拉津脅迫下AT-P(根際)和AT(非根際)沉積物中脫氫酶活性比較注:圖中不同小寫字母分別表示培養期間不同處理沉積物中脫氫酶活性差異顯著(P<0.05)。Fig. 2 The comparison of dehydrogenase activity in AT-P (rhizosphere) sediment and AT (non-rhizosphere) sediment after atrazine exposureNote: Different lowercase letters represent significant differences among the dehydrogenase activity in two treatment sediments after atrazine exposure (P<0.05).
2.4 沉積物中細菌數量變化
種植穗花狐尾藻能顯著提高沉積物中細菌的總數。在整個培養過程,AT-P(根際)沉積物中細菌總數始終高于未種植植物的AT(非根際)沉積物。如圖3所示,在培養60 d內,沉積物中細菌數量隨培養時間的增加而增加。在培養15 d和30 d后,AT-P處理中細菌總數顯著高于CK和AT處理(P<0.05)。在培養結束的第60天,AT-P和CK處理中細菌數差異不顯著(P<0.05),但均高于AT處理,此時,AT-P、CK和AT處理中平均細菌總量分別為1.19×108、1.15×108和1.04×108cfu·g-1。
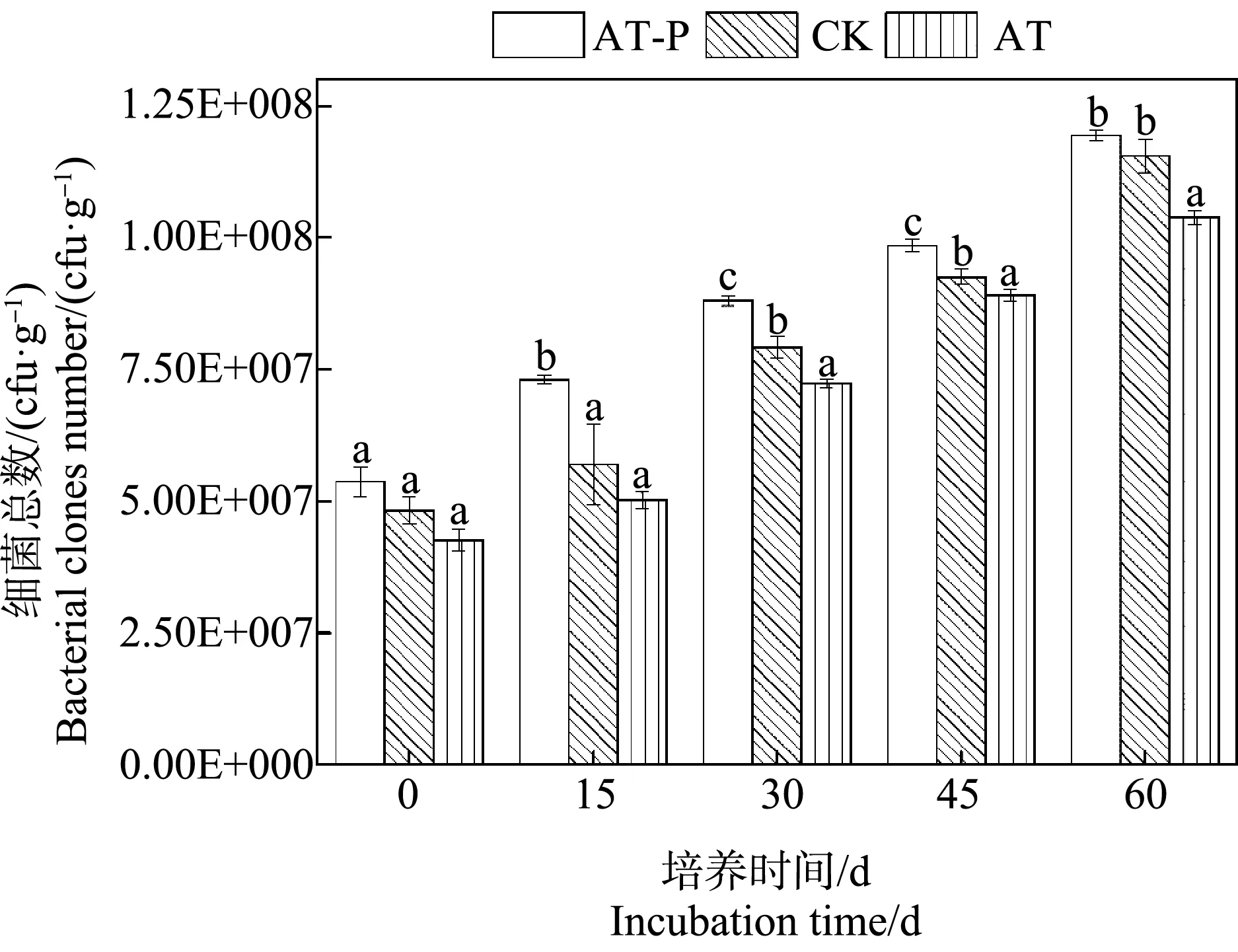
圖3 阿特拉津脅迫下AT-P(根際)、CK(空白)和AT(非根際)處理沉積物中細菌總數變化注:圖中不同小寫字母分別表示培養期間不同處理沉積物中細菌數量差異顯著(P<0.05)。Fig. 3 Changes of the bacterial quantities in AT-P (rhizosphere), CK (control) and AT (non-rhizosphere) sediments after atrazine exposureNote: Different lowercase letters represent significant differences among the bacterial population in two treatment sediments after atrazine exposure (P<0.05).
2.5 沉積物中阿特拉津降解菌的篩選與鑒定
本研究從不同沉積物中篩選出3株以阿特拉津為唯一氮源生長的菌株,分別命名為J1、J2和J3,其中,J1為非根際沉積物(AT)中篩選得到的菌株,J2、J3為根際沉積物(AT-P)中篩選得到的菌株,通過對不同菌株的16S rRNA進行擴增測序,將J1、J2和J3的16S rRNA基因序列用BLAST程序與GenBank中已登錄的16S rRNA基因序列進行序列同源性比較,并構建系統進化樹對細菌進行分類。如圖4所示,J1細菌與賴氏菌屬(Leifsoniasp.)的4株菌在系統進化樹上處于同一分支,推測J1為Leifsoniasp.菌屬;與此同時,J2細菌與2株伯克氏菌屬(Burkholderiasp.)的系統進化樹上處于同一分支,推測J2為Burkholderiasp.菌屬;J3細菌與成對桿菌屬(Dyadobactersp.)的2株菌在系統進化樹上處于同一分支,推測J3為Dyadobactersp.菌屬。

圖4 以阿特拉津為唯一氮源的J1、J2和J3細菌的16S rRNA基因序列系統進化樹注:圖中括號表示系統發育分析的基因序列登錄號,黑色粗體表示鑒定出的菌種J1、J2和J3,分支上面數值顯示相關分類群在測試中聚集在一起的百分比(1 000個重復)。Fig. 4 Phylogenetic trees of J1, J2 and J3 strains using atrazine as a sole nitrogen sourceNote: Accession numbers of the gene sequences used for the phylogenetic analysis are shown; J1, J2, and J3 were indicated by bold; the percentage of replicate trees in which the associated taxa clustered together in the bootstrap test (1 000 replicates) is shown next to the branches.
3 討論(Discussion)
植物生長能改變其根際微環境。DOC能夠增強土壤或沉積物中有機污染物的溶解,對有機污染物的生物有效性及遷移過程都有重要影響[22-23]。在培養15 d時,根際和非根際沉積物中DOC含量出現了明顯下降,隨后都呈上升趨勢,可能是因為在培養前15 d內阿特拉津的濃度較高,阿特拉津降解菌代謝旺盛導致了沉積物中DOC下降。據報道,在淹水條件下,土壤礦質態氮主要以銨態氮為主,水稻根系對銨態氮的強烈吸收會導致根際銨態氮含量顯著下降[24]。在本培養試驗后期,根際沉積物中銨態氮含量低于非根際沉積物,在培養結束時,差異達到顯著水平(P<0.05),可能是因為穗花狐尾藻對銨態氮的吸收所致。實際上,沉積物硝態氮的變化也與此類似,只是硝態氮不易滯留在沉積物中,故其變化并不明顯。從沉積物總的碳氮循環看,氮的變化更能反映植物存在下微生物對阿特拉津的降解。植物和微生物對土壤脫氫酶活性變化起著重要作用[25]。在阿特拉津污染土壤中,種植狼尾草(Pennisetumclandestinum)的土壤脫氫酶活性比未種植植物時增加了7倍[15]。在本實驗中,根際沉積物中脫氫酶活性始終高于非根際沉積物,在培養結束時,根際沉積物脫氫酶活性比非根際沉積物的高7%,表明穗花狐尾藻對沉積物中脫氫酶活性產生了顯著影響。
在施用阿特拉津和種植穗花狐尾藻后,沉積物中酸桿菌門(Acidobacteria)和硝化螺旋菌門(Nitrospirae)的相對數量分別增加[26]。在本實驗中,非根際沉積物中細菌數量一直顯著低于空白處理(P<0.05),說明阿特拉津介入會抑制細菌生長,給沉積物帶來生態風險。杜浩[27]利用平板計數法研究了10 mg·kg-1阿特拉津對土壤細菌群落的影響,結果表明,阿特拉津對細菌總數有明顯的抑制作用,該結論同本研究得到的結果基本一致。與之相反,Kolekar等[28]的研究表明,在1 000 mg·kg-1阿特拉津污染土壤中,阿特拉津降解菌與其他天然微生物的數量均隨培養時間增加而增加。可能是因為土壤微生物可以利用高濃度的阿特拉津作為碳源和氮源,當阿特拉津濃度較低,不足以為細菌生長提供足夠氮源與氮源,相反會對細菌生長產生一定抑制作用。在種植穗花狐尾藻后,本研究中根際沉積物中細菌數量一直顯著高于非根際沉積物(P<0.05)。有報道稱,在培養80 d后,土壤中23%~30%的初始濃度為19.52 mg·kg-1的阿特拉津被鋪地狼尾草(Pennisetumclandestinum)降解[15]。植物根系分泌物可增加植物對污染物生物利用度,也是根際微生物生長代謝或共代謝的基質[29]。這表明,穗花狐尾藻能直接降解阿特拉津和產生根系分泌物來解除阿特拉津對細菌群落的傷害[26],在一定程度上緩解阿特拉津對沉積物微生物的脅迫。隨著培養時間的推移,植物根系越來越發達,根際沉積物中的細菌數量也隨之增加。
部分微生物能將阿特拉津作為碳源和氮源,從而降解阿特拉津。在土壤中,阿特拉津主要在微生物作用下脫去烷基或被羥基化[30]。有研究報道,從耕作土壤中分離出的阿特拉津降解菌主要包括節桿菌屬(Arthrobactersp.)、螯合桿菌屬(Chelatobactersp.)和寡氧單胞菌屬(Stenotrophomonassp.)[31-32]。沉積物中阿特拉津降解菌也偶有報道,包括類諾卡氏菌屬(Nocardioidessp.)、路德維希腸桿菌(Enterobacterludwigii)和戴爾福特菌(Delftiatsuruhatensis)[33-34]。在本實驗中,根際和非根際中都篩選出了能夠以阿特拉津為唯一氮源生長的菌株。非根際沉積物中篩選得到Leifsoniasp. J1。目前少見Leifsoniasp.降解阿特拉津的報道,只有一篇文獻報道稱從阿特拉津溢油位點分離出的Arthrobactersp. TC1基因組與Leifsoniasp.具有高度相似性[35]。與此同時,從種植穗花狐尾藻的根際沉積物中篩選得到了Burkholderiasp. J2和Dyadobactersp. J3。有文獻報道,Burkholderiasp.含有atzA和atzB這2種阿特拉津降解基因,其中,atzA基因能將阿特拉津降解為羥基阿特拉津,atzB基因能將阿特拉津降解為氰尿酰胺(ammelide)或脫異丙基羥基阿特拉津(N-isopropylammelide)[36]。不同于Burkholderiasp.,Dyadobactersp.是一種未報道過的阿特拉津降解菌。總之,水生植物的種植可能促進了細菌對阿特拉津的降解作用,增加了沉積物中可被篩選利用的阿特拉津降解菌的種類[37]。

