原發性高血壓合并心房顫動危險因素分析
王東江,黃 魯,王 瑩,李春嚴
原發性高血壓是以體循環動脈血壓異常升高為主要特征的常見慢性病,其本身對患者生命健康威脅較小,且隨近年降壓藥物研發的長足進步,通常情況下患者生活質量基本不受影響[1]。然而高血壓的并發癥較多[2],一旦發生預后常令人擔憂,將給患者、家庭及社會帶來沉重負擔。心房顫動作為常見的嚴重心律失常類型,可引發心悸、胸悶等明顯癥狀[3],與原發性高血壓共病率較高,二者病情可呈現相互促進趨勢,進而增加腦卒中發病率及病死率,近年來已成為心血管內科研究的重難點所在。目前臨床對心房顫動發病機制仍未達成共識,但在心房顫動病理生理研究中被廣泛接受的局灶性激動學說、自旋波折返學說及折返伴顫動樣傳導學說均表明其患病與心房重構、神經電活動異常有關[4],因而常伴心室舒張功能不全的高血壓患者極易患病。因此,盡早識別原發性高血壓合并心房顫動的高危因素對臨床預防與早期干預十分重要。對此,本研究旨在分析高血壓患者合并心房顫動的危險因素。
1 資料與方法
1.1一般資料 回顧性分析2017年1月—2018年12月我院診治的256例原發性高血壓患者臨床資料,根據是否合并心房顫動分為觀察組87例(合并心房顫動者)和對照組169例(未合并心房顫動者)。納入標準:①經臨床及相關檢查結果診斷為原發性高血壓[5];②年齡≤90歲;③服用降壓藥物且血壓控制效果尚可;④心房顫動患者經動態心電圖檢查結果確診[6]。排除標準:①慢性腎臟疾病、內分泌系統疾病等引起的繼發性高血壓者;②合并心臟瓣膜病、心肌炎、先天性心臟病、風濕性心臟病、感染性心內膜炎、肺源性心臟病、肺動脈栓塞、甲狀腺功能亢進、惡性腫瘤等疾病或有心胸外科手術史者;③原發性高血壓確診前已存在心房顫動者;④未能按要求完成相關檢查項目者。
1.2研究方法 收集納入患者下列資料:①一般臨床資料:性別、年齡、體質量指數(BMI)、高血壓病程、高血壓家族史、24 h平均收縮壓(24 h SBP)、24 h平均舒張壓(24 h DBP)、糖尿病史、吸煙史及室上性早搏、房性心動過速伴隨情況;②血生化指標:患者確診或排除心房顫動當日采集肘靜脈血,采用全自動生化分析儀測定甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)、同型半胱氨酸(Hcy)、N末端B型腦利鈉肽前體(NT-proBNP)、胱抑素C(CysC)、尿素(UA)、纖維蛋白原(FIB)、D-二聚體(D-D)水平;③心臟彩超參數:采用飛利浦iE33型彩超診斷儀,以2.5 MHz頻率探頭經胸掃查,分別記錄左房內徑(LAD)、左室舒張末期容積(LVEDV)、左室后壁厚度(LVPWT)、左室射血分數(LVEF)、右室內徑(RVD)、右室前壁厚度(RVAWT)、舒張期末室間隔厚度(IVST)及二尖瓣左室舒張早期充盈峰值血流速率與心房舒張末期收縮峰值血流速率比值(E峰/A峰)。

2 結果
2.1一般資料比較 兩組性別、BMI、高血壓家族史、24 h DBP水平、糖尿病史、室上性早搏出現率比較差異均無統計學意義(P>0.05),而兩組在年齡、高血壓病程、24 h SBP水平、吸煙史、房性心動過速出現率方面比較差異有統計學意義(P<0.05或P<0.01),見表1。
注:觀察組和對照組分別為合并心房顫動和未合并心房顫動的原發性高血壓患者組;BMI為體質量指數,24 h SBP為24 h平均收縮壓,24 h DBP 為24 h平均舒張壓
2.2血液生化指標比較 兩組HDL-C、UA及FIB水平比較差異均無統計學意義(P>0.05),而觀察組TG、Hcy、NT-proBNP、CysC及D-D水平均明顯高于對照組,LDL-C水平明顯低于對照組,差異均有統計學意義(P<0.05或P<0.01),見表2。
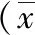
表2 合并心房顫動和未合并心房顫動的原發性高血壓患者血液生化指標比較±s)
注:觀察組和對照組分別為合并心房顫動和未合并心房顫動的原發性高血壓患者組;TG為甘油三酯,LDL-C為低密度脂蛋白膽固醇,HDL-C為高密度脂蛋白膽固醇,Hcy為同型半胱氨酸,NT-proBNP為N末端B型腦利鈉肽前體,CysC為胱抑素C,UA為尿素,FIB為纖維蛋白原,D-D為D-二聚體
2.3心臟彩超參數比較 兩組LVEDV、RVD及RVAWT比較差異無統計學意義(P>0.05),而觀察組LAD、LVPWT、IVST明顯高于對照組,LVEF、E峰/A峰明顯低于對照組,差異有統計學意義(P<0.01),見表3。
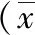
表3 合并心房顫動和未合并心房顫動的原發性高血壓患者心臟彩超參數比較±s)
注:觀察組和對照組分別為合并心房顫動和未合并心房顫動的原發性高血壓患者組;LAD為左房內徑,LVEDV為左室舒張末期容積,LVPWT為左室后壁厚度,LVEF為左室射血分數,RVD為右室內徑,RVAWT為右室前壁厚度,IVST為舒張期末室間隔厚度,E峰/A峰為二尖瓣左室舒張早期充盈峰值血流速率與心房舒張末期收縮峰值血流速率比值
2.4危險因素分析 經過多因素非條件logistic回歸分析,結果顯示:高齡、伴房性心動過速、LDL-C偏低、NT-proBNP偏高、LAD偏大及LVPWT偏大是原發性高血壓患者合并心房顫動的危險因素,見表4。

表4 原發性高血壓合并心房顫動的多因素非條件logistic回歸分析
注:LDL-C為低密度脂蛋白膽固醇,NT-proBNP為N末端B型腦利鈉肽前體,LAD為左房內徑,LVPWT為左室后壁厚度
3 討論
隨年齡的增長,心臟功能可出現進行性衰退,尤其表現在竇房結功能降低、心肌纖維化加重及左室順應性減低等方面,可導致心肌不應期持續縮短、傳導時間延長等心電征象[7],對誘發心房顫動有促進作用,因此高齡被證實是心房顫動的致病因素。相關調查顯示,65歲老年人心房顫動發生率為4%,且年齡每增長10歲其發生風險將提高9%[8]。本研究結果也表明,高齡是原發性高血壓患者并發心房顫動的危險因素。
高血壓患者由于心臟結構與心電活動出現變異,通常可表現出多種形式的房性和(或)室性心律失常[9],其中以房性心動過速、室上性早搏及心房顫動較為常見。有研究指出,高血壓患者由于腎素-血管緊張素-醛固酮系統異常激活,可導致心肌電生理活動異常,從而引發大折返性與局灶性的心律代償改變,增加心房細胞轉化生長因子表達與炎性因子釋放,從而促進心房重構[10]。本研究中,房性心動過速也是導致原發性高血壓合并心房顫動的高危因素。提示存在房性心動過速的高血壓患者心房顫動發生率較高,臨床預防需重視糾正心率與血流動力學異常,以避免心電活動持續惡化。
脂代謝異常為冠心病獨立預測因子,通常LDL-C水平低可提示冠心病發病風險下降,心血管保護作用增強[11]。但近年研究表明,使用他汀類藥物過度降低LDL-C可增加心房顫動發生風險,原因可能與心房細胞炎性反應、氧化應激及異位局灶自律性增強有關[12]。本研究結果發現,LDL-C水平偏低是引起原發性高血壓患者并發心房顫動的危險因素。建議他汀類藥物應設立具有上下限的降脂目標,以防增加心房顫動等不良事件發生風險。
心力衰竭作為高血壓長期控制不良導致心臟后負荷進行性加重的直接結果,多表現為靜脈回心血無法充分排出,動脈體循環系統灌注不足,而出現廣泛的淤血癥狀,預后往往較差[13]。有學者認為,心力衰竭可使左房壓力上升,激活交感神經興奮性,兒茶酚胺異常分泌,導致心房間質纖維化與電生理異常加重,繼而促進心房顫動的發生、發展[14]。NT-proBNP作為最常見的心力衰竭標志物,通常與心肌酶譜共同應用于合并心力衰竭的風險與嚴重度評估[15]。本研究結果顯示,NT-proBNP水平偏高也是導致原發性高血壓合并心房顫動的高危因素,這提示我們高水平NT-proBNP可通過激活神經內分泌系統與心肌重構機制增加原發性高血壓患者心房顫動發病概率。
心臟結構變異是高血壓觸發心房顫動的直接途徑,擴大的LAD將更易于引起心臟舒張功能減退,進而出現左房排空能力下降、充盈壓增加與收縮節律異常,從而誘發心臟電生理變化而導致心房顫動[16]。已有研究顯示,LAD每擴大5 mm,心房顫動發生風險將增加1.39倍,以40 mm作為臨界值時,LAD預測心房顫動的靈敏度為60%,特異度可達76%[17]。本研究還發現,LAD、LVPWT偏大是原發性高血壓患者合并心房顫動的危險因素,因此盡早識別左心結構改變可為預測心房顫動提供依據。劉焰華和吳繼雄[18]認為,高血壓患者由于心臟后負荷不斷增加,心室肌可呈現肥厚性增生趨勢,LVPWT增大,心室腔壓力持續升高,心房內壓也隨之升高,但因心房肌較為薄弱,增生并不明顯,可主要表現為心房擴大與肺靜脈牽張,心肌有效不應期縮短、離散度增加且傳導時間有所延長,進而出現電位重構,對心房顫動有較明顯的促進作用。
綜上所述,高齡、伴房性心動過速、LDL-C偏低、NT-proBNP偏高、LAD偏大及LVPWT偏大均可獨立引起原發性高血壓患者合并心房顫動,臨床早期檢查應針對上述指標進行嚴格篩察,盡早采取對應干預措施預防以改善患者預后。

