肺炎型原發性肺黏液腺癌的臨床、CT及病理特點分析
史曉光 曹輝 田成斌
原發性肺黏液腺癌(Primary Pulmonary Mucinous Adenocarcinoma,PPMA)屬肺內罕見的惡性腫瘤性疾病,在2011年國際肺癌多學科分類中被作為新病理類型分出[1]。PPMA據其CT影像表現被分為結節腫塊型和肺炎型,后者由于其CT征象缺乏特異性,與肺炎、肺結核等疾病較難鑒別,易造成誤診而延誤病情[2-3]。本研究的目的在于通過回顧性分析11例PPMA患者的臨床、CT影像及病理資料,旨在加深對該病的認識,提高對其診斷正確率。
資料與方法
一、一般資料
收集2013年5月至2019年4月期間于我院經病理證實的11例PPMA患者的臨床、CT影像及病理資料。11例患者中,男5例,女6例,年齡46~71歲,平均(59.55±7.45)歲。11例患者中3例經手術病理證實,3例經支氣管鏡活檢證實,5例經CT引導下穿刺活檢證實。
二、儀器與方法
所有患者均采用GE Lightspeed 16排螺旋CT或GE Optima 64排螺旋CT行胸部CT掃描。掃描時患者取仰臥位,雙臂上舉抱頭,于深吸氣后屏氣掃描。掃描范圍自肺尖至肺底。掃描參數如下:管電壓120kV,管電流自動調整(80~200mA),常規掃描層厚5mm,1.25mm薄層肺部重建算法重建。掃描完成后所有數據經PACS發送到AW4.6工作站進行多平面重組以便顯示病灶與周圍組織結構的關系。8例患者行增強掃描,采用非離子型碘對比劑碘海醇(300 mgI/mL)經肘前靜脈進行注射,注射速率為3mL/s,注射用量1.5~2.0mL/kg,動脈期25s~30s,靜脈期55s~60s,延遲期120s。
三、圖像評價
由兩位熟悉胸部疾病CT影像診斷的主治醫師對所有患者胸部CT影像進行獨立觀察,重點觀察病灶分布(左肺上、下葉,右肺上、中、下葉)、數量、形態、密度、瘤-肺界面(清楚、模糊)、病灶內部情況(空氣支氣管征、枯樹枝征、血管造影征)、病灶與鄰近結構關系(胸膜凹陷征、鄰近葉間胸膜膨隆等)、強化程度、轉移情況等,當兩者意見不一致時需共同商討或經更高一級醫師進行分析以求達到最終統一意見。CT影像觀察條件:肺窗窗寬1500HU,窗位-600HU;縱隔窗窗寬400HU,窗位50HU。增強幅度在0~20HU間,視為輕度強化、20~40HU間視為中度強化、大于40HU時視為明顯強化。
結 果
一、臨床表現
11例患者中男5例,女6例,其中有2例患者有既往或現抽煙史。所有患者中5例表現為咳嗽、咳痰,其中3例為咳少量白色粘痰,1例因胸痛就診,1例因不規則發熱就診,1例因胸悶、氣短就診,1例因外傷致肋骨骨折入院,其余2例無明顯臨床癥狀,為體檢發現。11例患者中,4例患者首次被誤診為肺部感染,經抗炎治療后無效。
二、CT影像表現
11例患者中共13個肺炎型PPMA病灶,9例單發病灶患者中右肺上葉1例、中葉1例、下葉3例,左肺上葉1例、下葉3例,1例患者右肺上葉及中葉各1個病灶,1例患者右肺中葉及下葉各1個病灶。所有PPMA病灶均表現為片狀實變影伴周圍磨玻璃影,實變區局部邊緣膨隆(圖1)、所有病灶內均可見“空氣支氣管”征(圖1~5)、10個病灶鄰近葉間胸膜局限性膨隆(76.92%)(圖1)、9個病灶中可見“枯樹枝”征(69.23%)(圖1~4)。8例患者共計9個病灶行增強掃描,其中9個病灶均呈輕中度不均勻強化(圖3、4),且病灶內存在斑片狀無強化區(100%)(圖6~8),6個病灶內可見“血管造影”征(66.67%)(圖4),2個病灶伴有周圍胸膜凹陷征。3例患者可見縱隔淋巴結轉移,其中2例患者伴有雙肺多發轉移。
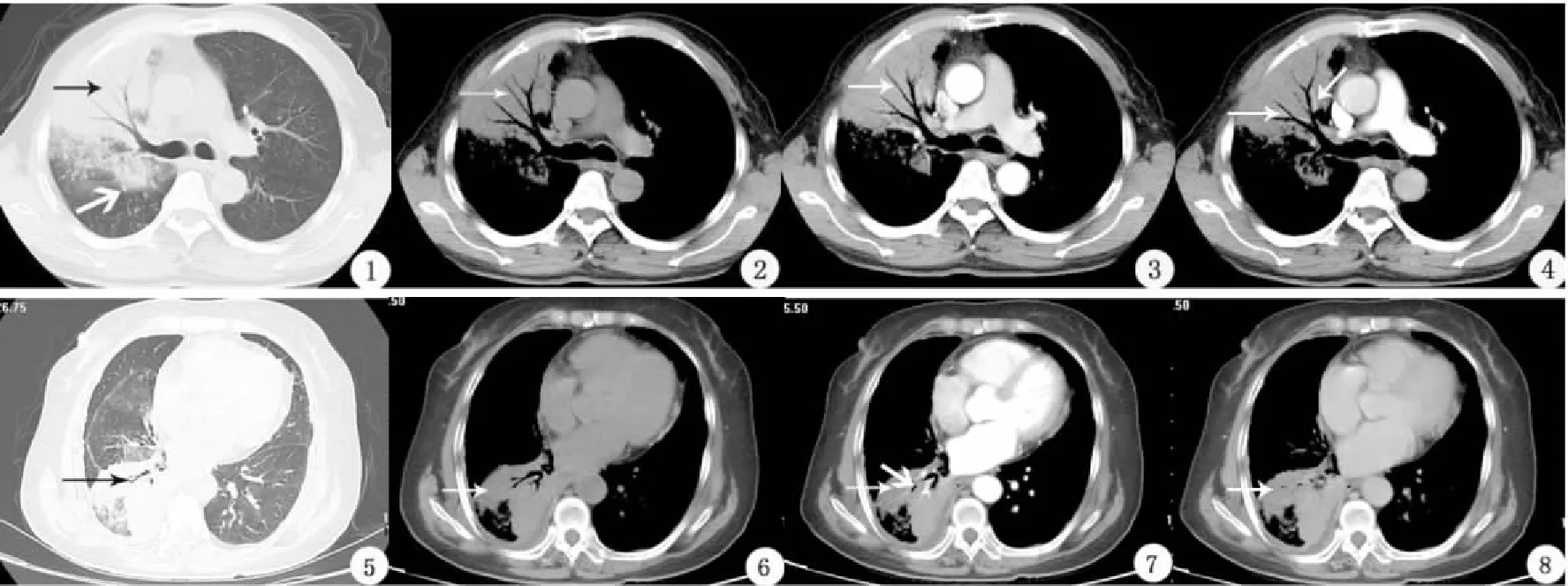
圖1~4:男,63歲,PPMA。圖1:平掃肺窗顯示右肺上葉片狀實變影伴磨玻璃影,內可見“空氣支氣管”征及“枯樹枝”征(細黑箭);病灶鄰近斜裂胸膜區局限性膨隆(粗白箭);圖2~4:平掃及增強掃描縱隔窗示片狀實變,病灶呈輕度強化,其內可見“枯樹枝”征(圖2~3中,白箭)及“血管造影”征(圖4中,白箭)。圖5~8 女,71歲,PPMA。圖5:平掃肺窗顯示右肺下葉斑片狀實變影伴周圍磨玻璃影,實變區局限性膨隆,內可見“空氣支氣管”征(黑箭)及“枯樹枝”征(黑箭);圖6~8:平掃及增強掃描縱隔窗示片狀實變影,內可見“枯樹枝”征及小斑片狀更低密度區(圖6中,白箭),增強掃描示斑片狀實變區呈中度強化,其內小斑片狀低密度區無明顯強化(圖7~8中,細白箭);病灶內可見“血管造影”征(圖7中,粗白箭)。
討 論
黏液腺癌是一種特殊類型的黏液分泌型腫瘤,常發生于胃腸道、乳腺、卵巢和子宮等部位,原發于肺的黏液腺癌較為少見[4]。根據2011年肺腺癌國際多學科分類新標準[1],PPMA取代原來的黏液性細支氣管肺泡癌,被列為肺腺癌的一個獨立的變異亞型,其病理特點是腫瘤細胞由細胞質內含有大量黏液的柱狀細胞和/或杯狀腫瘤細胞組成,而該兩種腫瘤細胞較少出現在其他類型肺癌中[5]。目前國內外有關肺炎型PPMA的報道不多,除了吳婧等[2]報道了36例外,其余均為個案報道或少數病例報道。
一、臨床表現
肺炎型PPMA可見于任何年齡段,以中老年患者為著[6-7]。此次研究11例患者中 10例患者年齡超過50歲(90.91%),該結果與文獻報道基本一致[2,7],再次印證PPMA多見于中老年人群。另外,本次研究中男女比例為1 ∶1.2,與秦冬雪[8]、張潔[9]等研究結果基本一致,提示肺炎型PPMA在不同性別間發病率無明顯差異。
肺炎型PPMA患者的臨床表現往往缺乏特異性,其主要表現多為長期咳白色黏液樣痰、痰中帶血絲,刺激性干咳、乏力、消瘦、胸悶氣短等[5]。本組11例患者中僅有3例(27.27%)表現為咳嗽、咳痰伴少量白黏痰,其余均無典型癥狀。11例患者中有4例首次被誤診為肺部感染,臨床行抗感染治療無效。總之,肺炎型PPMA無特征性的臨床表現,加上臨床少見,故容易被誤診。
二、CT影像表現
(1)病灶分布:此次研究中各肺葉、段均有肺炎型PPMA病灶分布,但以雙肺下葉分布較多,占53.85%(7/13),該結果與部分學者[10-11]研究結果基本一致。Sawada等[12]認為PPMA起源于杯狀細胞,長期煙霧等刺激可引起杯狀細胞的突變,從而導致PPMA的出現;而人的雙肺下葉由于重力作用可能更容易接受外界刺激而導致杯狀細胞的增生和化生,這可能是PPMA多發生于雙肺下葉的原因之一。此次研究11例患者中有2例(18.18%)患者有吸煙史,提示PPMA可能與吸煙關系不大,該結果與王興蘭[7]、Zhang Y[13]等人研究結果基本一致,但與部分學者[11,14]研究結果相反,筆者分析導致這種情況的原因可能為多數研究的樣本量較小而導致的誤差較大所致,有關吸煙與PPMA的關系有待于未來更大樣本量的進一步分析。
(2)病灶形態:肺炎型PPMA病灶在CT上多呈片狀實變影伴周圍磨玻璃密度影。肺炎型PPMA也被稱之為實變型PPMA,其是唯一可以表現為片狀實變的肺部腫瘤性病變,此征象提示氣道播散,預后不佳[15]。本組13個病灶均表現為片狀實變伴磨玻璃影,病灶內可見“空氣支氣管”征。導致該CT影像表現的病理機制可能跟PPMA病變的不同時期有關系,在早期時腫瘤細胞浸潤部分肺泡腔形成磨玻璃密度影,隨著病變進一步發展,肺泡腔內氣體減少,外加腫瘤細胞分泌黏液,這兩者加速病變呈實性密度。鑒于其在CT影像上表現為片狀實變,故其與大葉性肺炎、干酪性肺炎等肺部感染性病變的CT表現相似,這也是肺炎型PPMA常常被誤診的主要原因之一。
(3)病灶密度:本組13個病灶均呈較片狀實變伴磨玻璃影,增強掃描時病灶呈輕中度不均勻強化,病灶內可見斑片狀無強化區,這一點與非黏液性肺腺癌和感染性病變的強化方式明顯不同,可以作為肺炎型PPMA的重要CT影像特征。導致肺炎型PPMA病灶內斑片狀無強化區的病理機制是由于腫瘤細胞分泌黏液所致[3]。
(4)病灶邊緣:此次研究中13個病灶均伴有局限性邊緣膨隆,且10個病灶鄰近葉間胸膜局限性膨隆,導致該征象發生的病理機制,可能是由于腫瘤細胞分泌的黏液的重力作用所致[2,16]。此外,此次研究中2個病灶伴有周圍鄰近胸膜凹陷征,可見胸膜凹陷征的發生率均較非黏液性肺腺癌的發生率低,其病理機制可能是有由于PPMA以黏液性成分為主,瘤內較少出現纖維化、瘢痕并形成收縮力;而非黏液性肺腺癌以浸潤性結構為主,且容易向外浸潤性生長及收縮牽拉周圍肺結構所致[3]。
(5)病灶內部結構:此次研究中所有PPMA病灶內均可見空氣支氣管征、9個(69.23%)病灶中可見“枯樹枝”征;8例患者共計9個病灶行增強掃描,其中6個(66.67%)病灶內可見“血管造影”征。“空氣支氣管”征及“枯樹枝”征可能是由于病變的不同時期所致,在PPMA病變早期,支氣管尚未受腫瘤細胞累及或累及程度較輕時,支氣管結構保留相對完整,此時在實變區內顯示為“空氣支氣管”征;隨著病變進展,腫瘤細胞分泌黏液,部分細支氣管被黏液阻塞而不能顯示,故形成分支較少的“空氣支氣管”征,外加隨著病變進展,腫瘤細胞對支氣管侵犯加重,使支氣管走行僵硬、分支減少,進而形成“枯樹枝”征[10]。“血管造影”征在此次研究的9個病灶中發生率為66.67%,其表現為增強CT掃描時在低密度的病灶中可見明顯強化的血管影,該征象的發生機制是由于血管受腫瘤細胞浸潤較少而腫瘤細胞分泌的黏液使病灶強化不明顯所致。以往“血管造影”征被認為是肺炎型PPMA的特征征象之一,后續研究發現在阻塞性肺炎和淋巴瘤中均可見到該征象,因此缺乏特異性[17-18]。
綜上所述,肺炎型PPMA臨床癥狀無特異性,易被誤診為肺部感染性疾病,但抗感染或抗結核治療無效。肺炎型PPMA的CT表現具有以下特點:①肺內片狀實變伴磨玻璃影,病灶局部邊緣膨隆樣改變;②病灶實變區在增強掃描呈輕中度不均勻強化,其內可見斑片狀無強化區;③病灶實變區內多可見“枯樹枝”征。熟知以上CT征象有助于肺炎型PPMA的診斷,以上征象具備的越多,其診斷為肺炎型PPMA的可能性大越大。

