IgA腎病合并高尿酸血癥患者的臨床及病理特點分析
郭海華,孫志國,劉 群,蘇森森,許鐘鎬*
(1.吉林大學第一醫院 腎病內科,吉林 長春130021;2.解放軍32183部隊醫院 腎病內科,吉林 白城137000)
IgA腎病(IgAN)是世界范圍內最常見的原發性慢性腎小球疾病[1],約15%-40%的患者在10-20年內進展為終末期腎臟病[2],當前公認的IgAN進展因素包括高血壓、蛋白尿、腎功能受損(eGFR≤60 ml/min/1.73m2)[3]、腎間質纖維化、腎小球硬化、新月體形成等[4]。有研究顯示,高尿酸血癥是IgAN進展的危險因素[5],本研究通過探討IgAN合并高尿酸血癥患者的臨床特點及病理特征,進一步揭示IgAN患者發生高尿酸血癥的危險因素,為疾病防治及延緩疾病進展提供依據。
1 資料與方法
1.1 研究對象收集2015年1月至2018年8月期間于吉林大學第一醫院腎病內科經腎活檢明確診斷為原發性IgAN患者。入選標準:①入院時年齡≥18歲,性別不限。②臨床資料完整。排除標準:①檢測外科綜合、ANA系列、ANCA篩查、風濕三項等臨床指標排除系統性紅斑狼瘡腎炎、過敏性紫癜性腎炎、乙型病毒相關性腎炎,肝硬化相關性IgAN等繼發性IgAN。②合并其他腎臟疾病,如糖尿病腎病、膜性腎病等。③排除系統性疾病,如感染、腫瘤等。④腎穿刺標本中腎小球個數<8個。⑤重復腎穿刺活檢以及移植腎穿刺活檢患者。
1.2 觀察指標①一般情況:性別、年齡、體重指數(BMI)、以及是否合并高血壓病史。②實驗室指標:血肌酐、血尿素氮、血清尿酸、胱抑素C、谷草轉氨酶(AST)、谷丙轉氨酶(ALT)、甘油三脂、膽固醇、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、24 h尿蛋白定量、腎小球濾過率(eGFR)、血常規、血清IgA、補體C3等。所有實驗室指標均為患者入院后行腎活檢前最近1次的空腹檢查結果。③病理學資料:根據Lee氏分級標準將IgAN分為Ⅰ-Ⅴ級[6],采用Katafuchi半定量積分評價IgAN的病變程度[7]。
1.3 相關指標評價標準①高尿酸血癥:男性血尿酸>420 μmol/L(7 mg/dL),女性血尿酸>360 μmol/L(6 mg/dL)。②應用慢性腎臟病流行病學合作研究公式(CKD-EPI)計算eGFR。③ BMI=體重/身高2(kg/m2)。④腎臟病理采用Katafuchi半定量積分進行評價,總分為27分,其中腎小球積分1-12分,包括系膜增殖程度(1-4分)、節段損害(0-4分)、球性硬化(0-4分);腎小管間質積分0-9分,包括間質炎性細胞浸潤(0-3分)、間質纖維化(0-3分)、小管萎縮(0-3分);血管病變積分0-6分,包括血管壁增厚(0-3分)和玻璃樣變性(0-3分)。
1.4 分組根據血尿酸水平將患者分為正常尿酸組和高尿酸血癥組。
1.5 統計方法應用SPSS22.0統計學軟件進行統計分析,兩組間連續性計量資料比較采用t檢驗;不滿足正態分布時采用非參數檢驗;計數資料采用χ2檢驗。
2 結果
2.1 血尿酸正常組與高尿酸血癥組患者一般資料比較
根據入院時血尿酸水平將IgAN患者分為正常尿酸組和高尿酸血癥組,其中正常尿酸組62人,男性30人,占48.4%,女性32人,占51.6%,平均年齡40.03±12.33歲,高血壓發生率為19例(30.6%);高尿酸血癥組95人,男性54人,占56.8%,女性41人,占43.2%,平均年齡37.13±12.31歲,高血壓發生率為51例(53.7%)。兩組間患者性別、年齡、BMI均無統計學意義。高尿酸血癥組患者高血壓發生率明顯高于正常尿酸組,差異具有統計學意義(P<0.05),見表1。

表1 兩組間患者的一般資料比較
注:與正常尿酸組相比,*P<0.05
2.2 血尿酸正常組與高尿酸血癥組患者實驗室指標比較
通過62例正常血尿酸IgAN患者與95例高尿酸血癥IgAN患者臨床指標比較,結果發現,兩組間白蛋白、血膽固醇、HDL、LDL、血清IgA、補體C3無統計學意義。高尿酸血癥組患者甘油三酯、24小時尿蛋白定量、白細胞計數均較正常血尿酸組高,差異具有統計學意義(P<0.05);高尿酸血癥組患者AST、ALT、血紅蛋白低于血尿酸正常組,差異具有統計學意義(P<0.05);兩組間患者血肌酐、血尿素氮、胱抑素C、eGFR差異具有顯著性統計學意義(P<0.01),見表2。

表2 兩組間患者實驗室指標比較 M(P25,P75)
注:與正常尿酸組相比,*P<0.05,**P<0.01
2.3 血尿酸正常組與高尿酸血癥組患者CKD分期比較
根據eGFR水平對兩組患者進行CKD分期比較,結果提示,正常尿酸組患者以CKD1期39例(62.9%)為主,CKD1-CKD2期55例(88.7%),CKD3-CKD5期7例(11.3%);高尿酸血癥組患者以CKD3期32例(33.7%)為主,CKD1-CKD2期46例(48.5%),CKD3-CKD5期49例(51.6%),見表3。

表3 兩組間患者CKD分期比較[n(%)]
2.4 血尿酸正常組與高尿酸血癥組患者病理Lee氏分級比較
根據兩組患者病理結果進行Lee氏分級比較,正常尿酸組患者以Ⅲ級39例(62.9%)為主,Ⅰ+Ⅱ+Ⅲ級52例(83.9%),Ⅳ+ Ⅴ級10例(16.1%);高尿酸血癥組患者以Ⅳ級45例(47.4%)為主,Ⅰ+Ⅱ+Ⅲ級43例(45.3%),Ⅳ+ Ⅴ級52例(54.8%),見表4。

表4 兩組間患者Lee式分級比較[n(%)]
2.5 血尿酸正常組與高尿酸血癥組患者Katafuchi半定量積分比較
根據腎臟病理穿刺結果,對兩組患者進行Katafuchi半定量積分比較,結果顯示高尿酸血癥組患者腎小球系膜增生程度、階段損害、以及腎血管病變均較正常尿酸組患者嚴重,差異具有統計學意義(P<0.05);腎小球球性硬化程度、腎間質炎細胞浸潤、腎間質纖維化以及腎小管萎縮差異具有顯著性統計學意義(P<0.01),見表5。
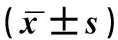
表5 兩組間患者Katafuchi半定量積分比較
注:與正常尿酸組相比,*P<0.05,**P<0.01
3 討論
尿酸是人體嘌呤代謝的終產物,人體內的嘌呤主要來源于外界攝入以及體內合成或核酸分解代謝產生,人體內約30%的尿酸可經胃腸道分解排出,其余約70%的尿酸可經腎臟排泄,因此腎臟是尿酸排泄的主要靶器官。近年來,隨著人們生活方式的改變,高尿酸血癥的患病率逐年增加,當前高尿酸血癥在我國成年人中患病率為13.3%[8]。國外研究表明,高尿酸血癥為IgAN進展的獨立危險因素[9],我國學者研究發現,IgAN患者發生高尿酸血癥的風險明顯高于普通人群,其患病率為36.6%[10]。本研究共納入157名IgAN患者,其中IgAN患者中高尿酸血癥的患病率為60.51%,明顯高于既往文獻報道,分析原因可能與東北地區飲食方式有關。經證實,高尿酸血癥與eGFR下降及CKD的發生獨立相關[11],本組研究中,高尿酸血癥組患者腎功能受損更為嚴重,主要表現為血肌酐、血尿素氮、胱抑素C較正常組更高,eGFR下降較正常組更明顯,CKD3-CKD5期患者高達51.6%,而正常尿酸組患者多為CKD1期39例(62.9%),本研究結果與Bakan[12]等人研究結果一致,因此提示腎功能受損是IgAN患者血尿酸升高的主要原因。人體2/3的血尿酸經腎臟排泄,血尿酸鹽可經腎小球自由濾過,由近端腎小管主動重吸收,腎功能損害重的IgAN患者eGFR下降導致尿酸排泄障礙,從而導致高尿酸血癥。有研究表明,合并高尿酸血癥的IgAN患者,其5年后eGFR明顯下降,發病初期血清尿酸每升高10 mg/L,IgAN患者發生腎功能不全的風險將增加1.35倍[13]。
本研究證實,IgAN患者發生高尿酸血癥的危險因素,不僅與腎功能受損有關,代謝性因素如高血壓、高甘油三酯血癥的作用也不容忽視。有研究表明,血清尿酸水平每增加1 mg/dl,高血壓的患病率增加1.2倍[14]。升高的血清尿酸可抑制血管內皮細胞一氧化氮產生,導致血管內皮功能障礙[15],同時可激活腎素-血管緊張素系統,導致血管緊張素Ⅱ生成增加,促進血管平滑肌細胞增殖以及通過氧化應激反應引起血壓升高[16];而長期高血壓可使腎臟局部組織缺血缺氧,通過乳酸作用使尿酸鹽排泄障礙,導致血尿酸水平升高,因此高血壓引起腎臟組織缺血是IgAN發生高尿酸血癥的原因之一[17];因此兩者相互作用,共同影響IgAN進展。但有報道稱,隨著年齡增加以及高血壓病程的延長,血尿酸水平反而呈下降趨勢,因此尿酸在年輕人以及高血壓發病初期有重要作用[18]。高甘油三酯血癥與高尿酸血癥之間的發病機制尚未闡明。有學者認為,高甘油三酯導致游離脂肪酸產生增加,加速三磷酸腺苷的分解,導致尿酸生成增加[19]。此外,高血壓與脂質代謝紊亂是代謝綜合征的主要表現,有研究報道,高尿酸血癥與代謝綜合征有關,隨著血尿酸水平的升高,代謝綜合癥的患病率也隨之增加[20]。代謝綜合征的生理基礎為胰島素抵抗。一項15年的隨訪研究表明,高尿酸血癥患者發生胰島素抵抗的風險為1.36倍[21],胰島素可增加腎臟近端小管對鈉離子的重吸收,競爭性抑制尿酸排泄, 最終導致高尿酸血癥[22]。同時升高的血尿酸可抑制內皮細胞產生一氧化氮,經動物實驗證明,一氧化氮產生減少是發生胰島素抵抗的機制之一[23],因此高尿酸血癥與胰島素抵抗的作用是相互的,最終造成腎臟損害。
IgAN臨床上常表現為血尿和不同程度的蛋白尿,本研究中,高尿酸血癥組患者24小時尿蛋白較正常組較高,尿蛋白的產生主要為足細胞損傷所致。體外動物實驗證明,與大多數內分泌和代謝性疾病相似,高尿酸可通過氧化應激反應誘導足細胞損傷導致蛋白尿[24],但其具體損傷機制尚未明確。
本研究提示與正常尿酸組比較,高尿酸血癥組患者白細胞計數以及血紅蛋白含量差異具有統計學意義。一項回顧性研究表明,白細胞計數與高尿酸血癥的發生率呈正相關,且與CKD的發生無關[25]。白細胞作為一種炎癥指標,通常用來預測體內的炎癥反應,而尿酸作為體內一種促炎因子,可誘導體內產生炎癥反應,使得白細胞以及炎癥因子如IL-6、TNF-α等顯著增高[26,27]。此外有文獻報道,體內血尿酸水平與血紅蛋白水平呈正相關[28]。本組研究中,兩組比較雖有統計學意義(P<0.05),但高尿酸血癥組患者較正常組患者血紅蛋白低,與趙曼均等人研究結果一致[29]。分析原因為高尿酸血癥組患者CKD分期高,腎損害較重,EPO水平下降導致紅細胞生成減少,血紅蛋白降低。此外,血尿酸作為一種促炎因子,誘發體內炎癥反應,導致白細胞增高的同時可導致鐵調素水平升高,從而抑制紅細胞生成[30],導致血紅蛋白下降。
腎臟病理病變程度是影響IgAN預后以及治療的重要因素。本組研究中,對兩組患者病理結果進行Lee氏分級以及Katafuchi半定量積分比較,結果均提示高尿酸血癥組患者病理損傷較重。Myllymaki[31]等人研究表明,高尿酸血癥是影響腎小管間質病變的獨立危險因素。高尿酸血癥與腎臟病理特征之間的關系可以通過高尿酸血癥損傷腎臟的機制來解釋。高尿酸血癥可通過多種機制激活腎素-血管緊張素系統、損傷血管內皮細胞,促進血管平滑肌細胞增殖,導致氧化應激和炎癥反應 ,最終損傷腎間質[32],加重腎臟損害。此外,高尿酸血癥通過誘導腎小管上皮細胞的轉分化作用直接誘導腎間質纖維化[33]。
綜上所述,IgAN患者中高尿酸血癥發病率較普通人群高。積極控制易患因素及控制血尿酸水平可改善IgAN的預后。本研究發現高尿酸血癥組患者AST、ALT較正常組患者較低,其具體原因以及發病機制尚不清楚,有待后期深入探究。本研究為回顧性研究,需多中心前瞻性研究進一步驗證,為IgAN的綜合防治提供可靠依據。

