三氧化二砷對黑色素瘤細胞B16-F10的效應及其分子機制研究
王 洋,成志強,王曉玫,婁 楠
(1.深圳市人民醫院(暨南大學第二臨床醫學院,南方科技大學第一附屬醫院),廣東 深圳518020;2.香港大學深圳醫院)
黑色素瘤是起源于神經嵴黑素細胞的具有高度侵襲性的惡性腫瘤,病變早期就可以侵及深部,發生局部淋巴結和/或血行轉移,預后較差。過度的紫外線照射是其明確的病因之一,嚴重威脅到戶外活動較多的兒童及青少年人群,發病率呈持續上升趨勢[1,2]。惡性腫瘤的傳統治療方式是通過手術、放療和化療,但是由于黑色素瘤細胞顯示出高侵襲性、耐藥性和抗輻射性等特征,晚期患者傳統治療的效果并不理想[3]。隨著精準治療理念的提出,在黑色素瘤分子分型研究中發現約50%的晚期患者存在BRAF(B Rapidly Accelerated Fibrosarcoma)基因突變[4]。針對BRAFV600E突變的抑制劑Vemurafenib,使部分晚期BRAF突變的黑色素瘤患者腫瘤進程得到有效緩解,但該藥物易出現短期耐藥和腫瘤復發的現象以及誘發皮膚鱗狀細胞癌、慢性淋巴細胞性白血病等不良后果不容忽視[5,6]。近年來在腫瘤免疫治療研究方面,美國FDA于2014-2015年間先后批準PD-1(Programmed Death 1)的抑制劑Nivolumab,用于治療BRAFV600E突變的晚期不可切除的黑色素瘤患者;CTLA-4(Cytotoxic T- lymphocyte- associated Antigen 4)的抑制劑Ipilimumab,用于Ⅲ期黑色素瘤患者術后的輔助治療[7,8]。這些用于免疫治療的藥物使部分患者的腫瘤進程得到有效控制,但同樣由于耐藥和腫瘤復發的迅速產生,副作用的影響以及高額的費用,臨床超過半數用藥有效的患者不得不選擇放棄治療[9,10]。目前晚期黑色素瘤患者短期迅速耐藥的難題亟待解決。
三氧化二砷(arsenic trioxide)早在2000多年前已被我國中醫藥領域廣泛應用,如今作為化療藥物,三氧化二砷已經被成功應用于白血病的治療中:研究表明砷化物可以誘導白血病中腫瘤細胞的分化,并促進這類細胞自身發生凋亡[11];此外三氧化二砷在其他一些實體腫瘤治療的實驗研究和臨床療效方面,同樣取得了顯著的進展,包括從體外細胞系研究,進一步過渡到動物體內的移植瘤研究,再逐漸擴展到臨床應用,證明其在抗腫瘤這一艱巨且迫切的任務中擁有巨大治療潛力和廣闊的應用前景[12-15]。結合目前黑色素瘤治療研究所遇到的困難,且三氧化二砷作用于黑色素瘤細胞的相關研究報道并不多見。因此本研究另辟蹊徑,擬對三氧化二砷作用于黑色素瘤細胞的效應及相關分子機制進行探討,可以為晚期黑色素瘤的臨床治療研究提供新的研究方向。
1 材料與方法
1.1 相關材料試劑
小鼠黑色素瘤細胞B16-F10來自于美國ATCC資源中心;H-DMEM培養基購自Gibico公司;胎牛血清購自杭州四季青生物公司;三氧化二砷購自于黑龍江哈爾濱醫大藥業股份有限公司;CCK8細胞活性檢測試劑盒、細胞周期檢測試劑盒及Annexin V-FITC/PI檢測試劑盒分別購買于上海碧云天生物技術有限公司;提取RNA所用試劑購自于美國賽默飛公司;DNaseI(RNase free)購自于Promega Corporation;逆轉錄試劑盒及相關PCR引物均來自于寶日醫生物技術有限公司;qPCR相關試劑購自愛普拜斯應用生物系統貿易有限公司。
1.2 三氧化二砷對B16-F10細胞的處理
稀釋三氧化二砷儲存液,配置終濃度分別為:0 μM,5 μM,10 μM,20 μM,40 μM,80 μM的砷化物工作液。在37℃、5% CO2條件下,取細胞培養箱中用含10%FBS的H-DMEM培養基培養的指數增長期的B10-F10細胞,以2.0×105個/ml的細胞密度,接種于所需的6 cm培養皿中,或以2×103個細胞/孔的細胞密度,接種于96孔培養板內,培養24 h后,分別加入不同濃度的三氧化二砷溶液再繼續培養24 h,以0 μM組為陰性對照,分別進行后續檢測。
1.3 三氧化二砷作用后B16-F10細胞增殖的檢測
劑量效應曲線的繪制:取如1.2中所述0 μM,5 μM,10 μM,20 μM,40 μM,80 μM濃度三氧化二砷處理的細胞,分別加入CCK-8溶液(10 μl/孔),于恒溫箱內37℃孵育2 h,檢測OD490 nm吸光度數值,繪制三氧化二砷作用于B16-F10細胞的劑量效應曲線。時間效應曲線的繪制:另取如1.2中所述0 μM,5 μM濃度三氧化二砷處理的細胞,連續5 d進行檢測,并繪制三氧化二砷作用于B16-F10細胞的時間效應曲線。本實驗所涉及計算公式:細胞存活率(%)=[實驗組平均OD值/對照組平均OD值]×100%;IC50=lg-1[Xm -i(Σp-0.5) ],公式中Xm為設計的最大濃度的對數值;i代表相鄰兩組濃度對數值之差;Σp表示各組生長抑制率之和,(生長抑制率p (%)=[(對照組平均OD值-實驗組平均OD值)/對照組平均OD值]×100%);0.5為經驗常數。
1.4 三氧化二砷作用后B16-F10細胞凋亡的檢測
取如1.2中所述0 μM,5 μM濃度三氧化二砷處理的細胞,胰酶(不含EDTA)消化后收集細胞,分別加入Annexin V-FITC檢測溶液(5 μl/管),避光,4℃孵育15 min后,再次加入PI檢測溶液(10 μl/管),避光,4℃孵育,1 h內用流式細胞儀進行檢測。 其中設置對照組:Annexin V-FITC和PI均未添加組;只添加加Annexin V-FITC組;只添加PI組;Annexin V-FITC和PI全部添加組。
1.5 三氧化二砷作用后B16-F10細胞周期的檢測
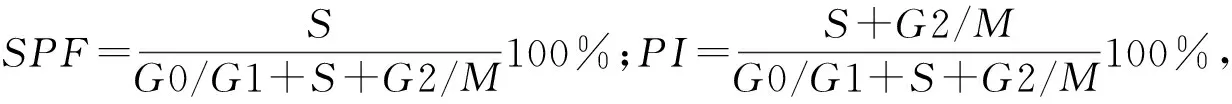
1.6 qPCR檢測相關基因表達
取如1.2中所述0 μM,5 μM濃度三氧化二砷處理的細胞進行RNA提取(Trizol);OD值的測定(分光光度計),計算RNA濃度[RNA濃度(ug/ul)=OD260×40×稀釋倍數];運用RT試劑進行RNA逆轉錄;PCR引物的選擇:小鼠RPL13作為內參,上游序列:5’-CGA GTT GGC TGG AAG TAC C-3’,下游序列5’-CTT CTG GCC TGT TTC CGT AG-3’;小鼠STC1為目的基因,上游序列5’-CTT AAA GTG CAT CGC CAA TGG G-3’,下游序列5’-GCT TCG GAC AAG TCT GTT GTA-3’,運用Sybe Green實時熒光定量PCR反應體系(詳見試劑說明書)進行qPCR反應,獲得相應的Ct值,通過2(-△△Ct)定量基因的表達(△Ct值=目的基因Ct值-內參Ct值。△△Ct值=5 μM三氧化二砷處理△Ct值-0 μM三氧化二砷處理△Ct值)。
1.7 統計學處理

2 結果
2.1 三氧化二砷抑制B16-F10細胞增殖
腫瘤的發生最直觀的體現就是生長失控,與腫瘤細胞異常增殖密切相關。我們發現不同濃度的三氧化二砷作用于B16-F10細胞后,細胞增殖程度均被不同程度的抑制,如圖1A所示,在5 μM的三氧化二砷作用下,細胞的增殖率明顯下降(P<0.05),細胞增殖率隨著砷化物劑量的增加,下降越明顯;如圖1B所示,在5 μM的三氧化二砷作用24 h即可顯著降低細胞增殖率(P<0.05),作用48 h對細胞增殖抑制更為顯著(P<0.01),48 h后無顯著差別;如表1所示,計算IC50值=65.3±6.5 μM。這些結果表明三氧化二砷在較低濃度(5 μM)作用24 h就可以顯著抑制B16-F10細胞的增殖,且砷化物濃度與細胞增殖抑制程度呈劑量效應關系。
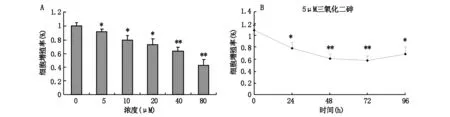
圖1 三氧化二砷抑制B16-F10細胞增殖
注:A代表不同濃度三氧化二砷作用于B16-F10細胞的劑量效應關系;B代表5 μM三氧化二砷作用于B16-F10細胞的時間效應關系,*P<0.05,**P<0.01。
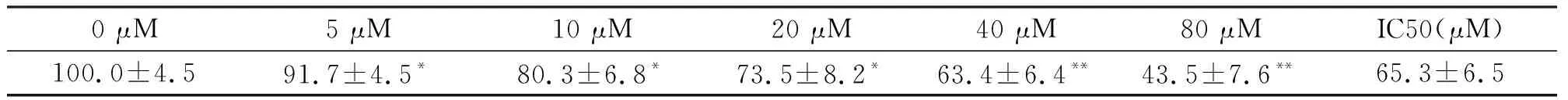
表1 三氧化二砷抑制B16-F10細胞增殖分析及IC50
注:*P<0.05,**P<0.01。
2.2 三氧化二砷促進B16-F10細胞的凋亡
化療藥物殺傷腫瘤細胞的重要機制之一就是誘發細胞凋亡。本研究同時檢測了三氧化二砷作用下B16-F10細胞的細胞凋亡情況。如圖2所示,我們發現在5 μM的三氧化二砷作用下,細胞的凋亡率顯著增加(P<0.05);隨著砷化物劑量的增加,凋亡率增加越明顯;如表2所示,計算IC50值=70.4±3.6 μM。表明較低濃度(5 μM)的三氧化二砷可以顯著促進B16-F10細胞的凋亡,且砷化物濃度與細胞凋亡程度呈劑量效應關系。

表2 三氧化二砷促進B16-F10細胞凋亡分析及IC50
注:*P<0.05,**P<0.01。
2.3 三氧化二砷阻斷細胞G1→S期進程
為探尋三氧化二砷抑制細胞增殖的作用機制,本研究繼續運用利用流式細胞術,檢測三氧化二砷(5 μM)處理的B16-F10細胞周期的改變。結果如圖3所示,砷化物可以顯著減少S期的細胞數量, 并顯著增加G0/G1期細胞數量,如表3所示,細胞周期相關的SPF及PI明顯減低(P<0.05)。這些結果提示三氧化二砷是通過阻斷細胞G1→S期進程,降低細胞增殖的活性。
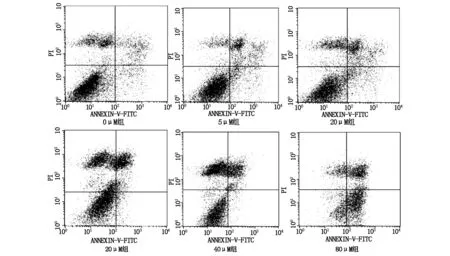
圖2.2 三氧化二砷促進B16-F10細胞凋亡
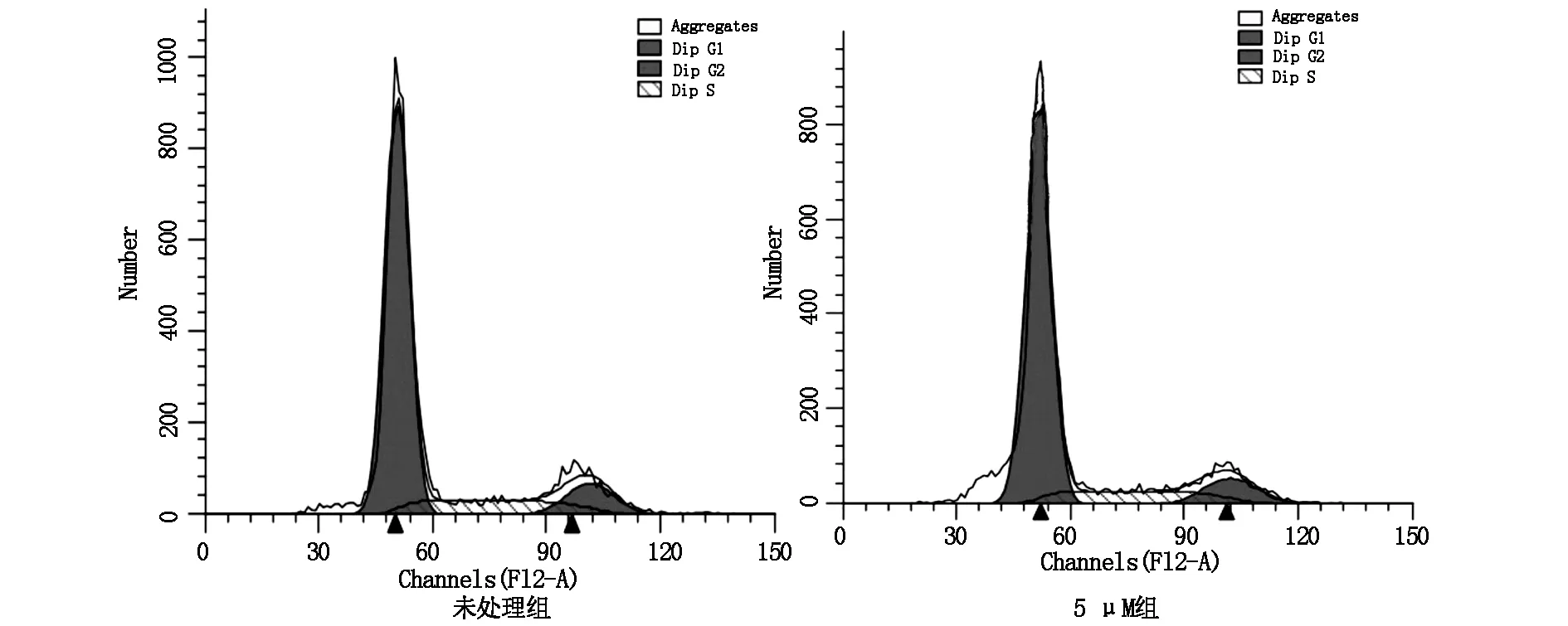
圖3 三氧化二砷阻斷B16-F10細胞G1→S期進程
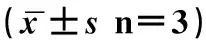

組別G0/G1SG2/MSPF(%)PI(%)未處理組72.84±1.415.92±1.211.24±1.315.92±1.127.16±1.55 μM砷處理組78.14±1.512.05±2.69.81±1.412.05±1.6*16.86±1.5*
注:*P<0.05。
2.4 三氧化二砷降低了B16-F10細胞STC1的mRNA水平
為進一步探討三氧化二砷的作用機制,本研究檢測了砷化物作用下B16-F10細胞STC1的mRNA水平,如表4所示。在5 μM濃度的三氧化二砷作用下,斯鈣素1(Stanniocalcin-1,STC1)的mRNA表達水平顯著下調,為對照組的42.51±5.62% (P<0.01)。該結果提示三氧化二砷對黑色素瘤細胞的作用機制可能與抑制了細胞內STC1的mRNA水平,進而阻斷了細胞G1→S期進程,并引起細胞凋亡相關。

表4 STC1的mRNA表達的分析
注:**P<0.01。
3 討論
盡管晚期黑色素瘤的研究從分子分型到免疫治療等方面取得了重要進展,在世界范圍內發表的探索性科研成果日益增多,但目前患者短期內耐藥復發的情況依然存在,尚缺乏安全有效的治療措施,其根本原因在于靶向殺傷黑色素瘤細胞的相關調控機制尚未清晰,制約了防治研究的進程。
在從白血病到實體瘤的研究中表明三氧化二砷可以直接作用于線粒體,還能繞過線粒體上游的傳導階段,誘導細胞凋亡[14];砷化物還能直接作用于氧化還原酶,引起細胞內活性氧含量增加,進而抑制細胞有絲分裂,并誘導細胞發生凋亡[15];還可以抑制端粒酶活性誘導癌細胞凋亡[16]等等。但目前三氧化二砷對黑色素瘤細胞產生的效應及分子機制的相關研究還并不多見。
本研究發現三氧化二砷在較低濃度(5 μM)作用24 h就可以顯著抑制B16-F10細胞的增殖,且砷化物濃度與細胞增殖抑制程度呈劑量效應關系;同時較低濃度(5 μM)的三氧化二砷可以顯著促進B16-F10細胞的凋亡,且砷化物濃度與細胞凋亡程度呈劑量效應關系。上述兩部分結果共同提示黑色素瘤細胞對三氧化二砷具有較高的敏感性,砷化物在治療黑色素瘤方面頗具潛力。
進一步研究發現,三氧化二砷(5 μM)可以顯著增加G0/G1期細胞數量,并明顯減低細胞周期相關的SPF及PI(P<0.05)。這些結果提示三氧化二砷是通過阻斷細胞G1→S期進程,降低細胞增殖的活性;在三氧化二砷(5 μM)作用下,STC1的mRNA水平顯著下調,為對照組的42.51±5.62%(P<0.01)。STC1作為一種分泌型糖蛋白,通過抑制過氧化物生成,參與調節線粒體功能[17]。STC1在多種腫瘤細胞及其動物模型中都具有促進細胞增殖等作用,可以促進細胞周期G1→S期進程及減少細胞的凋亡[18,19]。由此可見,三氧化二砷對B16-F10細胞的作用機制是抑制細胞內STC1的mRNA水平,阻斷了細胞G1→S期進程,引起細胞凋亡。結合本研究的前期工作[12],可以進一步推斷在黑色素瘤中三氧化二砷通過抑制細胞內STC1的mRNA水平,影響和改變氧化還原酶的活性,增加細胞內的活性氧,阻斷了B16-F10細胞G1→S期進程,引起細胞凋亡,更詳細的相關機制是本研究后續將要深入探討的部分。
綜上所述,三氧化二砷可以顯著抑制B16-F10細胞增殖并促進細胞凋亡,作為一種潛在的治療藥物,為晚期黑色素瘤的輔助治療提供新的思路;可能的作用機制是抑制細胞內STC1的mRNA水平,阻斷了細胞G1→S期進程,引起細胞凋亡,提示STC1可以作為黑色素瘤治療的靶點,值得進一步研究。

