多維度關注生物類似藥的管理與臨床應用
梅丹 都麗萍 張鈺宣


中圖分類號 R979.9
文獻標志碼A
文章編號1001-0408(2020)03-0373-06
DOI 10.6039/j.issn.1001-0408.2020.03.24
摘要 目的:為提高生物類似藥的管理與臨床應用水平提供參考。方法:檢索國內外藥品監管部門和世界衛生組織有關生物類似藥審批和應用管理相關的政策法規,從藥品全生命周期、通用名和處方、適應證外推、臨床用藥互換、藥物警戒、醫保支付體系、教育培訓等多維度對生物類似藥進行梳理。結果與結論:生物類似藥是指在質量、安全性和有效性方面與已獲準上市的參照藥具有相似性的治療性生物制品。在生物類似藥的研發、生產、流通、使用、監管全生命周期系列環節中的管理在不同國家/地區/組織各有特點,其在研發階段不需再獨立驗證安全性和有效性,只需用分析方法逐步從結構和功能上闡明其與參照藥高度相似性即可;我國的生物類似藥命名與原研藥相同,采用通用名處方;美國FDA批準生物類似藥的適應證外推需要基于其申請時的數據和信息、參照藥的安全性和有效性信息及適應證相關科學要素的考量,需要經過評估,在監管下有條件地使用;美國FDA審批可替換生物類似物的標準嚴格,即實現互換的審批標準要高于生物相似的審批標準,但我國目前尚無這一概念;醫藥企業、監管機構、學術機構、醫院藥房之間需溝通交流,共同加強上市后風險控制和安全性監測;我國醫療保障部門需建立適宜的支付體系并通過支付制度鼓勵生物類似藥的使用;醫務工作者要學習生物類似藥的特點,才能在了解其技術審評的基礎上,于實踐中用好生物類似藥。
關鍵詞 生物類似藥;藥品管理;臨床應用
近年來,生物制品在治療領域顯現出臨床優勢,無論國內或國外,生物制品用作治療性藥品已呈飛速增長的態勢。具有臨床價值的新的生物藥可通過綠色通道或優先審評審批程序研發上市[1,2],上市產品呈爆發式增加,但同時也帶來醫療衛生費用的快速增長[1]。生物類似藥是指在質量、安全性和有效性方面與已獲準注冊的原研藥具有相似性的治療用生物制品。以原研生物藥質量、安全性和有效性為基礎的生物類似藥的研發,提高了生物藥的可及性[3],并為臨床治療多提供了一個選擇。在挽救生命、滿足公眾對生物治療產品需求的同時,幾種治療等效的生物類似藥有望因更大的市場競爭而使治療費用降低。目前,生物類似藥已列入2019年版世界衛生組織(WH0)《基本藥物目錄》[3],將會對衛生費用的預算帶來重大影響。
2006年,歐盟批準了第一個生物類似藥,在建立生物類似藥的管理框架、審評體系、成型發展方面,為全球作H{了積極的引領作用[4]。從臨床獲得的證據表明,歐盟已批準的28種生物類似藥用于所批的適應證是安全有效的[5]。2009年,美國國會通過的《生物制品價格競爭和創新法案》[6],創造性地簡化了生物類似藥的上市途徑,替換FDA已批準的生物制品,在解決可及性問題的同時降低了費用。我國也在2015年發布了《生物類似藥研發與評價技術指導原則(試行)》[7],旨在規范生物類似物的研發與評價,推動生物醫藥行業的健康發展。2019年2月22日,用于治療非霍奇金淋巴瘤的首個國產生物類似藥利妥昔單抗(商品名:漢利康)獲批上市[8];同年11月7日,國內首個阿達木單抗生物類似藥獲批。本文通過梳理國內外相關審評審批制度和應用管理政策法規與文獻,為提高生物類似藥的藥事管理和臨床應用水平提供參考。
l 概述
從市場看,2018年全球銷售額排名前10位的藥物中,8個是生物制品,年銷售額突破767.2億美元[9],聚焦的疾病領域包括抗腫瘤、風濕免疫、眼部疾患、炎性腸病和血液疾病等,均是目前臨床治療需求活躍的領域。醫院藥事管理與藥物治療委員會對新藥申請和遴選的總體原則一般是在滿足臨床患者需求的同時,體現學科發展方向,生物藥和生物類似藥正逐漸成為醫院藥事管理與藥物治療委員會遴選藥品的重要組成部分。生物制品是以微生物、細胞、動物或人源組織和體液等為起始原材料,用生物學技術制成的用于診防治疾病的制劑[10],具體包括治療用蛋白(如非格司亭)、單克隆抗體(如阿達木單抗)和疫苗(如流感疫苗)等。因其特點不同于傳統的化學藥和化學仿制藥,為確保臨床用藥的安全、有效和經濟,更需要藥師為醫院藥事管理與藥物治療委員會準備充足且不偏倚的材料,只有讓醫院相關管理部門和臨床醫師從概念、審批、差異等方面深刻理解生物類似藥,才能讓生物類似藥進入處方集并在臨床實踐中發揮作用及提供理論基礎。
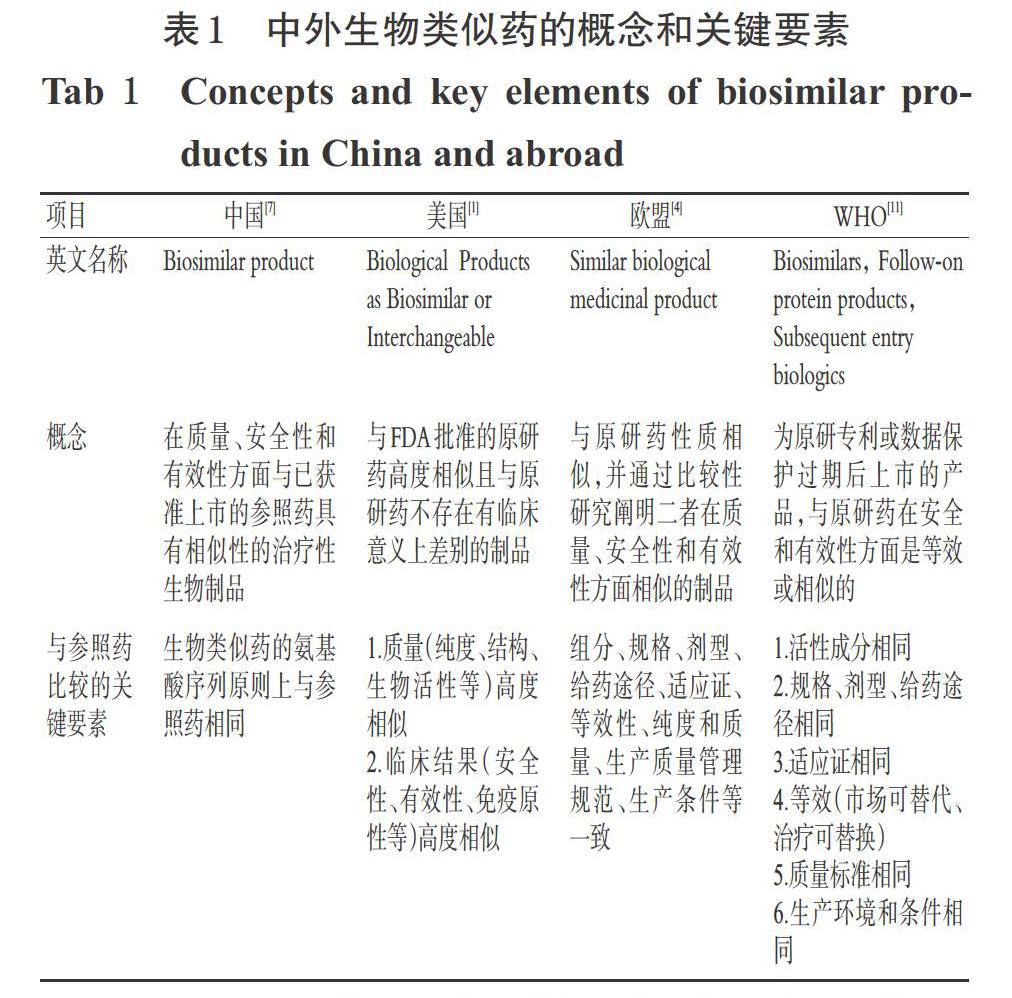
與生物類似藥相對應的,市場上已有的按照新藥研發和生產且已獲準注冊的生物制品被稱為原研藥(Ref-erence product),其具有完整安全性和有效性研究數據[1],是生物類似藥開發的參照藥。中外生物類似藥的概念和關鍵要素見表1。
由表1可見,臨床慣用的化學藥和仿制藥是結構和治療學等效,而生物類似藥與參照藥比較是高度相似但更為復雜,除臨床非活性成分的細小差別外,與參照藥在安全性和有效性方面不存在有臨床意義的差別。從臨床應用的角度,生物類似藥除了與參照藥在品名、組分、規格、劑型、給藥途徑、適應證、純度和質量、生產條件和質量管理等一致外,還應綜合考慮包裝的適用性、貯存條件和有效期等因素。
2 從藥品全生命周期關注生物類似藥
生物藥的特點是分子量比化學藥大成百上千倍,具有復雜的多級結構和理化性質,且生產工藝復雜,完全等同復制極為困難。因開發不易,申報難,生產罐的大小、產能、批量等受限因素多,臨床研究費用高昂等,導致生物類似藥應運而生。特別是在臨床需求、醫保控費及資本市場的推動下,全球生物類似藥的研發異常火熱,截至2019年5月29日,全球生物類似藥研發處于活躍狀態的有718個、上市121個、注冊階段31個、Ⅲ期臨床試驗階段72個、Ⅱ期臨床試驗階段8個、I期臨床試驗階段75個,還有386個處于開發階段[9]。我國在研生物類似藥以251個的數量優勢領先全球。
研發、生產、流通、使用、監管是藥品全生命周期的系列環節,每個環節均有其需要注意的內容。
2.1 從研發的角度
原研產品要經過完整的非臨床和臨床試驗系統評價來獲批上市,而生物類似藥不需再獨立驗證其安全性和有效性,只需用分析方法逐步從結構和功能上闡明其與參照藥高度相似性,可避免重復、耗費很長周期且花費高昂的臨床試驗。
鑒于某一企業生產的產品很難被另一藥企完全精細復制,生物類似藥的研發是以藥學、非臨床和臨床比對試驗證明其與參照藥的相似性[12],保障其安全、有效和質量可控[7]。我國生物類似藥研發評價要素見表2。
2.2 從審批的角度
生產生物類似藥的藥企可依靠某些已發布的原研藥的安全性和有效性數據來作為支撐[1]。美國FDA在考慮發證時,會全面評價數據和信息并結合公眾對原研藥的認知,如果原研品存在免疫原性等不良結果,則會要求提供更嚴格的生物類似藥免疫應答數據[1]。即便是快速審評審批并不降低標準,所需的數據包要求依然非常全面。對可替換產品,還需提供針對特定患者與原研藥相同的臨床結果,證明不會增加安全性風險或降低有效性[1]。
2.3 從生產的角度
藥企應用最先進的技術保證生物類似藥的產品特性和生物活性與參照藥高度相似,仔細監控生產過程的差異,因為源自生產過程的內在變異會給產品定性和生產過程帶來挑戰[1]。同一產品不同批次間的細微內差在制造過程中是正常可接受的,也是可預期的。美國FDA強調通過評價制造過程和制造商控制產品內變異的策略來確保生產出具有臨床一致性的生物制品。
2,4 從臨床的角度
臨床無差異是指不同產品在安全性、純度、效價方面沒有差異,具體通過人體藥動學(暴露量)和藥效學(反應)研究、臨床免疫原性評估,必要時還可能需要結合臨床試驗來證實[1]。當生物類似藥被藥監部門批準上市后,會在標簽和說明書上體現。美國的紫皮書中收載了FDA已批準的生物類似藥,其列表有生物制品許可證碼、生物類似藥通用名、參照藥通用名和商品名、批準日期、參照藥專利過期時間等[13]。同時在FDA網站的Drugs欄目下可查詢評估概要信息,即批準信息和管理咨詢信息。我國的上市藥品目錄集尚未收載相關信息。
3 從通用名和處方關注生物類似藥
藥品的名稱是一切應用的基礎,標準化至關重要,我國現在多已采用WHO的國際非專利名(INN名稱)作為藥品通用名。各國關于生物類似藥的通用名規則見表3。
由表3可見,不同國家和地區制定的命名規則是有區別的。通用名即INN是基本組成,原研藥和生物類似藥都要用到。隨著生物類似藥的不斷上市,需要通過命名區分不同產品:有直接采用通用名但要求處方時必須加注商品名的,有采用通用名加獨立識別碼(數字或字母)為名而不必要求用商品名的。有區別的通用名規則要求處方、收費、調配、發藥及藥品不良反應監測應具體到品種,如原研藥與生物類似藥采用相同的通用名,則需在應用環節加注廠牌、商品名和批號等可區分的項目。生物類似藥與參照藥的通用名有所區分,可降低處方或藥房調劑差錯的發生風險,并將藥品不良事件與特定的產品準確關聯,以實施有效監管。但我國的生物類似藥命名與原研藥相同,采取的是不區分原則,有關藥物警戒和和替換建議在說明書中進一步明確[15],結合我國醫院處方必須用通用名開方的要求,建議宜在開方、審方、收費、調劑、配發乃至藥物警戒環節要有內部溯源手段,以保證患者健康和用藥安全。
4 從適應證外推關注生物類似藥
生物類似藥獲批的適應證與參照藥是相同的,當獲批了一個與參照藥相同的適應證后,可以獲批參照藥其他適應證,被稱為外推。但生物類似藥廠家必須提供科學證據來支持外推。外推適應證是由藥品審評部門批準的,例如美國FDA批準外推需基于以下信息:(1)生物類似藥申請時的所有數據和信息;(2)審批參照藥適應證已知的安全性和有效性信息;(3)每個適應證相關的不同科學要素的知識和考量[1]。所以要清楚參照藥在所批適應證的作用機制、藥動學、藥效學、有效性、安全性和免疫原性,即便是作用機制及靶點相同的,FDA也要評估無差異后才能使類似物獲得外推適應證。對合并用藥人群、不同合并疾患者群及存在不同推薦劑量等情形,外推須很慎重[1]。為此,醫務人員要仔細閱讀說明書,為患者開具適宜的藥品。當臨床實踐中出現說明書之外的用法時,建議經醫院醫療委員會、醫院藥事管理與藥物治療委員會和專科評估后,在醫務處備案監管下有條件地使用,以降低醫院的醫療風險。
5 從臨床用藥互換關注生物類似藥
醫師的醫療目標是正確診斷并使患者獲得健康結果;藥師在為患者提供藥物治療的同時要保證藥物的正確使用和貯存;患者在沒有過度支付的情況下希望得到最有效并能負擔得起的治療;支付方確保在預算框架內的患者得到盡可能好的治療;政策制定者則是創造或維持醫療保健系統,以滿足需求、提高健康結果、保證公平性。為此,多方利益平衡的結果就是可能出現用藥的互換,具體包括原研藥與生物類似藥的轉換(Switch)或兩種生物類似藥間的替換(Substitution)。
轉換一般是指在特定患者身上,當疾病得到穩定控制時,醫師可能將患者使用的原研藥轉換為具有可互換性的生物類似藥,期望產生臨床等效并降低費用。這多是醫師根據患者個體情況作出的臨床決策,但往往需要額外的科學研究數據如交叉試驗驗證,并需要患者意愿上的支持。替換則是指同一生物類似藥不同品牌的等效產品間的選擇,國外一般不需醫師參與,而由藥師發起該行為。
針對可替換生物類似物的審批,FDA的標準更為嚴格,即實現互換的標準要高于生物相似性的審批,生物類似藥生產企業需提供風險評估數據和信息,證實其類似物與參照藥在任意患者身上都會產生相同的臨床結局,即不增加不良反應、不降低藥效。在單個患者多次交替使用中,生物類似藥的安全性和療效減少的風險應不高于持續使用參照藥的風險。但須注意的是,FDA只是批準上市,在藥房可否被替換不是其監管范疇內事務,而由各州藥品法規決定。一旦生物類似藥獲批為可替換產品,依照所在州法律規定,可能由藥師實現替換[16]。各國藥監部門有關生物類似藥互換的簡要規定見表4。
美國已批準23款生物類似藥[16],紫皮書中列表[13]標注出是否有可轉換性(Interchangeable標記),該表實時更新,有一個產品已獲批多個生物類似藥的如英夫利昔單抗,但尚未見I標記。2019年4月3日,美國國會能源商務委員會通過《2019保護消費者對仿制藥的獲取法案》[17]禁止原研藥企通過補償仿制藥企(包括生物類似藥企)而推遲仿制藥和生物類似藥進入市場。2019年5月10日,美國FDA發布了生物類似藥可互換性指南[18]。
轉換用藥的主要潛在風險因素是生物類似藥免疫原性相關經驗有限,相似并不意味著即可互換,而要有嚴格穩健的藥物警戒系統跟蹤和追溯。
6 從藥物警戒關注生物類似藥
藥物警戒是生物類似藥全生命周期安全性評價的重要手段,WHO早在十余年前就意識到生物類似藥相關藥物警戒問題,啟動制定全球規則,并于2009年發布了關注生物類似藥警戒風險一用藥安全的新挑戰[11]。2017年歐盟更新了生物類似藥指導原則[5]。美國在2015年3月6日批準第一個生物類似藥Zarxio時要求在醫院處方/給藥,從采購、電子處方等追蹤安全性并設立了療效相關生物標志物——中性粒計數——進行用藥后監測評價。
隨著生物制劑的廣泛應用,慢病用生物制劑安全性問題備受關注,特別是免疫原性的風險評估。為此,企業、監管機構、學術機構、醫院藥房間的溝通交流與信息分享非常重要[6]。國家法律法規、配套政策、指南的完善、利益相關方教育是解決患者對生物類似藥可及性和安全使用的重要基礎和保障。
7 從醫保支付體系關注生物類似藥
生物類似藥為醫師和患者提供了更多的選擇,將有效緩解患者與醫保系統的經濟壓力。艾昆緯調查數據顯示,未來5年內,生物類似藥有望為歐盟和美國市場的醫療衛生體系節約超過500億歐元的費用。《美聯邦食品、藥品和化妝品法案》在2019年修訂了生物類似藥使用費用法案(BsUFAⅡ),授權FDA收集2017年10月一2022年9月生物類似藥的費用[19]。FDA還頒布了生物類似藥使用計劃(Biosimilars action plan,BAP)[20]和生物類似藥可互換性指南[18],旨在鼓勵開發創新和競爭,同時也促成生物類似藥和可替換產品的批準,以表明其支持生物類似藥在拯救生命或改善生活質量、使公眾健康獲益的同時降低病患費用方面的態度。我國的醫療保障涵蓋了藥品的保險目錄遴選、采購、高價值藥品談判,更具挑戰的是建立適宜的支付體系并通過支付制度鼓勵生物類似藥的使用。
8 從教育培訓關注生物類似藥
藥師作為生物類似藥教育培訓的重要參與者、主導者,首先,要告知醫務人員和患者,在說明書批準的適應證上,生物類似物和參照藥是沒有差別的,同樣安全有效[3]。向醫師解釋清楚生物類似藥的一致性信息會比簡單呈遞新藥批件和行政命令要求、廣告更為讓他們信服。2017年歐盟發布了新指南[5],旨在從科學和法規兩方面提升醫務人員對生物類似藥的理解。跟蹤更新的藥物治療方案,協助醫師開展患者用藥的教育和干預,在生物類似藥成為慢病治療藥的一部分時提供專業技術的支持是藥師處理復雜用藥的工作之一。FDA下屬藥品審評中心的小型工商業支持項目( Small business&industry assistance,SBIA)[21]從2013年8月開始在其網站提供多媒體學習資源,藥師和藥學技術員可通過文字資料、更新的數據庫、錄制的幻燈片和社交媒體信息學習理解生物類似藥。網站還為咨詢委員會和政府雇員更好地理解相關法條的管理框架和關鍵要點提供了課件,都是藥師可以深入學習借鑒并在藥師繼續教育平臺實踐的手段。
9 結語
總體而言,生物類似藥的研發、商業化和臨床應用都進入了蓬勃發展的時期,我國在解決國內患者生物制品藥物可及性的同時,要遵循生物類似藥研發規律,夯實生物制品民族產業基礎。利好的政策(監管、審批、法規、醫保支付等)極大地推動了生物類似藥的商業化進程,但極度激烈的競爭可能會導致市場無序甚至存在突破底線的潛在風險,醫師和藥師等醫務工作者在加深理解生物類似藥的同時,應關注其在上市后真實世界數據、有效性和安全性評價,充分發揮生物類似藥的優勢。
參考文獻
[1]FDA. Biosimilars are safe,effective treahnent options[EB/01]. (2018-09-06) [2019-08-26]. https://www.FDAgov/drug s/therapeutic-biologic s-applications-bla/biosimi-lars.
[2] 國家藥品監督管理局.國家藥品監督管理局藥品審評中心關于鼓勵藥品創新實行優先審評審批的意見[EB/OL].(2017-12-21) [2019-09-02].http://www.cde.org.cn/poli-cy.do?method=view& id=418
[3]WHO. World health organization model list of'essentialmedicines 21st list 2019[EB/OL]. (2019-07-09) [2019-09-06] .https: //apps.who.int/iris/bitstream/handle/10665/325771/WHO-MVP-EMP-IAU-2019.06-eng.pdf?ua=l
[4]EMA. Guideline on similar biologicalmedicinal products[EB/OL].(2005-10-30) [2019-09-05]. https://www.emaeuropa.eu/en/doc uments/scientific-guideline/guideline-similar-biological-medicinal-products_en.pdf.
[5]EMA. New guide 0n biosimilar medicines.for healthcarepro fessionals increasing understanding o[biosimilar medi-cine.s'[EB/OL]. (2017-05-05) [2019-09-04].https://wwwema.europa.eu/e n/documents/press-releas e/new-guide-bi-O similar-medicines-healthcare-pro fe ssionals-increa sing-understanding-biosimilar_en.pdf
[6]U.S. Department of Health and Human Services,FDA,CDER, et a1.BiosimilaritV biosimilars: additional ques-tions and answers regarding implementationD,'the biolog-ics piice competition and innovation act of'2009 guidance.for industry[EB/OL]. (2015-05)[2019-09-16].http://pharma-bio.com/wp-content/uploads/2015/06/FDA_Biosi-milars_Q&A.pdf.
[7]國家食品藥品監督管理總局,生物類似藥研發與評價技術指導原則:試行[EB/OL].(2015-02-28) [2019-08-12]http://www.nmpa.gov.c n/WS04/CL2138/300003.html
[8]國家藥品監督管理局首個國產生物類似藥利妥昔單抗獲批上市[EB/OL].(2019-02-25)[2019-08-12]. http://www.nmpa.gov.cn/W S04/CL2056/335194.html
[9] 肖恩2019全球生物類似物研發報告[EB/OL].( 2019-08-06) [2019-10-3l].http://www.360doc.com/content/19/0806/19/52645714 853361880.shtml
[10]國家藥典委員會中華人民共和國藥典:三部[S]. 2015年版北京:中國醫藥科技出版社,2015:XTX.
[1 1]WHO. Pharmacovigilance .focus-biosimilar medicinesand sa fety:newcha Henges.for pharmacovigilance[EB/OL][2019-09-05].https://www.who.int/medicine s/publica-tions/druginformation/issues/Druglnf009v23-2.pdf.
[12]國家藥品監督管理局,國家藥監局藥品審評中心生物類似藥研發相關問題問與答[EB/OL].(2019-07-31)[2019-09-02].http: //www.cde.org.c n/news.do?method=viewln-foCommon&id=314906.
[13]FDA. Background information:lists of Iicensed biologicalproducts with reference product exclusivity and biosimilar-ity or interchangeability evaluations (puiple book) [EB/01]. (2019-07-02) [2019-09-16]. https://www.FDAgov/drugs/biOsimilars/background-information-lists-li-censed-biological-products-reference-product-exclusivity-and
[14] 國家藥典委員會生物制品通用名命名原則規程[EB/OL].(2017-02-12)[2019-09-16]. http://www.chp.orgcn/upload/userfiles/20170301/97081488335137530.pdf.
[15] 國家藥品監督管理局關于生物類似藥臨床研究用原研參照藥進口有關事宜的公告[EB/OL].(2019-05-27)[2019-08-12].http://www.nmpa.gov.cn/WS04/CL2138/338047.html.
[16] FDA. Biosimilar product information[EB/OL].(2019-07-23) [2019-09-1 6]. https: Uwww.FDA.gov/drugs/biosimi-lars/biosimilar-product-info rmation
[17]House Committee on Energy&Conuuerce. EC chairmanpallone on pa.s'.s'age of'12 b///.s to lower health care andprescription drug costs .for consumers[EB/OL]. (2019-04-04) [2019-09-16]. https://energycommerce.house.gov/newsroom/press-releases/ec-chairman-pallone-on-passage-of-12-bills-to-lower-health-care-and.
[18] Center for Drug Evaluation and Research, Center for Bio-Iogics Evaluation and Research of FDA. Considerationsin demonstrating interchangeability with a reference prod-uct guidance .for /ndushy[EB/OL]. ( 2019-05-10 ) [2019-09-16] .https : //www.FDA.gov/regulatory-information/se-arch-FDA-guidance-documents/considerations-demonstra-ting-interchangeability-re ference-product-guidance-indus- try.
[19]FDA. Biosimilar user .fee amendments[EB/OL]. (2019-08-16) [2019-09-16].https ://www.FDA.gov/industry/FDA-user-fee-programs/biosunilar-user-fee-amendments.
[20] FDA. Bio.s-imilar action p/an[EB/OL].(2018-07-18)[2019-09-16].https : //www.centerforbiosimilars.com/news/FDA-releases-biosimilar-action-plan.
[21] FDA. Patient and prescriber outreach materials[EB/OL].(2018-05-22) [2019-09-16].https://www.FDA.gov/drugs/biosimilars/patient-and-prescriber-outreach-materials.
(收稿日期 :2019-10-04 修期:2019-11-25)
(編輯:劉明偉 )

