黃芪多糖對CPZ誘導的急性脫髓鞘模型的保護作用
邢雁霞 李自青 劉斌焰 趙一錦 章培軍 劉斌鈺 馬存根
(1大同大學醫學院腦科學研究所,山西 大同 037009;2山西中醫藥大學“2011”協同創新中心)
少突膠質細胞是中樞神經系統(CNS)中一群高度分化的神經膠質細胞,其主要功能是在軸突周圍形成緊密的多層髓鞘,維持神經元軸突的存活和正常功能。少突膠質細胞分化不良或受損后影響髓鞘的正常功能,導致CNS脫髓鞘疾病,如多發性硬化(MS)〔1〕。雙環己酮草酰二腙(CPZ)是一種銅離子螯合劑,小劑量CPZ能特異性誘導少突膠質細胞死亡,引發CNS脫髓鞘,但對神經元的影響較小〔2〕。中醫學認為脫髓鞘疾病屬于“痿癥”的范疇,治療以補氣為主。黃芪具有益氣扶正,養陰生津,補氣升陽,益衛固表等作用,其主要化學成分為黃芪多糖(APS)。課題組前期研究發現黃芪多糖具有提高機體免疫功能、增強耐力、延緩衰老等作用〔3~6〕,黃芪糖蛋白能通過抗炎和免疫調節機制減輕實驗性自身免疫性腦脊髓膜炎(EAE)小鼠髓鞘的脫失,促進神經修復〔7,8〕。目前對于APS不涉及免疫調節的機制下治療脫髓鞘疾病,國內未見有報道。本實驗主要觀察APS對CPZ誘導的急性脫髓鞘小鼠的神經保護作用,探討其治療髓鞘脫失疾病的可能性。
1 材料和方法
1.1材料
1.1.1動物 8周齡雌性C57BL/6小鼠購自北京維通利華實驗動物技術有限公司,體重18~22 g,健康清潔級,飼養于大同大學腦科學研究所實驗動物中心,實驗前小鼠在無病原菌動物房自由飲食喂養1 w。
1.1.2試劑 APS(S31346)和CPZ(S30349)均購自北京博揚宏達科技有限公司;大鼠抗小鼠MBP單克隆抗體(monoclonal antibody,mAb)(550280)購自英國AbD Serotec公司;Alexa Fluor 488 熒光標記的二抗(#4416S)購自美國Cell Signaling公司。
1.1.3儀器 日本Olympus 熒光顯微鏡(BX51);德國Leica冰凍切片機(CM1950);北京賽多利斯天平有限公司電子天平(BS210S)。
1.2方法
1.2.1模型制備與給藥 通過含0.2%CPZ的混合飼料連續喂食小鼠來誘導建立脫髓鞘模型〔9〕。54只小鼠隨機分為三組:正常組,CPZ組,APS組,每組18只,每組根據觀察時間(4、5和6 w)分為三個亞組,每個亞組6只。正常組小鼠采用普通飼料飼養,CPZ組和APS組小鼠食用含有0.2% CPZ的特殊飼料,持續喂養6 w。從第2周開始,APS組按500 mg/(kg·d)腹腔注射APS,CPZ組給予等量生理鹽水,持續給藥至實驗結束。
1.2.2標本制備 實驗第4、5和6周末,各組取6只小鼠采用0.3 g/L戊巴比妥鈉按0.2 ml/只 腹腔注射麻醉后,采用40 g/L多聚甲醛灌注進行組織固定,小心剝取腦組織,取4只用最佳切削溫度化合物(OCT)包埋后制成7 μm冷凍切片,用于髓鞘固藍(LFB)染色和免疫熒光組化染色;剩余2只常規做石蠟包埋并切片,用于蘇木精-伊紅(HE)染色。
1.2.3髓鞘染色 采用LFB染色法顯示髓鞘,配制LFB染液〔8〕,將腦組織切片在95%乙醇溶液中浸泡15 min后,轉入LFB染液37℃過夜,95%乙醇和雙蒸水漂洗,0.05%碳酸鋰溶液分化,70%乙醇分色,蒸餾水終止分色,梯度乙醇脫水、二甲苯透明、中性樹膠封片。鏡下觀察,用 Image-Pro Plus6.0 軟件計算腦組織染色平均光密度值。
1.2.4免疫熒光組織化學染色 取腦組織冰凍切片置室溫下晾干,先用0.01 mol/L磷酸鹽緩沖液(PBS)洗3次,5 min/次;用1%胎牛血清白蛋白(BSA)以1∶1 000的比例稀釋髓鞘堿性蛋白(MBP)一抗抗體,4℃冰箱中孵育過夜;次日再用PBS洗3次,5 min/次,濾紙吸干,加入Alexa Fluor 488熒光標記的二抗(1∶1 000)室溫孵育2 h;PBS洗3次,5 min/次。再加入染核液(1∶1 000)室溫孵育5 min,PBS洗3次,5 min/次,甘油封片,熒光顯微鏡觀察每個切面腦組織MBP陽性細胞熒光強度,用Image-Pro Plus 6.0 軟件統計。
1.2.5HE染色 常規做小鼠腦組織石蠟包埋并切片,每張切片厚度為5 μm,HE染色,中性樹膠封片,光鏡下觀察腦組織形態學變化,并用Image-Pro Plus 6.0 軟件分析每個切面腦組織小膠質細胞的數量。
1.2.6小鼠體重、進食量和全腦重量檢測 實驗開始為每只小鼠放入相應飼料10 g,以后每天固定時間記錄放入籠中的新鮮飼料重量和剩余飼料重量;實驗期間每隔1 d給小鼠稱重并記錄,在喂養4、5和6 w末將小鼠麻醉取腦,置于稱量杯中用電子天平稱出腦濕重,根據腦組織重量計算臟器系數(臟器系數=臟器重量/體重×100%)。
1.3統計學分析 采用SPSS19.5軟件進行方差分析。
2 結 果
2.1APS對CPZ小鼠體重的影響 采用CPZ造模前三組小鼠體重無顯著差異(F=1.05,P=0.364)。造模第1周末CPZ組與APS組小鼠體重均減輕,與正常組小鼠體重比較有顯著差異(F=3.46,P=0.046);但兩組間比較無明顯差異(P>0.05);第2~6周正常組小鼠體重呈逐漸增加的趨勢,且明顯高于APS組、CPZ組(P<0.05,P<0.001);CPZ組小鼠體重低于APS組(P<0.05,P<0.01,P<0.001)。見表1。

表1 三組造模前及造模后不同時間體重比較
與正常組比較:1)P<0.05,2)P<0.001;與APS組比較:3)P<0.05,4)P<0.01,5)P<0.001
2.2APS對CPZ小鼠進食量的影響 造模前三組小鼠的進食量無顯著差異(F=2.593,P=0.093)。造模第2~6周,與正常組相比,CPZ組和APS組小鼠進食量均明顯降低(F=71.71、89.33、82.85、69.41、80.12,均P<0.001),且CPZ 組小鼠進食量明顯低于APS組小鼠(P<0.001)。見表2。

表2 三組造模前及造模后不同時間進食量比較
與正常組比較:1)P<0.001,與APS組比較:2)P<0.001,下表同
2.3APS減輕CPZ小鼠髓鞘的脫失 用LFB染色法觀察5 w末小鼠腦組織髓鞘變化:正常組小鼠腦組織LFB染色后呈深藍色,致密均勻,OD值為(0.29±0.024),顯著高于CPZ組和APS組(0.16±0.018,0.23±0.019,P<0.001)。CPZ組染色明顯變淺,呈現淡藍色塊狀,APS有效改善了髓鞘脫失,APS組與CPZ組比較差別有統計學意義(P<0.001)。見圖1。

圖1 3組腦組織LFB髓鞘染色(×200)
2.4APS促進CPZ小鼠腦組織MBP的表達 免疫熒光組化雙染法觀察造模后4~6 w小鼠腦組織MBP的表達,實驗結果發現:正常組小鼠腦胼胝體切片中MBP陽性纖維完整、無損失;CPZ組顯示明顯而廣泛的髓鞘損傷,MBP陽性纖維斷裂以造模后5 w最為明顯,MBP的表達量明顯下降;APS組可見有完整的MBP陽性纖維及結構重建,提示APS能促進髓鞘的再生修復(圖2~4)。對MBP平均熒光強度進行IOD值的統計發現:與正常組相比,CPZ 組和APS組小鼠的IOD值明顯下降(P<0.001);APS組小鼠IOD值明顯高于CPZ模型組(P<0.001),APS明顯促進了CPZ小鼠髓鞘的再生修復。見表3。

圖2 造模后4 w 3組小鼠腦組織MBP的表達(免疫組化,×400)

圖3 造模后5 w 3組小鼠腦組織MBP的表達(免疫組化,×400)

圖4 造模后6 w 3組小鼠腦組織MBP的表達(免疫組化,×400)
2.5APS對CPZ小鼠腦組織形態學的影響 造模后4~6 w腦組織石蠟切片HE染色可見正常組小鼠有成熟的神經元,且分布均勻,小膠質細胞分布較少;CPZ組小鼠小膠質細胞聚集,數量明顯增多,5 w達高峰,神經元排列紊亂,空泡形成;APS組神經元病理性損傷減輕,小膠質細胞數量較CPZ組減少(P<0.001),見圖5,表4。

表3 造模后不同時間APS增加CPZ小鼠腦MBP的表達
與正常組比較:1)P<0.001;與APS組比較:2)P<0.001

圖5 3組造模后不同時間腦組織形態學改變(HE ×400)
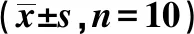
表4 造模后不同時間APS減少CPZ小鼠腦組織小膠質細胞數
與正常組比較:1)P<0.001;與APS組比較:2)P<0.05,3)P<0.001
2.6APS對CPZ小鼠臟器系數的影響 各組組間造模后4、5、6 w全腦重量比較差異有統計學意義(P<0.05,P<0.01),見表5。

表5 造模后不同時間APS對CPZ小鼠腦重量的影響
與正常組比較:1)P<0.01,與CPZ組比較:2)P<0.05,3)P<0.01
4~6 w各組臟器系數分別為:正常組1.52±0.99、1.45±0.87和1.41±0.79;CPZ組2.07±0.64、1.99±0.89和1.98±0.69;APS組1.79±0.59、1.70±0.67和1.68±0.76。各組組間比較差異有統計學意義(P<0.05,P<0.01)。APS增加了CPZ小鼠腦重,降低了臟器系數。
3 討 論
CPZ是Cu2+螯合劑,含Cu2+的輔酶在細胞內濃度極為有限,如干擾Cu2+在細胞內濃度的穩定性可導致神經變性,小劑量(0.2%)CPZ通過干擾Cu2+對酶抑制而產生神經毒性。CPZ作用于C57BL/6小鼠可明顯誘導其CNS少突膠質細胞凋亡,引起髓鞘脫失〔10〕。利用這一特性,CPZ可用于建立MS等脫髓鞘疾病的動物模型,該模型的優勢是與MS復發緩解的病理特點相似,可從髓鞘的脫失和再生角度對疾病進行模擬。
小鼠的體重變化和進食量可反映機體的整體狀態和疾病的進展程度,腦臟器系數則較好地反映了CPZ對腦的毒性作用及APS的干預效應。體重減輕可能與CPZ導致小鼠攝食能力的下降和病情有關;進食量減少是CPZ的味道不佳,還是抑制攝食中樞或病情所致有待進一步研究。本研究結果,提示APS可減輕CPZ的毒性作用,保護腦組織。中醫認為MS是“痿證”,明·方隅《醫林繩墨》認為“痿者,氣之軟弱也……,氣虛血瘀證”;《內經》言調理氣血應“疏其氣血,令其調達,以致和平”,故中醫理論認為補益氣血可改善MS患者的臨床癥狀。黃芪無論從傳統用藥還是現代應用,均顯示出良好的補益氣血作用,APS是黃芪的有效單體成分,具有廣泛的藥理作用,如神經保護功能、對抗氧化應激誘導的神經變性及提高記憶力等,由此推測APS通過健脾補氣增加小鼠進食量、體重和機體耐力。
MS的脫髓鞘和神經變性病變與小膠質細胞活化有關。一般情況下,不活化的小膠質細胞有助于神經元室內穩態。過度活化的小膠質細胞通過產生活性氧(ROS)和活性氮(RNS),誘導線粒體功能障礙,進而直接損傷少突膠質細胞前體細胞和神經元〔11,12〕。給予小鼠含cuprizone 的飼料2 w后,腦內小膠質細胞聚集,第3周髓鞘脫失顯著且小膠質細胞聚集數量增加,4~6 w病變達高峰〔13〕。Lindner等〔14〕將17β-雌二醇給予CPZ模型小鼠時,小膠質細胞活化的延遲,髓鞘脫失減輕。Millet等〔15〕研究報道表明注射蛋白酶體抑制劑乳胞素,可促進CPZ小鼠髓鞘再生,并伴有小膠質細胞和巨噬細胞數量減少。體內給予小膠質細胞活化抑制劑米諾環素可抑制小膠質細胞的活化與增殖,阻止cuprizone引起的脫髓鞘〔13〕。本實驗可見小膠質細胞在cuprizone 引起的脫髓鞘動物模型中具有有害作用,抑制小膠質細胞的聚集與活化可減少髓鞘脫失,促進髓鞘再生。
本實驗LFB 染色顯示CPZ組小鼠髓鞘染色變淺、斷裂或缺失,提示造模成功;APS組小鼠髓鞘脫失減輕,證實APS有不同程度的髓鞘修復作用。MBP是CNS髓鞘的主要蛋白質,用于評價髓鞘的形成和發展,判斷神經損傷的嚴重程度、損傷范圍的指標〔16〕。MBP染色顯示CPZ組小鼠MBP陽性纖維有明顯而廣泛的斷裂,MBP的表達量顯著下降,以造模后5 w最為明顯;APS組小鼠腦組織有完整的MBP陽性纖維及結構重建,提示APS能促進髓鞘的再生修復。綜上,APS對CPZ誘導的急性脫髓鞘小鼠具有較好的神經保護作用。

