GPD1L在腎透明細胞癌中的表達及其臨床意義
劉仁?許曉明?羅勇?馮源發?周瑞?鐘惟德
【摘要】目的 分析甘油磷酸脫氫酶1樣抗原(GPD1L)在腎透明細胞癌中的表達及其臨床意義。方法 選用包含79例腎透明細胞癌及10例腎臟正常組織的組織芯片,使用免疫組織化學染色法(免疫組化)檢測GPD1L蛋白的表達情況,并運用癌癥基因組圖譜(TCGA)數據庫收集包含GPD1L mRNA資料的腎透明細胞癌患者相關資料。觀察組織芯片中腎臟正常組織與腎透明細胞癌組織GPD1L蛋白的表達部位及表達強度,分析TCGA中腎臟正常組織與腎透明細胞癌組織GPD1L基因的表達水平差異。按基因芯片或TCGA中腎透明細胞癌GPD1L蛋白或mRNA表達情況分為高表達組與低表達組,分析腎透明細胞癌患者GDP1L蛋白或mRNA表達與臨床特征及總體生存期(OS)的關系。應用單因素和多因素Cox比例風險回歸分析腎透明細胞癌患者OS的影響因素。結果 組織芯片中,GPD1L蛋白陽性染色呈棕黃色或褐色,在腎透明癌細胞與腎臟正常組織中主要表達于腎小管上皮的細胞胞質中,GPD1L蛋白在腎透明細胞癌組織表達強度低于其在正常腎臟組織中的表達強度(P < 0.001),GPD1L蛋白低表達組中病理分級高和臨床分期晚者比例高于高表達組(P均< 0.05)。TCGA中,腎透明細胞癌組織GPD1L mRNA表達水平低于腎臟正常組織(P < 0.05),GPD1L mRNA低表達組中女性、病理分級高、臨床分期晚、有轉移、死亡者比例均高于高表達者(P均< 0.05), GPD1L mRNA低表達組OS低于高表達組(P < 0.001)。Cox比例風險回歸分析顯示,GPD1L mRNA表達水平、年齡、腫瘤轉移為腎透明細胞癌OS的影響因素(P均< 0.05)。結論 GPD1L的表達與腎透明細胞癌密切相關,可考慮作為臨床診斷及預后的分子標志物。
【關鍵詞】腎透明細胞癌;甘油磷酸脫氫酶1樣抗原;預后
Expression and clinical significance of GPD1L in clear cell renal carcinoma Liu Ren, Xu Xiaoming, Luo Yong, Feng Yuanfa, Zhou Rui, Zhong Weide. Department of Urology Surgery, Guangzhou First Peoples Hospital, Guangdong Key Laboratory of Clinical Molecular Medicine and Diagnostics, Guangzhou Medical Univ-ersity, Guangzhou 510180, China
Corresponding author, Zhong Weide, E-mail: wdezhong@ 21cn. com
【Abstract】Objective To investigate the expression and clinical significance of GPD1L (glycerol-3-phophate dehydrogenase 1 like) in clear cell renal carcinoma.? Methods Tissue microarrays including 79 cases of clear cell renal carcinoma and 10 cases of normal tissuess were selected. The expression level of GPD1L protein was detected by immunohistochemistry. Relevant data including GPD1L mRNA data of patients were collected by the TCGA database. The expression location and intensity of GPD1L protein were quantitatively analyzed between two groups. The expression level of GPD1L mRNA was statistically compared between two groups in TCGA database. According to the expression levels of GPD1L protein and mRNA in the microarray or TCGA database, all patients were assigned into the high and low expression groups. The correlation between the expression of GPD1L mRNA, clinical features and overall survival (OS) was analyzed. The influencing factors of OS were identified by univariate and multivariate Coxs proportional hazard regression analyses.? Results In the tissue microarray, GPD1L protein was positively stained as yellow brown or brown, mainly expressed in the cell cytoplasm of the renal tubular epithelium of the clear cell renal carcinoma and normal renal tissues. The expression intensity of GPD1L protein in the clear cell renal carcinoma was significantly lower than that in normal renal tissues (P < 0.001). The proportion of patients with high grade and late clinical stage in the low expression of GPD1L protein group was significantly higher compared with that in the high expression group (both P < 0.05). In TCGA database, the expression level of GPD1L mRNA in the clear cell renal carcinoma tissues was remarkably lower than that in the normal renal tissues (P < 0.05). In the low expression of GPD1L mRNA group, the proportion of female patients, those with high pathological grade, high clinical stage, metastasis and death was significantly higher compared with those in the high expression group (all P < 0.05). In addition, the OS in the low expression group was significantly shorter than that in the high expression group (P < 0.001). Coxs proportional hazard regression analysis demonstrated that the expression level of GPD1L mRNA, age and tumor metastasis were the influencing factors of the OS of patients (all P < 0.05). Conclusion The expression of GPD1L is intimately correlated with clear cell renal carcinoma, which can be considered as a molecular marker for clinical diagnosis and prognosis.
【Key words】Renal clear cell carcinoma;GPD1L;Prognosis
腎細胞癌起源于腎臟表皮,90%的腎癌都屬于腎細胞癌。這種惡性腫瘤包括了超過10種組織和分子亞型,對后續的診斷和治療都造成了很大的困擾。腎透明細胞癌是腎細胞癌中最常見的類型,接近75%的腎細胞癌都是腎透明細胞癌,而且也是致死率最高的腎細胞癌種類[1]。雖然腎細胞癌的臨床治療研究在近年已經取得了很大的進步,但是腎細胞癌的自然病史和預后都呈現多樣性,有的發展緩慢,有的可表現出高度的侵襲性[2]。臨床醫師需要通過早期診斷為患者提供最佳的個體化治療方案,所以尋找特異度高、靈敏度強的分子生物學指標勢在必行。這既可以避免眾多醫療資源的浪費,又可以客觀評估腫瘤的潛在轉移侵襲性和預后,對于腎透明細胞癌的個體化治療有著重要的意義[3]。
甘油三磷酸脫氫酶1樣抗原(GPD1L)的編碼蛋白是一種蛋白酶,催化甘油三磷酸轉變為磷酸甘油酮。GPD1L編碼蛋白存在于與質膜相關的細胞質中,在該處結合鈉通道、電壓門控、V型、α亞單位(SCN5a)。該基因的缺陷可導致布魯加達綜合征2型(BRS2)和嬰兒猝死綜合征(SIDS)[4]。近年來,非編碼RNA尤其是微小RNA(miR)和腫瘤之間的研究發展迅速,多項研究顯示miR-210可以靶向抑制GPD1L從而促進了腫瘤在缺氧環境中的生長,而同時miR-210又是缺氧誘導因子-1(HIF-1)的下游靶點,在多種腫瘤生長發展中起著重要作用[5]。業已證實,GPD1L在頭頸癌、肝細胞癌等腫瘤中扮演重要角色[6-7]。但是,GPD1L在腎細胞癌尤其是透明細胞癌中的作用還沒有相關的文章報道。組織芯片是將許多不同個體組織標本以規則陣列方式排布于同一載體上,這樣可以在同一實驗條件下進行同一指標的組織學研究,一次性實驗即可獲得大量的結果。癌癥基因組圖譜(TCGA)公共數據庫是通過采用高通量基因組測序、基因芯片運用多維數據整合分析方法將幾乎人類所有惡性腫瘤基因表達水平圖譜繪制出來的數據庫,通過對TCGA數據庫的研究可以為惡性腫瘤的診斷、分類標準和治療方法提供新的策略。本次采用的組織芯片包括79例腎透明細胞癌樣本及10例正常腎臟組織樣本,并利用TCGA中腎透明細胞癌的mRNA數據庫進行臨床數據分析,旨在研究GPD1L在腎透明細胞癌中的表達及其臨床意義。
材料與方法
一、材 料
組織芯片購自西安艾麗娜生物科技有限公司(BC07115a)。每張芯片包含79例腎透明細胞癌標本和10例正常腎臟組織標本,所有病例均為接受腎癌切除手術治療,手術前均未接受放射治療或化學治療。所有標本均經過HE染色并由病理科醫師明確診斷。每例標本均附有相關臨床數據,如年齡、性別、病理分級、腫瘤分期,見表1。
二、數據下載
TCGA腎透明細胞癌數據庫是一個包含553例腎透明細胞癌組織及對應癌旁腎臟正常組織的大樣本基因測序庫,本研究納入其中有GDP1L基因檢測結果及詳細臨床資料的530例腎透明細胞癌及對應癌旁腎臟正常組織進行分析,具體的臨床信息和分子特征來源于TCGA網站(http:// cancergenome.nih.gov/),見表1。
三、GPD1L蛋白表達強度檢測
使用邁新生物技術UltraSensitiveTM SP IHC 試劑盒對組織芯片進行免疫組織化學染色(免疫組化),60 ℃烘烤組織芯片40 min,使用二甲苯、無水酒精、95%酒精、80%酒精、70%酒精梯度脫蠟,過氧化氫溶液封閉15 min,減低內源性過氧化物酶活性,之后使用0. 01 mmol/L枸櫞酸鹽緩沖液(pH 6.0)進行抗原修復,待組織芯片自然冷卻至室溫,血清封閉。一抗GPD1L(1∶100,愛博泰克生物,貨號A14392)4 ℃孵育過夜,二抗室溫孵育60 min,三抗室溫孵育15 min,二氨聯苯胺試劑盒顯色,蘇木素復染細胞核。免疫組化評分由兩位病理專科醫師獨立完成,芯片染色結果根據著色強度和著色范圍進行評估。染色強度根據鏡下所見的腎小管上皮細胞的顏色深度分為0、1、2、3共4個等級,染色范圍分為0(無著色)、1 (0% ~ 10%)、2 (10% ~ 50%)、3(51% ~ 75%)、4(76% ~ 100%)共5個等級,最終得分為染色強度與染色范圍的乘積。
四、研究方法
觀察組織芯片中腎臟正常組織與腎透明細胞癌組織GPD1L蛋白的表達部位及表達強度,分析TCGA中腎透明細胞癌組織與對應癌旁腎臟正常組織GPD1L基因的表達水平差異。按基因芯片中腎透明細胞癌GPD1L蛋白表達強度分為高表達(免疫組化得分> 6分)組與低表達(免疫組化得分 ≤6分)組,按TCGA中腎透明細胞癌GDP1L mRNA表達水平分為高表達(mRNA表達水平>均值)組與低表達(mRNA表達水平≤均值)組,分析腎透明細胞癌患者GDP1L表達與臨床特征的關系。觀察TCGA中腎透明細胞癌患者的預后,使用總體生存期(OS)作為研究的終點,OS是指從確診腎透明細胞癌至患者死亡或最后一次隨訪之間的時間,繪制腎透明細胞癌患者的生存曲線,分析GDP1L對預測腎透明細胞癌患者預后的意義。
五、統計學處理
使用SPSS 24.0處理數據。計量資料以表示,組間比較采用t檢驗。計數資料以例(%) 表示,組間比較采用χ2檢驗。采用Kaplan-Meier法繪制生存曲線。應用單因素和多因素Cox比例風險回歸分析腎透明細胞癌患者預后的影響因素。P < 0.05表明差異有統計學意義。
結果
一、組織芯片中腎透明細胞癌GPD1L蛋白的表達部位及表達強度分析
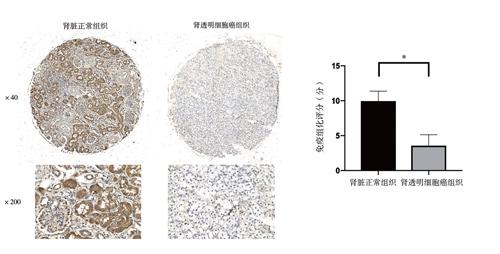
組織芯片中,GPD1L蛋白陽性染色呈棕黃色或褐色,在腎透明細胞癌與腎臟正常組織中主要表達于腎小管上皮的細胞胞質中,見圖1A。免疫組化組織芯片分析顯示,GPD1L蛋白在腎透明細胞癌組織表達強度為(3.32±2.65)分,在腎臟正常組織中表達強度為(9.87±1.33)分,組間比較差異有統計學意義(t = 12.705,P < 0.001),見圖1B。
二、組織芯片中腎透明細胞癌GPD1L蛋白表達強度與腎透明細胞癌患者臨床特征的分析
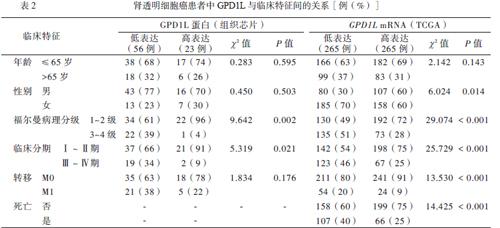
腎透明細胞癌組織芯片中,GPD1L高表達23例、低表達56例。低表達組中病理分級高和臨床分期晚者比例高于高表達組(P均< 0.05),見表2。
三、TCGA中GPD1L mRNA表達水平與腎透明細胞癌患者臨床特征及預后的分析
TCGA中,腎透明細胞癌組織GPD1L mRNA表達水平低于腎臟正常組織(t = 21.293,P < 0.05),
見圖2A。GPD1L mRNA高表達265例、低表達265例。低表達者中女性、病理分級高、臨床分期晚、有轉移、死亡者比例均高于高表達者(P均< 0.05),見表2。GPD1L mRNA低表達組OS低于高表達組(P < 0.001),見圖2B。
四、TCGA中影響腎透明細胞癌患者OS的單因素及多因素分析
對TCGA腎透明細胞癌患者的單因素分析顯示,GPD1L mRNA低表達、年齡大、臨床分期晚、病理分級高、出現轉移者OS較短(P均< 0.05);多因素分析顯示,GPD1L mRNA表達水平、年齡、腫瘤轉移是腎透明細胞癌患者OS的影響因素(P均< 0.05),見表3。
討論
在所有的腎細胞癌組織亞型中,腎透明細胞癌超過了80%,而且腎透明細胞癌是致死率、侵襲率、轉移率最高的組織亞型,對傳統化學治療和放射治療的抵抗也最強[8]。雖然近年腎透明細胞癌的治療研究取得了很大的進展,新的手術方式、分子靶向藥物的應用提高了患者的預后[9]。但是目前仍缺乏對腎透明細胞癌患者早期診斷和預后的有效評估指標,導致后續無法進行有針對性的個體化治療,或是診斷過晚或病情進展迅速而耽誤治療時機,或是治療過度而浪費了大量金錢和精力。尋找反映疾病進展過程中生理狀態和細胞變化的新生物標志物對腎透明細胞癌患者進行個體化治療和預測預后有重要意義。
GPD1L是編碼催化甘油三磷酸轉變為磷酸甘油酮的關鍵酶。已經有報道GPD1L作為miR-210的直接靶點,在腫瘤形成缺氧環境過程中發揮著重要作用,并已在肝癌、頭頸癌等有相關的研究[10]。目前,GPD1L在腎細胞癌尤其是腎透明細胞癌中的作用尚缺乏相關的研究。本研究中,與腎臟正常組織相比,GPD1L在腎透明細胞癌組織中的蛋白水平下降,這表明GPD1L可能抑制了腎透明細胞癌的發生和發展。此外,GPD1L蛋白的低表達與高病理分期、臨床轉移相關,因此導致腎透明細胞癌患者預后較差。免疫組化檢測到的GPD1L蛋白表達與TCGA數據庫中mRNA低表達均為腎透明細胞癌患者OS的影響因素。
腎透明細胞癌被認為是一種代謝相關的腫瘤疾病,缺氧的微環境在其發生和發展起著重要的作用,而其中缺氧誘導因子-1α(HIF-1α)扮演著重要的角色[11]。miR-210作為HIF-1α的下游,直接抑制著GPD1L的表達;而根據本研究結果,GPD1L可考慮作為腎透明細胞癌預后預測指標,這提示miR-210可以作為腎透明細胞癌的重要靶點,2017年Costales研究團隊發現了一種可以直接抑制miR-210的小分子藥物可提高GPD1L的表達[12]。對于其是否可以應用在腎透明細胞癌的治療中,還需要日后進一步的研究。
參 考 文 獻
[1] Hsieh JJ, Purdue MP, Signoretti S, Swanton? C, Albiges L, Schmidinger? M, Heng DY, Larkin J, Ficarra V. Renal cell carcinoma. Nat Rev Dis Primers,2017,3:17009.
[2] 范大為,劉凱,袁成剛,杜曉媛. Beclin-1與 EZH2在腎透明細胞癌中的表達及其意義. 新醫學, 2016,47(5): 329-334.
[3] Li QK, Pavlovich CP, Zhang H, Kinsinger CR, Chan DW. Challenges and opportunities in the proteomic characterization of clear cell renal cell carcinoma (ccRCC): a critical step towards the personalized care of renal cancers. Semin Cancer Biol,2019,55:8-15.
[4] Valdivia CR, Ueda K, Ackerman MJ, Makielski JC. GPD1L links redox state to cardiac excitability by PKC-dependent phosphorylation of the sodium channel SCN5A. Am J Physiol Heart Circ Physiol, 2009, 297(4):H1446-H1452.
[5] Gee HE, Ivan C, Calin GA, Ivan M. HypoxamiRs and cancer: from biology to targeted therapy. Antioxid Redox Signal, 2014, 21(8):1220-1238.
[6] Feng Z, Li JN, Wang L, Pu YF, Wang Y, Guo CB. The prognostic value of glycerol-3-phosphate dehydrogenase 1-like expression in head and neck squamous cell carcinoma. Histopathology, 2014, 64(3):348-355.
[7] Sulaiman SA, Abu N, Ab-Mutalib NS, Low TY, Jamal R. Signatures of gene expression, DNA methylation and microRNAs of hepatocellular carcinoma with vascular invasion. Future Oncol, 2019, 15(22):2603-2617.
[8] Barata PC, Rini BI. Treatment of renal cell carcinoma: current status and future directions. CA Cancer J Clin, 2017, 67(6):507-524.
[9] Li QK, Pavlovich CP, Zhang H, Kinsinger CR, Chan DW. Challenges and opportunities in the proteomic characterization of clear cell renal cell carcinoma (ccRCC): a critical step towards the personalized care of renal cancers. Semin Cancer Biol, 2019, 55:8-15.
[10] Kelly TJ, Souza AL, Clish CB, Puigserver P. A hypoxia-induced positive feedback loop promotes hypoxia-inducible factor 1alpha stability through miR-210 suppression of glycerol-3-phosphate dehydrogenase 1-like. Mol Cell Biol, 2011, 31(13):2696-2706.
[11] Sch?del J, Grampp S, Maher ER, Moch? H, Ratcliffe PJ, Russo P, Mole DR. Hypoxia, Hypoxia-inducible transcription factors, and renal cancer. Eur Urol, 2016, 69(4):646-657.
[12] Costales MG, Haga CL, Velagapudi SP, Childs-Disney JL, Phinney DG, Disney MD. Small molecule inhibition of microRNA-210 reprograms an oncogenic hypoxic circuit. J Am Chem Soc, 2017, 139(9):3446-3455.
(收稿日期:2019-09-18)
(本文編輯:林燕薇)

