神經膠質瘤中NQO1高表達在預后評估中的意義
鄭 蘭,王馨悅,韓安娜,尹香琳,王藝璇,林貞花,楊 洋
神經膠質瘤是神經系統最常見的惡性腫瘤,其發病率占顱內腫瘤總發病率的40%~50%,且具有發病隱匿、惡性度高等特點,多數患者就診時已為疾病晚期。因此,亟待尋找神經膠質瘤的早期診斷及預后評估的有效分子靶標,以改善神經膠質瘤患者的預后。NQO1基因定位于16p22,長度為20 kb,含有6個外顯子和5個內含子。它主要通過雙電子還原反應使醌類化合物變成低毒性的氫醌類物質,從而使細胞免受氧化損傷[1-2]。研究顯示,NQO1蛋白高表達與多種腫瘤的發生、發展密切相關,如甲狀腺[3]、卵巢癌[4]和結腸癌[5]等。其中,Yang等[6]研究顯示,NQO1蛋白高表達可作為乳腺癌評估的獨立風險因素。目前,關于NQO1與神經膠質瘤的文獻報道較少。因此,本文旨在應用免疫組化EnVision法檢測NQO1蛋白在神經膠質瘤組織中的表達,探討NQO1表達水平在神經膠質瘤中的臨床病理學意義及其與患者預后的關系。
1 材料與方法
1.1 材料神經膠質瘤組織芯片購于上海芯超生物公司,包含122例神經膠質瘤組織,17例癌旁正常組織。所有患者臨床、病理及實驗室資料完整。病理類型和惡性程度按WHO(2018)膠質母細胞瘤的標準進行分類。
1.2 試劑NQO1鼠抗人單克隆抗體購自美國Santa Cruz公司(sc-32793);免疫組化EnVision法檢測試劑盒購自DAKO產品。
1.3 方法免疫組化采用EnVision法染色。組織芯片行常規脫蠟、梯度乙醇水化,于檸檬酸鹽抗原修復液中熱修復,經PBS緩沖液清洗,加入l ∶200稀釋的鼠抗NQO1抗體4 ℃冰箱孵育過夜,標記辣根過氧化物酶的抗鼠二抗室溫下孵育45 min,DAB顯色,蘇木精對比染色,中性樹膠封固。為了證明NQO1蛋白抗體免疫組化檢測的特異性,實驗中應用鼠IgG代替一抗作為對照,結果為陰性。同時,選擇NQO1蛋白陽性染色切片,以PBS代替一抗染色結果為陰性。利用GEPIA(http://gepia.cancer-pku.cn)在線分析TCGA數據庫神經膠質瘤樣本中NQO1 mRNA的表達,并繪制Kaplan-Meier生存曲線。
1.4 判斷標準NQO1蛋白表達以細胞質呈棕褐色顆粒為陽性。根據細胞染色強度進行計分:無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分。根據陽性細胞數的百分比計分:0~5%為0分,6%~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分。將兩項得分結果相乘:0分為(-),1~4分為(+),5~8分為(),9~12分為()。其中≤4分為低表達,>4分為高表達。以“-”為陰性,“+”為陽性,“~”為強陽性。
1.5 統計學分析應用SPSS 25.0軟件進行統計學分析,采用χ2檢驗或Fisher精確檢驗法,運用Kaplan-Meier生存分析。以P<0.01為差異有統計學意義。
2 結果
2.1 NQO1蛋白在神經膠質瘤組織中的表達免疫組化染色結果顯示NQO1蛋白在神經膠質瘤組織中主要定位于細胞質,少量表達于細胞核。在122例神經膠質瘤組織中,NQO1蛋白的陽性率和強陽性率分別為88.5%(108/122)和52.5%(64/122)。在17例癌旁正常組織中,NQO1蛋白的陽性率和強陽性率分別為29.4%(5/17)和5.9%(1/17)。NQO1蛋白在神經膠質瘤組織中的表達明顯高于癌旁正常組織,且差異有顯著性(P<0.01,表1,圖1)。
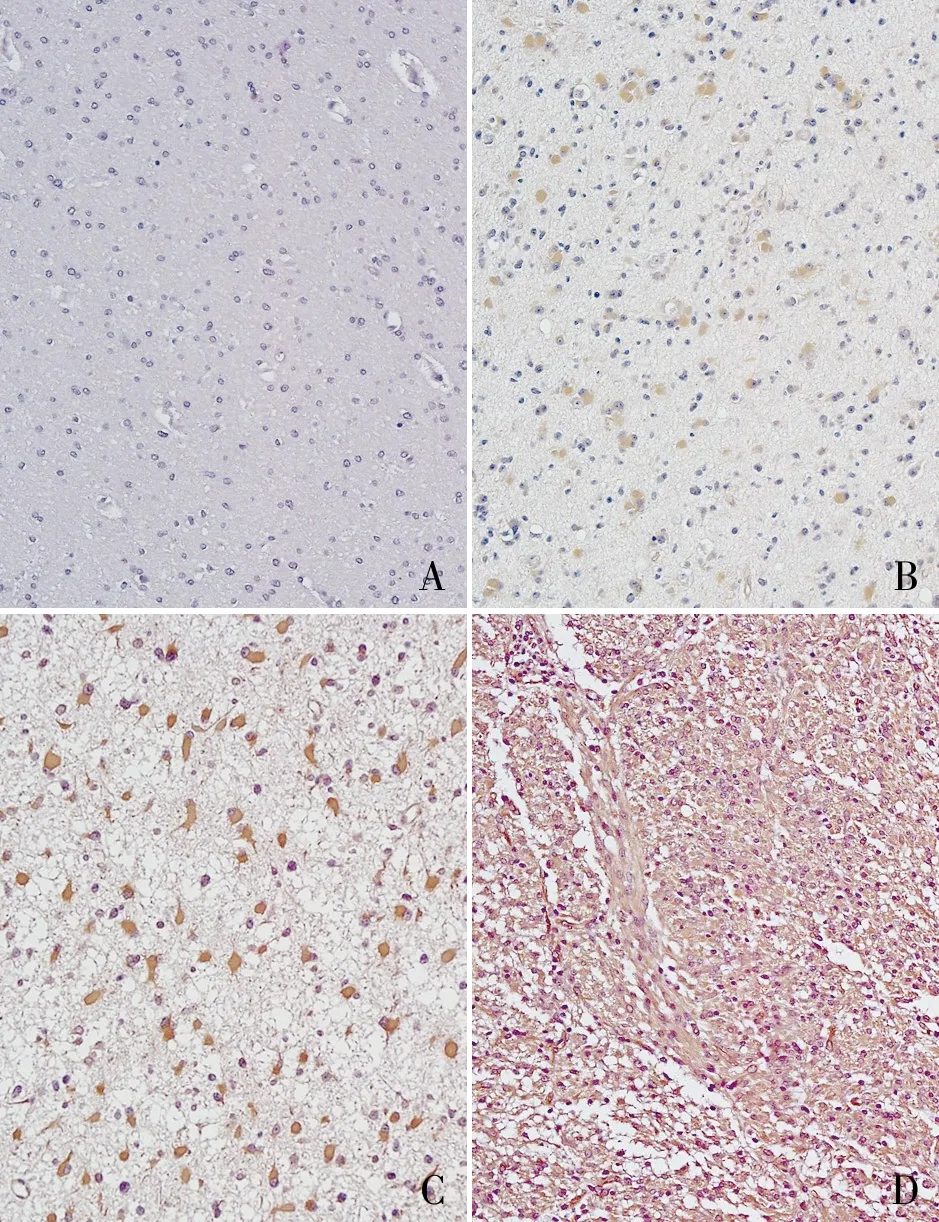
圖1A. NQO1蛋白在癌旁正常組織中呈陰性(-),EnVision法;B. NQO1蛋白在神經膠質瘤組織中呈弱陽性(+),EnVision法;C.NQO1蛋白在神經膠質瘤組織中呈強陽性,EnVision法();D. NQO1蛋白在神經膠質瘤組織中呈強陽性(),EnVision法
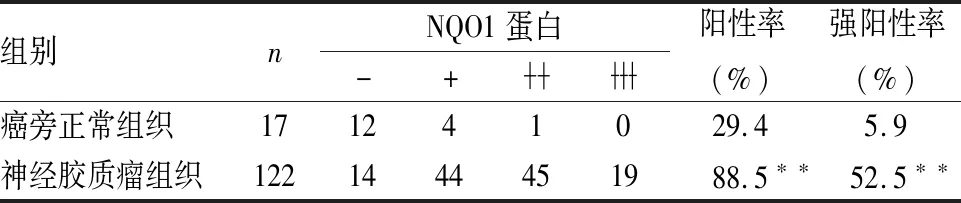
表1 癌旁正常組織和神經膠質瘤組織中NQO1蛋白的表達
與癌旁正常組織相比,**P<0.01
2.2 NQO1蛋白高表達與神經膠質瘤臨床病理特征的關系進一步分析NQO1蛋白高表達與神經膠質瘤患者臨床病理特征的關系,結果顯示:NQO1蛋白高表達與神經膠質瘤患者性別、年齡、腫瘤大小、發生部位及浸潤情況無關,與臨床分期密切相關(P<0.05)。其中,NQO1蛋白在晚期(Ⅲ+Ⅳ)神經膠質瘤組織中的強陽性率(46/75,61.3%)明顯高于早期(Ⅰ+Ⅱ)神經膠質瘤組織(18/47,38.3%)(P=0.013,表2);提示NQO1蛋白可能參與神經膠質瘤的發生、發展。

表2 神經膠質瘤臨床病理特征與NQO1高表達的關系[n(%)]
組間比較,*P<0.05
2.3 NQO1蛋白高表達與神經膠質瘤預后的關系TCGA數據庫分析顯示,在162例神經膠質瘤患者中,NQO1 mRNA高表達的神經膠質瘤患者的無瘤生存期明顯低于NQO1 mRNA低表達者(P<0.05,圖2),但總生存期差異無顯著性。
3 討論
近年研究發現 NQO1 基因609位點可發生 C-T的突變,導致原來野生純合CC基因型變成突變雜合CT或突變純合TT基因型,致使該酶活性減弱或完全喪失,降低NQO1解毒及維護細胞穩定的功能,因而增加某些易感個體細胞發生癌變的可能性,使其具有促癌作用[7]。本組發現與癌旁正常組織相比,NQO1蛋白在神經膠質瘤組織中的陽性率明顯升高,與NQO1在多種惡性腫瘤中高表達的報道一致[8-12]。NQO1蛋白高表達與神經膠質瘤患者的病理分級密切相關,但與患者性別、年齡、腫瘤大小、腫瘤部位及有無浸潤無相關性。以上結果均提示,NQO1蛋白高表達可能在神經膠質瘤的演進中發揮重要作用。Li等[13]認為NQO1是值得有效利用的腫瘤特異性標志物,其不受細胞周期及抑癌基因的影響和控制。因此,推測NQO1的持續異常激活可能在神經膠質瘤的發生、發展中起重要作用。
圖2 TCGA數據庫分析NQO1高表達的神經膠質瘤患者的預后:A.NQO1 mRNA表達水平與總生存期無關;B. NQO1 mRNA高表達的神經膠質瘤患者的無瘤生存期低于NQO1 mRNA低表達患者(P=0.044)
我們前期研究表明,NQO1蛋白在卵巢黏液性囊腺癌中呈高表達,是卵巢黏液性囊腺癌的獨立風險因子[14];NQO1蛋白對結直腸癌患者生存期有顯著影響,可作為結直腸癌患者預后評估的分子標志物[5]。此外,在乳腺癌中NQO1蛋白高表達與患者不良預后顯著相關[15],且NQO1/PKLR軸激活可通過調節葡萄糖代謝重編程,促進乳腺癌細胞淋巴轉移及腫瘤演進[8],抑制NQO1表達可調節乳腺癌細胞增殖及EMT過程[15]。本實驗通過TCGA數據庫生存分析發現,NQO1 mRNA高表達的神經膠質瘤患者的無瘤生存期顯著低于NQO1 mRNA低表達者,提示NQO1高表達可能是神經膠質瘤判斷預后的有效標志物。
綜上所述,NQO1在神經膠質瘤的演進過程中起重要作用,對于判斷神經膠質瘤的進展及預后具有重要的指示意義。NQO1蛋白有望成為神經膠質瘤早期診斷、治療和預后評估的生物學標志物。目前,NQO1在惡性腫瘤中高表達的具體機制尚不清楚,有待于進一步的分子生物學分析證實。

