2型糖尿病患者血清胱抑素C、25羥維生素D和同型半胱氨酸與下肢血管病變的相關性
喻昆林 虞青 袁昌麗
(昆明醫科大學第二附屬醫院 1內分泌科,云南 昆明 650101;2超聲室;3核醫學科)
下肢血管病變(LEAD)是2型糖尿病(T2DM)常見的慢性并發癥,早期癥狀隱匿,是糖尿病(DM)患者致死、致殘的主要原因,動脈粥樣硬化(AS)是DMLEAD的主要病理基礎〔1〕。我國50歲以上的T2DM患者LEAD的患病率達6.9%~23.8%〔2〕。研究證實胱抑素(Cys)C與心血管疾病及AS的嚴重程度相關〔3〕,維生素(V)D缺乏與T2DM、DM外周血管病變密切相關〔4,5〕,同型半胱氨酸(Hcy)是DM下肢AS的獨立危險因子〔6〕。目前LEAD的發病機制尚未完全闡明。本研究旨在分析T2DM患者血清CysC、25羥(25-OH)VD和Hcy的水平與LEAD的相關性,探討LEAD的危險因素。
1 資料與方法
1.1研究對象 選取2018年1~12月在昆明醫科大學第二附屬醫院內分泌科住院的T2DM患者262例,根據下肢血管超聲檢查分為T2DM無LEAD (T2DM組)66例,男37例,女29例,平均年齡(62.47±7.42)歲;LEAD內膜增厚 (增厚組)62例,男30例,女32例,平均年齡(62.84±6.88)歲;LEAD斑塊形成(斑塊組)70例,男32例,女38例,平均年齡(62.07±6.63)歲;LEAD血管狹窄(狹窄組)64例,男35例,女29例,平均年齡(64.32±7.42)歲。納入標準:DM符合WHO 1999 年診斷標準及《中國2型糖尿病防治指南》(2013年版)診斷標準〔2〕。排出標準:1型DM、DM急性并發癥、嚴重肝腎損害、各種急慢性感染、惡性腫瘤、自身免疫性疾病、正在進行糖皮質激素治療、正在服用鈣劑、葉酸、維生素B12治療。各組性別、年齡差異無統計學意義(P>0.05)。
1.2方法 研究對象過夜禁食10 h抽取肘正中靜脈血,靜置1 h離心后取血清,美國BECKMAN COULTER全自動生化分析儀測定CysC、Hcy、空腹血糖(FPG)、餐后2 h血糖(2 h PG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低高密度脂蛋白膽固醇(LDL-C)、尿酸(UA)、尿微量白蛋白/肌酐(U-mAlb/Cr)。鄭州安圖生物工程股份有限公司AutoLumo A2000化學發光檢測儀測定空腹胰島素(FINS)。意大利DiaSorin.LIAISON-XL化學發光檢測儀測定25-OHVD。穩態模型評價胰島素抵抗指數(HOMA-IR),HOMA-IR=FPG×FINS/22.5。記錄所有受試者的臨床體征,包括年齡、性別、病程、身高、體重、收縮壓(SBP)、舒張壓(DBP)、體重指數(BMI)=體重(kg)/身高(m)2。
1.3下肢血管病變檢查 固定專人操作,美國LOGIQ E8彩色超聲診斷儀檢查下肢血管,觀察管腔內膜中層厚度(IMT)有無增厚、斑塊、狹窄形成,檢測部位為雙側股總動脈、股淺動脈、脛(前)后動脈、足背動脈。以IMT<1.0 mm、局部沒有斑塊并且無狹窄為單純DM;以IMT≥1.0 mm、局部有斑塊、管腔狹窄或血流充盈缺損中任何一項為DM合并LEAD〔7〕。
1.4統計學處理 采用SPSS19.0軟件進行方差分析、LSD法、χ2檢驗、Spearman相關分析、二元Logistic回歸分析;受試者工作特征(ROC)曲線下面積(AUC)及診斷截斷值評估血清CysC、25-OHVD和Hcy水平在LEAD 中的診斷價值。
2 結 果
2.1不同分組一般臨床資料及實驗室指標比較 LEAD組病程、FPG、2 h PG、HbA1c、TC、TG、FINS、HOMA-IR、U-mAlb/Cr、UA顯著高于T2DM組(P<0.05)。LEAD狹窄組與斑塊組、增厚組比較,FPG、HbA1c、HOMA-IR、TG、U-mAlb/Cr明顯增加(P<0.05)。斑塊組與增厚組比較HbA1c、FINS明顯增加(P<0.05)。LEAD組血清CysC、Hcy水平明顯高于T2DM組,隨著LEAD嚴重程度增加而逐漸升高。LEAD組血清25-OHVD水平明顯低于T2DM組,隨著LEAD嚴重程度增加而逐漸降低(P<0.05)。見表1。
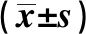
表1 各組一般資料及實驗室指標比較
與T2DM組比較:1)P<0.05 ;與增厚組比較:2)P<0.05 ;與斑塊組比較:3)P<0.05
2.2T2DM LEAD影響因素的Logistic回歸分析 以T2DM是否合并LEAD為因變量,以病程、FPG、2 h PG、HbA1c、FINS、HOMA-IR、U-mAlb/Cr、UA、TC、TG、CysC、25-OHVD、Hcy為自變量進行Logistic回歸分析,結果顯示CysC、Hcy、UA是LEAD的危險因素,25-OHVD是保護性因素。見表2。

表2 LEAD影響因素的Logistic回歸分析
2.3血清CysC、25-OHVD、Hcy與其他指標的Spearman相關分析 血清CysC 與HbA1c、U-mAlb/Cr、UA、Hcy呈顯著正相關(r=0.024、0.002、0.000、0.013,P=0.031、0.002、0.013、0.008)。血清25-OHVD與年齡、TG、Hcy呈顯著負相關(r=-0.252、-0.505、-0.226,P=0.000、0.048、0.019)。Hcy與HbA1c、CysC呈顯著正相關(r=0.309、2.290,P=0.042、0.008),與25-OHVD呈顯著負相關(r=-0.099,P=0.019)。
2.4ROC曲線評價血清CysC、25-OHVD、Hcy水平對LEAD 的診斷價值 血清CysC的AUC為0.885(95%CI:0.846~0.924,P=0.000),診斷截斷值取1.065 mmol/L時,敏感性與特異性分別為89.1%與74.7%。血清25-OHVD的AUC為0.874(95%CI:0.832~0.916,P=0.000),診斷截斷值取20.05 ng/ml時,敏感性與特異性分別為80.3% 與77.0%。血清Hcy的AUC為0.708(95%CI:0.634~0.781,P=0.000),診斷截斷值取15.65 μmol/L時,敏感性與特異性分別為53.1% 與80.3%。見圖1。

圖1 血清CysC、25-OHVD、Hcy水平對LEAD診斷的ROC 曲線
3 討 論
LEAD臨床表現為靜息痛、間歇跛行、血管閉塞,甚至DM足壞疽及截肢,患病率是非DM的20倍,早期臨床癥狀不典型,嚴重影響患者生活質量。LEAD受多種致病因素或伴發疾病共同作用,AS是LEAD的病理生理基礎,內皮細胞功能受損是AS的始動因素,炎癥反應是AS的發病機制,氧化應激是內皮炎癥的主要機制。目前多普勒超聲在臨床上作為下肢動脈閉塞癥篩查首選方法〔8〕,可直接觀察患者的血管壁、血流情況,為臨床早期LEAD的發現、診斷及治療提供了有效的手段。
CysC是非糖基化的堿性蛋白質,又稱半胱氨酸蛋白酶抑制蛋白C,通過調節半胱氨酸酶活性,參與細胞外基質的產生和降解,影響中性粒細胞吞噬與趨化功能而參與炎癥過程,引起血管內皮損傷導致AS〔9〕。CysC不僅是早期腎損害的標志物,與糖尿病腎病密切相關〔10〕。研究表明CysC水平與T2DM LEAD及嚴重程度相關〔11,12〕。馬明坤等〔13〕研究顯示高水平CysC是DM足病程進展的獨立危險因素。VD是一種脂溶性維生素,胰島細胞及動脈血管內皮中存在VD受體,除調節鈣磷代謝,VD參與調節糖脂代謝、調節免疫、抑制炎癥因子、抗氧化應激、抑制腎素-血管緊張素-醛固酮系統(RAAS)、抗動脈硬化等病理生理過程〔14〕。血清25-OHVD水平反映體內VD的營養狀況。DM患者中普遍存在VD水平的缺乏〔15〕。VD的缺乏與肥胖、DM、高脂血癥、高血壓及代謝綜合征等致AS的危險因素關系密切〔16〕。25-OHVD是頸動脈斑塊增加的獨立危險因素,其大小與25-OHVD水平負相關〔 17〕。劉金霞等〔18〕研究證實DM LEAD與25-OHVD濃度具有獨立相關性,低25-OHVD水平是LEAD 危險增加的獨立危險因素。Hcy 是一種含巰基的氨基酸,是蛋氨酸代謝的中間產物,也是一種反應性血管損傷性氨基酸,可通過氧化應激反應、一氧化氮途徑對血管的內皮細胞直接或間接造成損傷,加重AS及血管病變〔19〕。Banecka-Majkutewicz等〔20〕研究顯示Hcy每升高5 μmol/L,缺血性腦血管疾病發生率升高60%~80%。金京等〔21〕研究表明高Hcy 血癥是AS的獨立危險因素,且與DM LEAD嚴重程度密切相關。
本研究提示CysC、Hcy水平與LEAD及嚴重程度正相關,25-OHVD水平與LEAD及嚴重程度負相關。U-mAlb/Cr的升高是全身內皮功能障礙在腎臟的早期表現,CysC與U-mAlb/Cr的良好相關性提示CysC在糖尿病腎病、LEAD中的作用。CysC升高的同時往往伴隨超敏C反應蛋白的升高,通過抑制Hcy酶升高Hcy水平,協同高UA等炎性物質加重糖代謝紊亂、氧化應激過程導致LEAD。年齡是VD缺乏的高危因素,也是動脈彈性下降的主要原因。研究發現〔22〕25-OHVD通過抑制過氧化物酶體增殖物激活受體(PPAR)-γ,影響肝臟脂肪代謝,降低TG水平,同時作用于PPAR-α,調節脂肪酸代謝,改善胰島素抵抗。研究顯示〔23〕高水平Hcy可以通過誘導脂肪細胞中的內質網應激增加胰島素抵抗。CysC是Hcy的決定因素,兩者與HbA1c的正相關性反映了兩者在DM糖代謝及胰島素抵抗中的作用。
高林英等〔24〕研究顯示DM病程每增加1 年,并發LEAD的危險增加13%。UKPDS〔25〕研究顯示HbAlc每增加1%,下肢血管病變的危險性增加28%。既往研究已證實慢性高血糖、高胰島素血癥、胰島素抵抗、脂代謝紊亂是DM及并發癥的危險因素。尿微量蛋白隨LEAD嚴重程度的增加提示糖尿病腎病與下肢血管AS的進展密切相關。

