TLR10基因多態性與慢性乙型肝炎病毒感染的相關性研究
湯永志 王晨 陳華忠 朱敏 王奎鋒 朱堅勝
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是我國慢性肝臟疾病患者發生肝硬化、肝癌的主要病因之一[1]。目前認為HBV誘導機體免疫應答是肝臟損傷和炎癥的主要機制。Toll樣受體2(toll like receptor 2,TLR2)與慢性HBV感染的關系密切,TLR2介導的信號通路能抑制HBV復制,也可成為HBV發生免疫逃避的作用靶點[2]。TLR10是一類無特異性配體的寡受體。相關研究表明,TLR10作為抑制性受體與TLR2形成異源二聚體,對TLR2下游白細胞介素1(IL-1)分泌進行調節[3]。TLR10基因多態性是否參與慢性HBV感染過程中的免疫應答,目前尚無相關文獻報道。本研究對TLR10啟動子區RS10004195(-113T/A)以及外顯子區RS11096957、RS4129009與HBV感染的關系作一探討,現將結果報道如下。
1 對象和方法
1.1 對象 選取本院2012年9月至2015年12月收治的428例HBV感染患者為感染組,根據2010年《慢性乙型肝炎防治指南》的診斷標準進行常規乙型肝炎標志物檢測,并除外其他類型病毒感染、自身免疫性疾病、藥物、飲酒等引起的肝功能異常。選取同期在本院進行體檢的210例健康者為對照組。感染組男280例,女148例;年齡(41.8±11.8)歲;肝臟炎癥程度(依據 2000年中華醫學會傳染病與寄生蟲病學會和肝病學會修訂的《病毒性肝炎防治方案》):輕度172例,中度138例,重度24例,肝硬化94例;HBV DNA<103IU/ml 60例,103~106IU/ml 134 例,>106IU/ml 234 例;HBeAg(+)278例,HBeAg(-)150 例;有家族史 224 例,無家族史204例。對照組男134例,女76例;年齡(42.0±10.1)歲。兩組對象均為漢族人群,性別、年齡比較差異均無統計學意義(均P>0.05)。本研究經醫院醫學倫理委員會審查通過,所有對象知情同意。
1.2 主要試劑和設備 全血基因組DNA提取試劑盒(1408G26,上海捷瑞生物工程有限公司),聚合酶鏈反應(PCR)引物:RS10004195(F:141008Q43/R:141008Q44);RS11096957(F:141008Q45/R:141008Q46)上海捷瑞生物工程有限公司)。核酸定量分析儀(1702525,美國Biorad公司),小型高速離心機(5418,德國 Eppendorf公司),DNA測序儀(3730XL,美國 ABI公司)。
1.3 PCR及測序 采集患者晨間空腹外周血2~3ml,乙二胺四乙酸二鈉(EDTA-Na)抗凝后-80℃保存,以備DNA提取。(1)DNA抽提:按照全血基因組DNA抽提試劑盒說明書的步驟進行,核酸定量分析儀檢測DNA濃度及A260/A280比值,比值為1.7~2.0的樣本作為PCR擴增模板。(2)PCR 擴增:RS10004195 上游引物 5′-CCTGGGTGACAAAGTGAGACCCTACCT-3′;下游引物5′-CTTAAACCCCATCCGCCCTCTT-3′;RS11096957 上游引物 5′-CTTAAACCCCATCCGCCCTCTT-3′;下游引物 5′-GTAGCCTGCCCATCTTAAACAC-3′。擴增體系:10×緩沖液2.5μl,DNA模板0.5μl,MgCl21.0μl(25mmol/L),dNTP 0.5μl,TaqDNA 聚合酶 0.25μl,引物各 0.5μl,總體積為25μl,剩余體積用雙蒸水補足。PCR條件:RS10004195位點(95℃預變性 2min,94℃變性 45s,58℃退火90s,72℃延伸2min,共循環 35次);RS11096957位點(95℃預變性 2min,94℃變性 45s,56℃退火 90s,72℃延伸2min,共循環35次),擴增產物加入溴化乙錠染色的1.5%瓊脂糖凝膠中電泳,凝膠成像分析PCR產物特異性。(3)直接測序:將PCR擴增產物送上海桑尼生物科技有限公司,利用直接測序法進行基因序列分析。
1.4 統計學處理 應用SPSS 17.0統計軟件。對兩組人群RS10004195、RS11096957位點進行Hardy-Weinberg平衡檢驗,以驗證其群體代表性。計量資料用表示,組間比較采用兩獨立樣本t檢驗。兩組對象基因型及基因頻率[等位基因頻率=(2×純合子數+雜合子數)(/2×受檢人群)]用率表示,組間比較采用χ2檢驗,同時計算OR值及其95%CI。各位點基因型兩組間的關系比較采用logistic回歸分析,倍增P值經Bonferroni校正(n=3)。P<0.05為差異有統計學意義。
2 結果
2.1 兩組對象RS10004195與RS11096957基因型及等位基因分布特征比較 兩組對象RS10004195、RS11096957位點均符合 Hardy-Weinberg平衡(χ2=2.11、0.34和0.03、0.93,均P>0.05),提示本研究人群具備群體代表性。在RS10004195位點,感染組基因型(AA+AT)變異頻率為76.64%,明顯高于對照組的63.81%,差異有統計學意義(P<0.05);等位基因A頻率為53.50%,高于對照組的39.05%,差異有統計學意義(P<0.05)。在RS11096957位點,感染組基因型(CA+AA)的變異頻率為75.70%,與對照組的69.52%比較差異無統計學意義(P>0.05);感染組等位基因A頻率為50.93%,高于對照組的43.33%,差異有統計學意義(P<0.05),見表1~2。
2.2 HBV感染患者臨床特征與RS10004195基因變異的關系 在HBV感染患者中,HBeAg陽性患者RS10004195位點基因型(AA+AT)變異頻率較HBeAg陰性患者增高,差異有統計學意義(P<0.05);而在肝臟炎癥程度、HBV DNA水平、家族史等方面,差異均無統計學意義(均P>0.05),見表3。
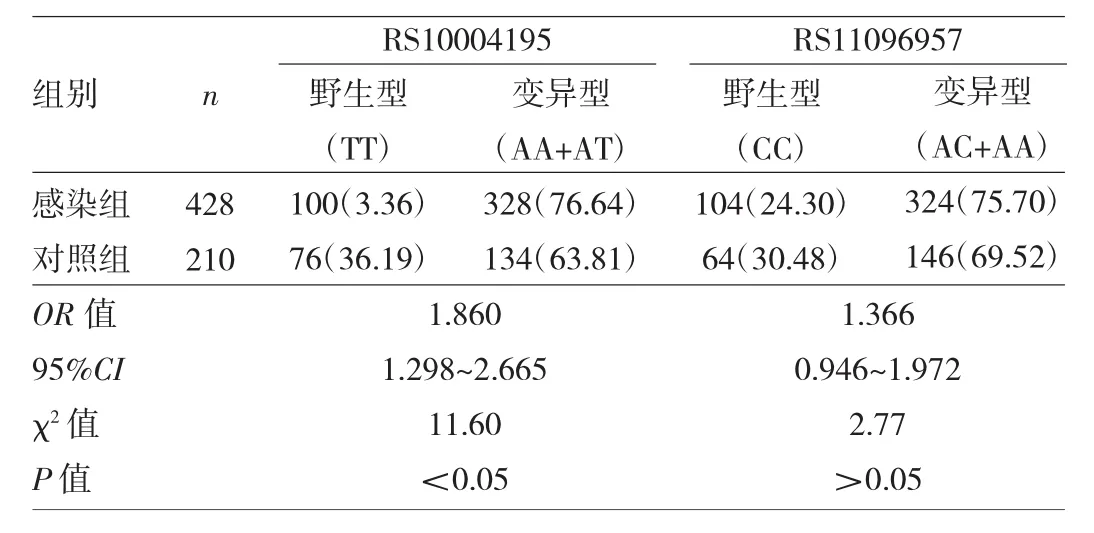
表1 兩組對象RS10004195與RS11096957基因型分布特征比較[例(%)]
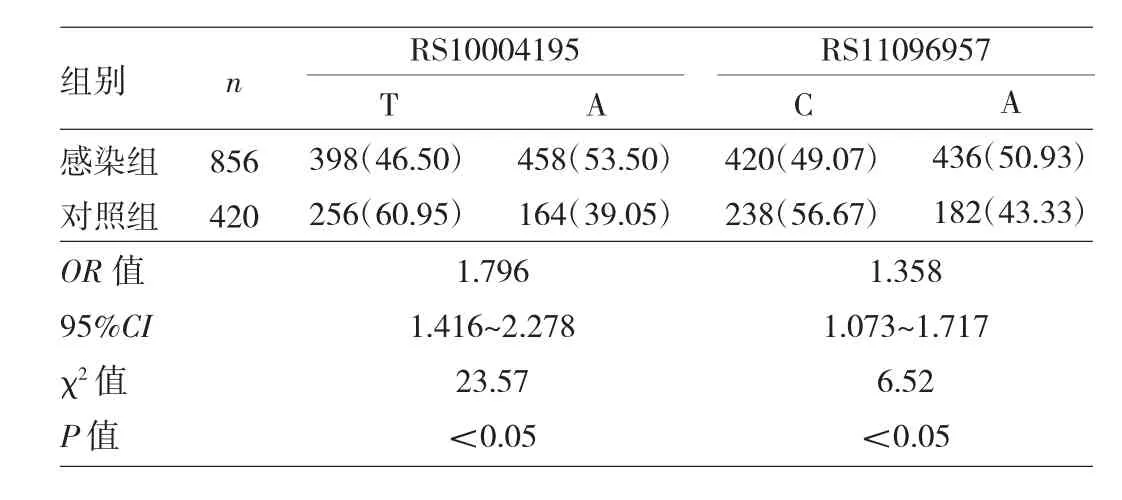
表2 兩組對象RS10004195與RS11096957等位基因分布特征比較[例(%)]
2.3 兩組對象TLR10基因多態性的logistic回歸分析 校正年齡、性別等混雜因素后進行logistic回歸分析,結果顯示RS10004195在共顯性模型、顯性模型和隱性模型中的OR值及95%CI分別為2.862(1.572~5.211)、1.712(1.142~2.566)、2.487(1.541~4.014),差異均有統計學意義(均P<0.05);提示T向A突變時,HBV感染風險增高。RS11096957在共顯性模型、顯性模型和隱性模型中的OR值及 95%CI分別為1.028(0.651~1.623)、0.905(0.595~1.378)、1.254(0.787~2.000),差異均無統計學意義(均P>0.05);提示其與HBV感染無關。RS4129009在共顯性模型、顯性模型和隱性模型中的OR值分別為0.639(0.424~0.963)、0.540(0.375~0.780)、1.016(0.559~1.847),其中顯性模型差異有統計學意義(P<0.05),共顯性模型、隱性模型差異均無統計學意義(均P>0.05);提示存在A向G突變,HBV感染的風險降低。
3 討論
TLR10基因單核苷酸多態性與人類多種疾病(如前列腺炎[4]、幽門螺桿菌相關性胃炎[5-6]、肥胖[7]和2型糖尿病[8]、結腸癌[9]、結核[10]、骨關節炎[11]、膀胱癌[12]、剛果出血熱[13]、支氣管哮喘[14]、鼻咽癌[15]、呼吸道合胞病毒感染[16]、IgA腎病[17]等)存在關聯。盡管尚未發現特異性配體,且TLR10參與人體疾病的確切機制也尚未明確,但近年來有關TLR10參與機體免疫應答調節的研究結果提示其在人體免疫調節中起重要作用。TLR10在人體B細胞和漿樣樹突狀細胞中表達,通過MyD88信號通路介導下游炎性因子分泌[18],人調節T細胞可表達TLR10,且受FOXP3、NF-AT復合體的調控[19]。在人單核細胞系THP-1中,TLR10也有表達,缺氧或活性氧均能增強TLR10表達[20]。現有研究認為TLR10是一種功能性受體,人TLR10轉基因小鼠經TLR2配體pam3CSK4(Pam3Cys)刺激后,血清中IL-6、IL-8水平較野生基因型小鼠明顯降低,TLR10交聯后的外周血單個核細胞IL-1受體拮抗劑(IL-1Ra)mRNA和蛋白高水平表達;在HEK293細胞實驗中,阻斷TLR10后,配體刺激下的TLR2細胞通路下游炎性因子分泌增多,提示TLR10是TLR家族中唯一通過產生IL-1Ra參與TLR2信號通路應答的抑制性受體,并發揮抗炎的特性[3]。在TLR10干預下,U397細胞中 TLR2/1配體(PAM3CSK4)、TLR2/6配體(MALP-2)、TLR3配體(pI:C)和 TLR4配體(LPS)介導的下游炎性因子IL-6、干擾素β表達均明顯下降,提示TLR10廣泛抑制了上述TLR介導的免疫應答,進一步研究顯示 TLR10通過抑制信號通路中 IκB、MAPK、MyD88和TRIF蛋白的表達,影響下游炎性因子分泌[21]。綜上所述,TLR10作為一種功能性受體在多種免疫細胞中表達,通過與其他TLR協同,在機體免疫應答中發揮負性調節作用。
HBsAg通過阻斷JNK-MAPK通路選擇性抑制巨噬細胞TLR2下游IL-12分泌而逃避免疫攻擊[22]。在HBV感染過程中,HBeAg陽性患者的肝細胞、庫否細胞和單個核細胞TLR2表達低于HBeAg陰性患者,慢加急性肝衰竭患者T細胞TLR2表達明顯增加,通過促進Th17細胞分化和外周血單個核細胞應答參與疾病進展[23-24]。在體外小鼠模型中,預激活的TLR2增強T細胞的應答,加速了HBV清除,間接印證了TLR2在HBV感染中發揮病毒抑制或清除的作用[25]。以上結果提示TLR2與HBV感染關系密切,在HBV感染的免疫應答中發揮重要作用。

表3 HBV感染患者臨床特征與RS10004195基因變異的關系[例(%)]
TLR10作為一種抑制性功能受體,參與TLR2信號通路介導的免疫調節。筆者前期報道了RS4129009位點HBV DNA>106IU/ml或HBeAg陽性的患者中基因型變異頻率較高(P<0.05)[26]。本文初步探討了慢性HBV感染與TLR10基因多態性的關系,結果提示啟動子區RS10004195出現變異基因A時與HBV易感性強相關,校正性別、年齡等混雜因素后logistic回歸分析顯示,純合突變個體HBV易感風險增高,且在HBeAg陽性患者突變的比例較高,提示慢性HBV感染與TLR10單核苷酸多態性位點有一定關聯。TLR10參與了TLR2信號通路應答,并發揮抑制性效應,在固有免疫應答中發揮重要作用。綜上,TLR10基因多態性與HBV感染存在關聯,但TLR10是否作為抑制性受體參與HBV感染過程中機體免疫細胞介導的免疫應答、幫助HBV逃避TLR2通路介導的免疫應答尚需進一步研究證實。

