骨骼肌心磷脂酰基轉移酶1的運動強度變化特征及其對氧化應激和線粒體自噬的影響
徐祖杰,田振軍
氧化應激是機體各器官組織病變發生發展的主要原因。有研究報道,衰老、糖尿病、癌癥及心力衰竭等機體骨骼肌中氧化應激水平顯著升高,線粒體功能發生障礙(Russell et al.,2014)。線粒體是活性氧族(reactive oxygen species,ROS)產生的主要場所,當線粒體異常自噬無法清除受損的線粒體時,氧化應激水平進一步增強,二者相互作用加速骨骼肌損傷。文獻資料表明,運動可通過PINK1/Parkin介導清除受損的線粒體,抑制病理條件下的骨骼肌氧化應激水平,改善線粒體功能,提高骨骼肌質量和力量(Joseph et al.,2016)。心磷脂酰基轉移酶1(acyl-CoA:lysocardiolipin acyltransferase-1,ALCAT1)是定位于線粒體-內質網結構偶聯的心磷脂重塑酶(Li et al.,2010),分布在心臟、肝臟和骨骼肌等組織的細胞生物膜上(Cao et al.,2004)。在肥胖、心肌肥厚、非酒精性脂肪肝和帕金森等病理模型中,心磷脂發生病態重塑,ALCAT1表達顯著增加,同時氧化應激水平增強,線粒體呼吸功能下降(Li et al.,2010;Liu et al.,2012;Song et al.,2019;Wang et al.,2015)。ALCAT1的下游靶標線粒體融合蛋白2(Mitofusin 2,MFN2)被PINK1磷酸化后作為Parkin的受體,參與受損線粒體的清除(Li et al.,2012;Chen et al.,2013)。ALCAT1高表達后引起線粒體腫脹、斷裂和呼吸功能紊亂,加速ROS產生,PINK1/Parkin介導的線粒體自噬異常導致受損線粒體無法清除,誘導氧化應激水平進一步升高;靶向敲除ALCAT1后,氧化應激水平降低,線粒體呼吸功能增強,上述病理情況明顯改善(Li et al.,2010;Liu et al.,2012;Song et al.,2019;Wang et al.,2015)。因此,ALCAT1在氧化應激及PINK1/Parkin介導的線粒體異常自噬中發揮關鍵作用。
研究發現,去神經誘導大鼠骨骼肌萎縮時ALCAT1 mRNA表達增加了290%,電刺激誘導大鼠骨骼肌肥大時ALCAT1 mRNA表達下降了32%(Ostojic et al.,2013),敲除小鼠骨骼肌ALCAT1后線粒體體積增大,肌纖維直徑增加(Li et al.,2010),因此,ALCAT1在骨骼肌萎縮和肥大中發揮重要作用。推測,運動訓練可能是抑制ALCAT1表達和心磷脂病態重塑的有效手段(劉紐等,2017)。但目前鮮見骨骼肌ALCAT1表達變化的強度運動特征及其與氧化應激和PINK1/Parkin介導的線粒體自噬關系的相關研究。綜上,本研究擬采用4周小鼠跑臺運動訓練,探討骨骼肌ALCAT1在不同強度運動中的變化特征及其對氧化應激和PINK1/Parkin介導的線粒體自噬的影響,為運動抑制ALCAT1重塑的強度篩選和耐力訓練誘導線粒體自噬的發生機制提供實驗依據。
1 研究對象與方法
1.1 研究對象及分組
8周齡健康雄性C57BL/6J野生型小鼠32只,購于西安交通大學動物實驗管理中心,動物質量合格證號:SCⅩK(陜)2017-003。所有小鼠常規分籠飼養,自由飲食進水。適應性喂養1周后,隨機分為安靜對照組(C組)、60%V.O2max運動強度組(SE組)、76%V.O2max運動強度組(ME組)和85%V.O2max運動強度組(HE組),每組8只。
1.2 運動方案及取材
所有運動組小鼠進行3天適應性跑臺訓練,速度為5 m/min,30 min/天,坡度為0°。正式運動方案的運動速度參照相關研究文獻制定,SE組以8 m/min(Zhang et al.,2016)、ME 組以 12 m/min(Sonobe et al.,2015)、HE 組以18 m/min(Zhang et al.,2016)進行跑臺運動,坡度均為 0°,60 min/天,5天/周×4周,C組不運動。
4周訓練結束24 h后取材,頸椎脫臼處死小鼠,切取左側腓腸肌入液氮固定,用于RT-qPCR和試劑盒檢測;右側腓腸肌一部分用于線粒體呼吸功能測定,另一部分入液氮固定,用于Western blotting實驗。
1.3 生化指標測定
腓腸肌丙二醛(MDA)含量采用硫代巴比妥酸法測定,總抗氧化能力(T-AOC)含量采用比色法測定,總超氧化物歧化酶(T-SOD)活性采用黃嘌呤氧化酶法測定,所有操作均嚴格按照試劑盒說明書進行實驗。
1.4 線粒體呼吸功能測定
采用Oxygraph-2k線粒體呼吸儀測定骨骼肌線粒體呼吸功能。清洗、校準工作艙,稱取2 mg腓腸肌組織,冰上研磨,制備勻漿液,轉移至工作艙。待呼吸速率平衡后,加入 5 μl丙酮酸、5 μl蘋果酸和 10 μl谷氨酸啟動態 4 呼吸。待呼吸速率再次平衡后,加入20 μl ADP啟動態3呼吸。儀器記錄耗氧曲線,導出數據,分析態3呼吸速率(respiration rate state 3,ST3)和態4呼吸速率(respiration rate state 4,ST4),ST3/ST4比值即為呼吸控制率比(respiratory control rates,RCR)。
1.5 Western blotting檢測
取腓腸肌組織加入預冷RIPA蛋白裂解液,剪碎勻漿,離心取上清,BCA法蛋白定量。等量蛋白上樣、電泳、轉膜 ,5%BSA 封閉 ,孵育一抗 ALCAT1(1:1 000,Abcam#ab175516)、MFN2(1:3 000,Abcam#ab124773)、PINK1(1:1 000,Bioworld#BS8731)、Parkin(1:5 000,Abcam#ab179812)、LC3(1:1 000,Abcam#ab128025)、P62(1:600,Proteintech#18420-1-AP)、SOD1(1:1 000,GeneT-ex#GTⅩ100659)、SOD2(1:1 000,GeneTex#GTⅩ116093),4℃過夜,復溫后TBST清洗5 min/次×5次,加二抗室溫孵育2 h,TBST清洗5 min/次×5次,ECL發光顯跡。內參為GAPDH(1:5 000,天德悅#TDY042),計算目的蛋白與內參灰度值比值即為蛋白相對表達含量。
1.6 RT-qPCR檢測
采用Trizol法提取腓腸肌總RNA,嚴格按照TaKaRa-RNA定量和反轉錄試劑盒說明書進行操作,內參為GAPDH。引物序列為alcat1:F5’TGGACCGCCTAAGAGAAGGGAA 3’,R5’CGGTAACATGCAAGTTC A ATGA 3’;gapdh:F5’AATGGTGAAGGTCGGTGTG 3’,R5’GTGGAGTCATACTGGAACATGTAG 3’,退火溫度為60℃。
1.7 圖像采集與數據處理
利用Image Lab 5.2軟件采集Western blotting結果,GraphPad Prism 6.0 Demo軟件作圖,所有數據使用SPSS 19.0軟件處理,結果以平均數±標準差(M±SD)表示,采用單因素方差分析,顯著性水平選擇P<0.05和P<0.01。
2 研究結果
2.1 不同強度運動對小鼠骨骼肌ALCAT1表達的影響
RT-qPCR和Western blotting結果顯示,與C組比較,SE、ME和HE組小鼠骨骼肌ALCAT1的mRNA和蛋白表達均顯著降低(P<0.01);與ME組比較,HE組小鼠骨骼肌ALCAT1的mRNA和蛋白表達均顯著升高(P<0.05,P<0.01,圖1)。
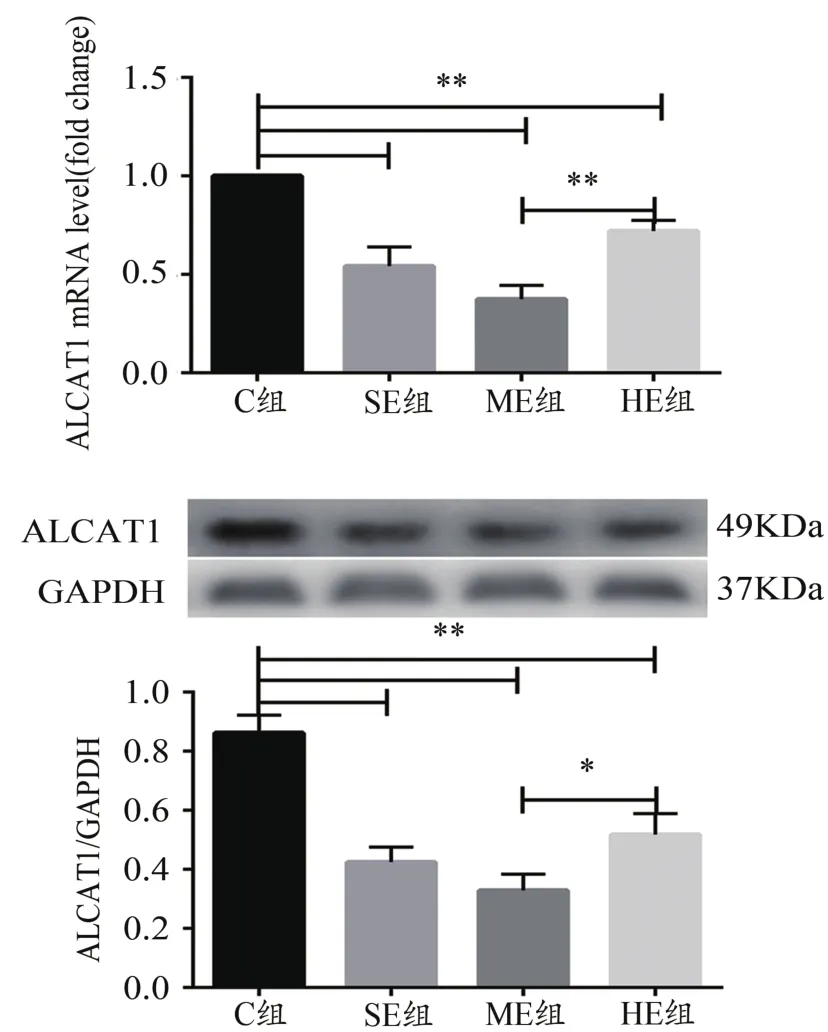
圖1 骨骼肌ALCAT1基因和蛋白表達結果Figure 1. Expression ofALCAT1 Gene and Protein in Skeletal Muscle
2.2 不同強度運動對小鼠骨骼肌氧化應激水平的影響
試劑盒測定結果顯示,骨骼肌MDA含量:與C組比較,SE、ME和HE組均顯著升高(P<0.01),與HE組比較,SE、ME組均顯著降低(P<0.01)。T-AOC含量:與C組比較,SE、ME組均顯著升高(P<0.01),HE組無顯著變化;與ME組比較,HE組顯著降低(P<0.01)。T-SOD活性:與C組比較,SE、ME組均顯著升高(P<0.01),HE組無顯著變化;與ME組比較,HE組顯著降低(P<0.01,圖2)。
Western blotting結果顯示,骨骼肌SOD1蛋白表達:與C組比較,SE、ME組均顯著升高(P<0.01),HE組無顯著變化;與ME組比較,SE、HE組均顯著降低(P<0.05,P<0.01)。SOD2蛋白表達:與C組比較,SE、ME組均顯著升高(P<0.01),HE組無顯著變化;與ME組比較,HE組顯著降低(P<0.01,圖3)。
2.3 不同強度運動對小鼠骨骼肌線粒體自噬相關信號通路的影響
Western blotting結果顯示,骨骼肌MFN2蛋白表達:與C組比較,SE、ME和HE組均顯著升高(P<0.01);與HE組比較,SE、ME組均顯著降低(P<0.01)。PINK1和Parkin蛋白表達:與C組比較,SE、ME組均顯著升高(P<0.01),HE組無顯著變化;與ME組比較,SE、HE組均顯著降低(P<0.05,P<0.01,圖 4)。提示,60%V.O2max和76%V.O2max運動強度能顯著提高骨骼肌PINK1/Parkin介導的線粒體自噬水平,且76%V.O2max運動強度促進效應顯著優于60%V.O2max運動強度。

圖2 骨骼肌MDA含量、T-AOC含量和T-SOD活性測定結果Figure 2. Determination of MDAContent,T-AOC Content and T-SODActivity in Skeletal Muscle
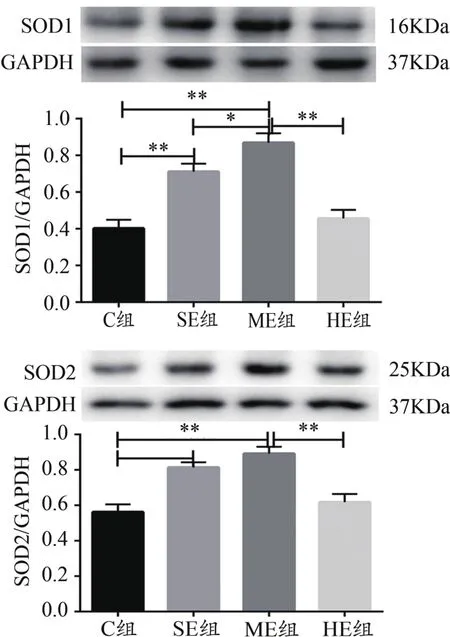
圖3 骨骼肌SOD1和SOD2蛋白表達結果Figure 3. Expression of SOD1 and SOD2 Protein in Skeletal Muscle
Western blotting結果顯示,與C組比較,SE、ME和HE組骨骼肌LC3-Ⅱ/I比值均顯著升高(P<0.01)。與C組比較,SE、ME和HE組P62蛋白表達均顯著降低(P<0.01),與HE組比較,SE、ME組P62蛋白表達均顯著升高(P<0.01,圖5)。提示,不同強度運動均可上調小鼠骨骼肌自噬流。
2.4 不同強度運動對小鼠骨骼肌線粒體呼吸功能的影響
線粒體呼吸儀測定結果顯示,骨骼肌ST3和RCR:與C組比較,SE、ME和HE組均顯著升高(P<0.01);與ME組比較,SE、HE組均顯著降低(P<0.05,P<0.01)。各組之間ST4沒有顯著差異(圖6)。提示,不同強度運動均可顯著提高小鼠骨骼肌線粒體呼吸功能,其中,76%V.O2max運動強度更為顯著。
2.5 骨骼肌ALCAT1蛋白表達與氧化應激和線粒體自噬相關分析
相關性分析顯示,骨骼肌ALCAT1蛋白表達與MDA含量呈顯著負相關(Pearson=-0.804,P<0.01);與SOD1蛋白表達呈顯著負相關(Pearson=-0.878,P<0.01),與SOD2蛋白表達呈顯著負相關(Pearson=-0.892,P<0.01),與PINK1蛋白表達呈顯著負相關(Pearson=-0.840,P<0.01),與Parkin蛋白表達呈顯著負相關(Pearson=-0.858,P<0.01),與 RCR 呈 顯 著 負 相 關(Pearson=-0.917,P<0.01,表1)。表明,骨骼肌ALCAT1蛋白表達與氧化應激和PINK1/Parkin介導的線粒體自噬關系密切。
3 分析與討論
ALCAT1是參與心磷脂病理性重塑的酰基轉移酶,目前只對該酶的生物學功能進行了初步研究。文獻表明,ALCAT1能調控線粒體呼吸功能(Li et al.,2012;Song et al.,2019)、氧化應激(Li et al.,2010;Liu et al.,2012;Wang et al.,2015;)和磷酸肌醇水平(Bone et al.,2017)。在肥胖、糖尿病、非酒精性脂肪肝和帕金森等疾病模型中,ALCAT1表達顯著升高,誘導線粒體呼吸功能紊亂、胰島素抵抗和氧化應激損傷(Li et al.,2010;Liu et al.,2012;Song et al.,2019;Wang et al.,2015)。在 ALCAT1 過表達的C2C12細胞系中,脂質過氧化產物MDA含量顯著增加,編碼氧化應激的基因NADPH氧化酶4(NOⅩ4)的mRNA表達顯著升高,而編碼抗氧化酶的基因如谷胱甘肽過氧化物酶(GPⅩ)、過氧化還原酶(PRDⅩ)、硫氧還蛋白還原酶(TⅩNRD)和超氧化物歧化酶(SOD)的mRNA表達顯著降低;使用H2O2處理小鼠分離的原代骨骼肌細胞后,ALCAT1表達顯著增加(Li et al.,2010)。以上研究提示,ALCAT1和氧化應激存在互作關系(Shi,2010)。有研究表明,ALCAT1低表達或敲除能減輕病理條件下氧化應激水平,上調PINK1/Parkin介導的線粒體自噬,改善線粒體呼吸功能(Li et al.,2010;Liu et al.,2012;Song et al.,2019;Wang et al.,2015)。Li等(2010)提出,抑制ALCAT1表達可能成為肥胖和其他代謝疾病的潛在治療靶點。有研究認為,運動訓練可能是抑制ALCAT1表達的有效手段(劉紐等,2017),但缺乏相關實驗支持。因此,本研究采取不同強度耐力運動,探討骨骼肌ALCAT1在不同強度運動中的變化特征。

圖4 骨骼肌MFN2、PINK1和Parkin蛋白表達結果Figure 4. Expression of MFN2,PINK1 and Parkin Protein in Skeletal Muscle
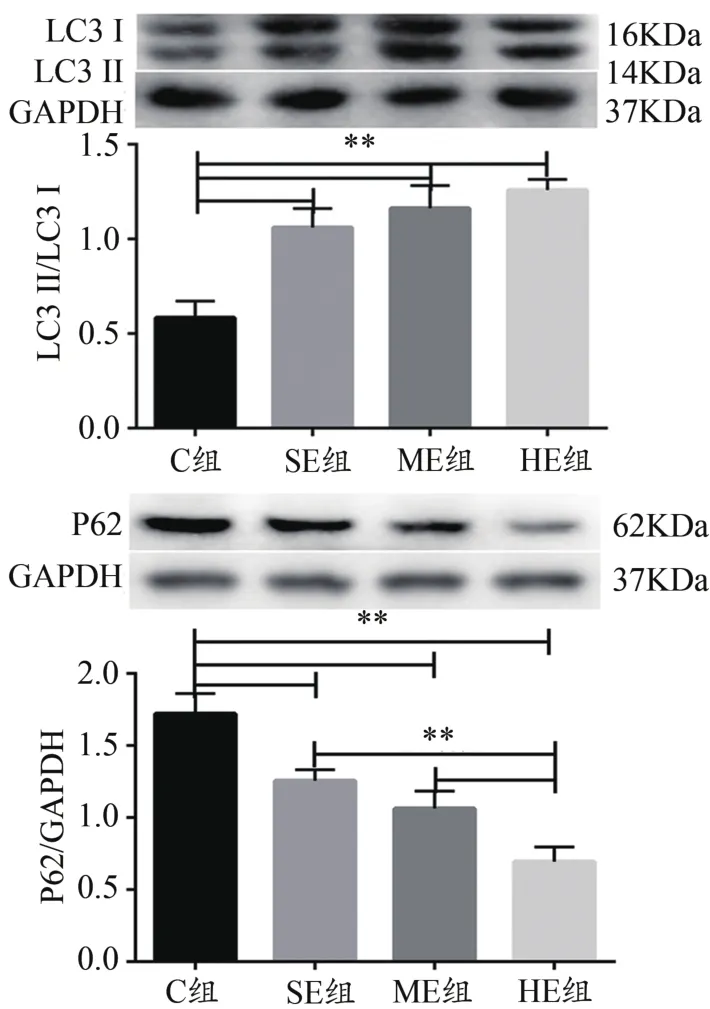
圖5 骨骼肌LC3和P62蛋白表達結果Figure 5. Expression of LC3 and P62 Protein in Skeletal Muscle
本研究發現,經過4周不同強度的耐力訓練,小鼠骨骼肌ALCAT1的mRNA和蛋白表達均顯著降低。同時,與ME組比較,SE組小鼠ALCAT1的mRNA和蛋白表達雖有降低趨勢但無顯著性,HE組小鼠ALCAT1mRNA和蛋白表達卻顯著增加。表明,骨骼肌ALCAT1表達變化呈現明顯的運動強度特征,抑制ALCAT1表達的最佳運動強度可能在76%~85%V.O2max。本研究還發現,4周60%、76%V.O2max運動強度跑臺訓練能顯著增加小鼠骨骼肌MDA含量、T-AOC含量、T-SOD活性、SOD1和SOD2蛋白表達;但在85%V.O2max運動強度組中,以上抗氧化能力指標無顯著變化,MDA含量卻異常升高。表明,適宜強度的耐力運動能刺激骨骼肌氧化產物和抗氧化酶的生成,激活氧化-抗氧化系統,而大強度運動則會顯著提高氧化應激水平,對抗氧化能力無顯著影響。值得關注的是,有研究顯示,病理條件下ALCAT1與MDA相互調節(Li et al.,2010;Liu et al.,2012;Song et al.,2019;Wang et al.,2015)。本研究結果表明,4周運動訓練后骨骼肌ALCAT1蛋白水平與MDA含量呈顯著負相關,提示,運動調控ALCAT1表達與氧化應激水平關系密切,運動產生的有益生理效應與病理條件下應激反應的差異性可能是造成這一結果的主要原因,其具體生物學分子機制仍需進一步研究。線粒體生物能學結果顯示,不同強度運動后骨骼肌ST3和RCR均顯著升高,ST4無顯著差異。但與ME組比較,HE組小鼠ST3和RCR卻顯著下降,其趨勢與ALCAT1表達一致。推測大強度運動導致骨骼肌出現氧化應激損傷,進而誘導線粒體質子漏和呼吸鏈解偶聯,線粒體呼吸功能有所下降。
線粒體是能量轉換和生物氧化的主要場所,有細胞“能量工廠”之稱。線粒體在氧化磷酸化過程中會產生ROS等副產物,引發細胞氧化應激;過度累積的ROS又會將線粒體作為攻擊靶標,損傷線粒體結構和功能(Hara et al.,2018)。與此同時,ROS能激活線粒體自噬以清除受損的線粒體,降低氧化應激水平,維持內環境穩態(Zhao et al.,2018)。心磷脂是線粒體氧化磷酸化的關鍵磷脂,ROS能氧化心磷脂的雙鍵結構,引起心磷脂病理性重塑,導致線粒體功能紊亂(Paradies et al.,2014)。ALCAT1催化心磷脂的病理性重塑,誘導氧化應激和線粒體功能障礙。文獻報道,MFN2為ALCAT1介導的線粒體功能障礙的下游靶標,在去極化的線粒體中PINK1磷酸化MFN2,吸引并結合Parkin促進線粒體自噬以清除受損的線粒體(Chen et al.,2013;Li et al.,2012)。微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3,MAP1-LC3)是反映自噬體形成的特異性標記物,它在細胞中有兩種相互轉化的形式即LC3-I和LC3-Ⅱ,目前研究中多利用LC3-Ⅱ/I比值反映自噬體的數量。P62(Protein 62)作為選擇性自噬受體,能介導LC3-Ⅱ與自噬體膜的連接,并通過自噬降解。因此,當LC3-Ⅱ/I比值與P62的降低具有一致性時,表明自噬流通暢,自噬流是評價自噬水平的可靠指標(Parousis et al.,2018)。有研究比較了久坐不動和經過耐力訓練的健康受試者股外側肌線粒體自噬相關蛋白表達,結果顯示,耐力訓練后MFN2、PINK1、Parkin和LC3蛋白表達顯著升高,P62表達沒有顯著變化,骨骼肌代謝和線粒體功能增強(Tarpey et al.,2017)。長跑運動員進行一次極限耐力運動后,肌肉活檢結果顯示,骨骼肌LC3-II表達顯著增加,PINK1和Parkin表達沒有顯著變化(Jamart et al.,2012)。動物實驗研究發現,一次大強度離心運動后,大鼠骨骼肌有大量自噬體形成,PINK1、Parkin和LC3蛋白表達均顯著升高,提示,PINK1/Parkin介導的線粒體自噬在運動性骨骼肌損傷中發揮重要作用(尚畫雨等,2018)。6周耐力訓練可顯著上調肥胖小鼠腓腸肌PINK1 mRNA和蛋白表達及LC3-Ⅱ/I比值,下調P62蛋白表達,從而提高骨骼肌線粒體數量,改善線粒體功能(崔迪等,2014)。然而另有研究報道,8周游泳耐力訓練后,雖然小鼠骨骼肌MFN2蛋白表達顯著升高,但PINK1、Parkin蛋白表達以及LC3-Ⅱ/I比值均無顯著變化,P62蛋白表達顯著下降(Ju et al.,2016)。由此可見,運動調控骨骼肌PINK1/Parkin介導的線粒體自噬可能受運動形式和運動強度的影響。
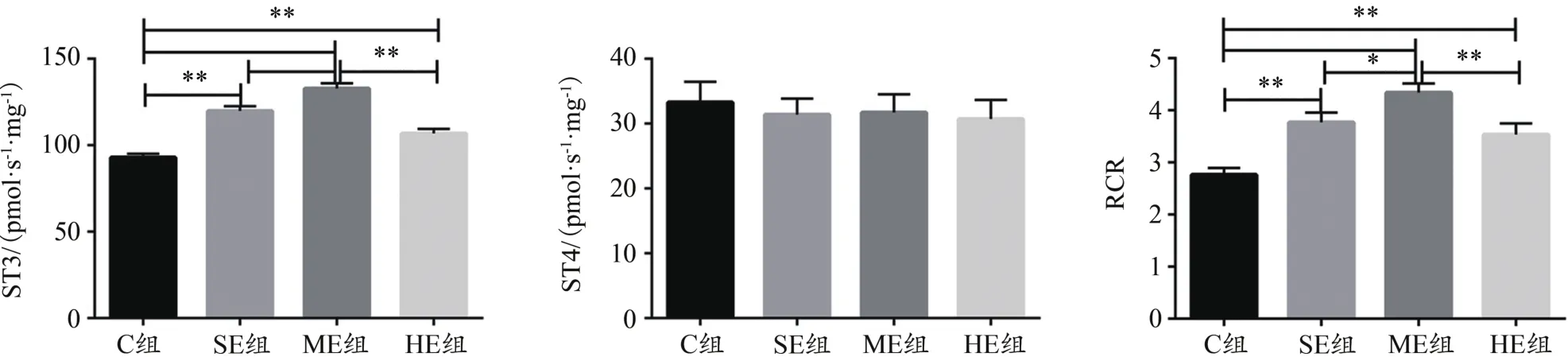
圖6 骨骼肌線粒體呼吸功能測定結果Figure 6. Measurement of Mitochondrial Respiration Function in Skeletal Muscle

表1 ALCAT1蛋白表達與氧化應激和線粒體自噬相關分析Table 1 Correlation Analysis of ALCAT1 Protein Expression with Oxidative Stress and Mitochondrial Autophag n=16
本研究結果發現,4周60%V.O2max和76%V.O2max運動強度耐力訓練可顯著提高小鼠骨骼肌MFN2、PINK1和Parkin蛋白表達以及LC3-Ⅱ/I比值,降低P62表達,表明,適宜強度運動能促進骨骼肌PINK1/Parkin介導的線粒體自噬。值得關注的是,經過85%V.O2max運動強度的耐力訓練后,骨骼肌MFN2表達以及LC3-Ⅱ/I比值升高,P62表達降低,提示自噬流通暢,但PINK1和Parkin的蛋白表達卻無顯著變化,表明,85%V.O2max運動強度的耐力訓練對骨骼肌PINK1/Parkin介導的線粒體自噬無顯著影響。原因分析:1)85%V.O2max強度運動提高了骨骼肌線粒體功能適應性,線粒體自噬水平趨于穩定;2)85%V.O2max強度運動誘導的線粒體自噬可能不依賴于PINK1/Parkin通路,其他線粒體自噬途徑如NIⅩ/BNIP3通路可能參與了此過程的線粒體自噬(Dun et al.,2017),但具體機制有待進一步研究。此外,本研究結果顯示,骨骼肌ALCAT1蛋白水平與PINK1、Parkin和RCR呈顯著負相關,推測運動抑制骨骼肌ALCAT1重塑可能與PINK1/Parkin介導的線粒體自噬有關,但具體機制尚不明確。進一步采用ALCAT1敲除及過表達動物模型,探討ALCAT1在不同強度運動調控骨骼肌氧化應激和PINK1/Parkin介導的線粒體自噬中的作用及其具體機制,將為運動介導骨骼肌功能穩態提供新的視角和依據。
4 結論
骨骼肌ALCAT1表達變化呈現明顯的運動強度特征,4周不同強度運動均可抑制骨骼肌ALCAT1表達,提高線粒體呼吸功能,其中76%V.O2max運動強度效果更顯著。

