mFOLFOX6化療聯合射頻消融治療原發性肝癌的療效及機制研究
符白玉 林怡 徐琪 張杰偉
原發性肝癌發病隱匿,臨床確診時多處于中晚期,大多數失去手術切除機會。射頻消融(radiofrequency ablation,RFA)為臨床新型微創技術之一,能局部徹底殺滅腫瘤細胞,療效明確且患者耐受性好[1],在各種實體腫瘤中應用較多,特別是原發性肝癌,被認為是繼手術切除、介入治療后治療肝癌的第三大方法,且其治療小肝癌療效與手術切除相當[2]。但受腫瘤大小、位置等影響,RFA治療范圍受限,可能影響原發性肝癌整體療效。mFOLFOX6為新輔助化療方案之一,通過調整藥物劑量以達到殺滅腫瘤細胞、增強腫瘤細胞藥物敏感度的目的。目前臨床關于mFOLFOX6化療+RFA治療原發性肝癌相關報道尚少,基于此,本研究通過對照試驗分析mFOLFOX6化療聯合RFA治療原發性肝癌的療效及對相關血清指標及10號染色體缺失的磷酸酶及張力蛋白同源物((phosphatase and tensin homolog deleted on chromosome ten,PTEN)通路相關基因表達的影響,以為臨床肝癌治療提供新方向,改善患者預后。現報道如下。
1 資料與方法
1.1 一般資料
抽取本院2014年1月至2017年1月收治的原發性肝癌患者94例,隨機數字表格法將其分為觀察組與對照組,各47例。觀察組中男30例,女17例;年齡33~67歲,平均(47.62±10.34)歲;腫瘤直徑≥5cm者33例,<5cm者14例;其中單發37例,多發10例。對照組中男28例,女19例;年齡34~68歲,平均(48.10±10.58)歲;腫瘤直徑≥5cm者30例,<5cm者17例;其中單發35例,多發12例。上述一般資料2組比較差異均無統計學意義(P>0.05),有可比性。本次研究經醫院倫理委員會批準,患者均知情同意。
1.2 納入及排除標準
納入標準:符合原發性肝癌診斷標準[2];腫瘤數目不超過3個;未累及鄰近器官、無遠處轉移;符合RFA適應證;均在本院接受治療。排除標準:凝血機制異常;黃疸、肝外組織器官轉移;肝腎原發性疾病;RFA禁忌癥;相關藥物過敏;相關資料不全者。
1.3 試劑與儀器
奧沙利鉑購自南京制藥廠有限公司,國藥準字H20000686;亞葉酸鈣購自江蘇恒瑞醫藥股份有限公司,國藥準字H20000584;氟尿嘧啶購自上海旭東海普藥業有限公司,國藥準字H31020593;血清血管內皮生長因子(vascular endothelialgrowth factor,VEGF)、堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)、糖類抗原199(carbohydrate antigen199,CA199)及甲胎蛋白(alpha fetoprotein,AFP)酶聯免疫吸附法(Enzyme-Linked ImmunoSorbent Assay,ELISA)試劑盒均購自上海江萊生物科技有限公司,分別為a12871、JL10364、0-009644、JL23952;RNA提取試劑盒購自美國Sigma公司,貨號為T9424;RT試劑盒購自美國Roche公司,貨號為4655885001;RITA1500X射頻消融治療系統購自美國RITA公司,包括射頻發生器、負極板、射頻電極等,輸出頻率460kHz±5%;ZF-6紫外分析儀購自上海市金鵬分析儀器有限公司,波長254 nm、365nm;RDY-SP8型瓊脂糖電泳儀購自上海市金鵬分析儀器有限公司,包括凝膠板、緩沖液、電泳槽等;PTEN、VEGF與缺氧誘導因子-1(hypoxia inducible factor-1,HIF-1)引物均購自美國Proteintech公司。
1.4 治療方法
觀察組行mFOLFOX6化療聯合RFA治療,先給予RFA處理:根據患者腫瘤位置選擇合適體位及進針路線,確定穿刺點及深度,局部麻醉成功后于超聲或計算機斷層掃描(computerized tomography,CT)引導下將射頻針穿刺到腫瘤靶位置,依據腫瘤直徑及位置確定消融相關參數:溫度80℃~100℃,時間10~30min;通常消融范圍為腫瘤及正常肝組織(0.5~1.0)cm。RFA治療7d后給予mFOLFOX6化療:奧沙利鉑85mg/m2靜滴,第1d;亞葉酸鈣400mg/m2靜滴,第1d;氟尿嘧啶500mg/m2靜滴,第1、2 d。1個化療周期2周,連續干預3個周期。對照組僅給予RFA治療,操作方法同觀察組。
1.5 觀察指標
1.5.1 近期療效
以實體瘤療效評價標準[3]為依據,完全緩解(complete remission,CR):靶病灶全部消失,腫瘤標志物水平降至正常范圍,且持續至少4周;部分緩解(partial remission,PR):病灶長徑總和縮小30%以上,且持續至少4周;穩定(stable disease,SD):介于PR與疾病進展(progression disease,PD)間;PD:病灶長徑總和增大20%以上,或新病灶出現。有效率(response rate,RR)=CR率+PR率;疾病控制率(disease control rate,DCR)=100%-PD率。
1.5.2 血清指標測定
分別于治療前、治療后2周空腹抽取患者外周靜脈血3mL,以2000r/min速率常規離心,離心15min,血清提取后保存待測。均通過ELISA測定2組患者血清VEGF、b FGF、CA199及AFP水平,嚴格按照ELISA試劑盒說明書操作。
1.5.3 PTEN通路相關基因測定
包括PTEN、VEGF與HIF-1mRNA表達,于治療后7d行腫瘤組織活檢,檢測方法為逆轉錄-聚合酶鏈式反應法(reverse transcription-polymerase chain reaction,RT-PCR):依據RNA提取試劑盒說明書提取肝組織標本總RNA,采用紫外分析儀、瓊脂糖電泳儀分別對總RNA濃度、完整性進行檢測。按照RT試劑盒說明書將總RNA反轉錄成cDNA。
1.6 統計學處理
應用SPSS 20.0軟件處理數據,計數資料以率表示,行χ2檢驗;計量資料以(±s)表示,行t檢驗;以P<0.05為差異有統計學意義。
2 結果
2.1 近期療效
觀察組RR、DCR均高于對照組,差異均有統計學意義(P<0.05),見表1。
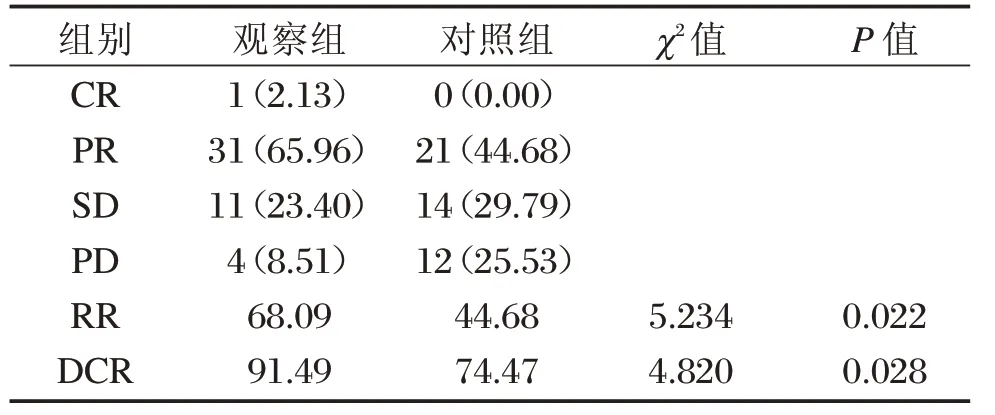
表1 2組近期療效比較[n=47,(%)]Table1 Comparison of short-term curative effect between the 2 groups[n=47,(%)]
2.2 血清VEGF、bFGF水平變化
與治療前比較,2組治療后血清VEGF、bFGF水平均明顯下降(P<0.05);觀察組治療后血清VEGF、bFGF水平均明顯低于對照組,差異有統計學意義(P<0.05),見表2。
表2 2組治療前后血清VEGF、b FGF水平比較[(±s,pg/mL),(n=47)]Table2 Comparison of serum VEGF and bFGF levels before and after treatment in the 2 groups[(±s,pg/mL),(n=47)]
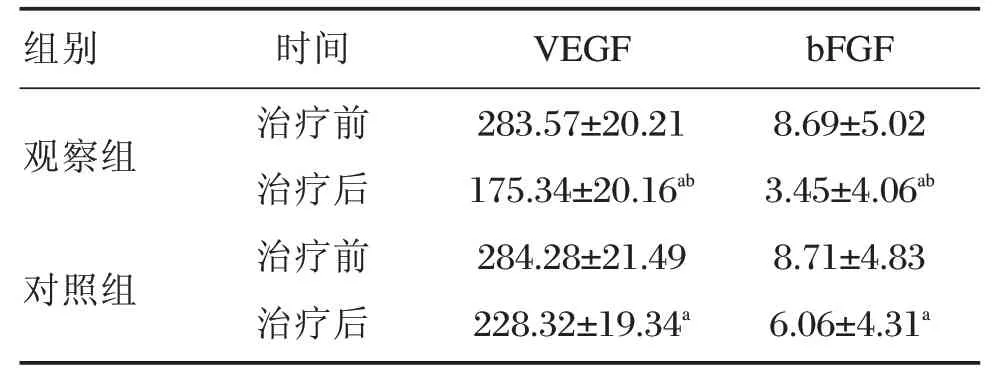
表2 2組治療前后血清VEGF、b FGF水平比較[(±s,pg/mL),(n=47)]Table2 Comparison of serum VEGF and bFGF levels before and after treatment in the 2 groups[(±s,pg/mL),(n=47)]
注:與同組治療前比較,aP<0.05;與對照組治療后比較,bP<0.05。
組別觀察組對照組時間治療前治療后治療前治療后VEGF 283.57±20.21175.34±20.16ab 284.28±21.49 228.32±19.34a bFGF 8.69±5.023.45±4.06ab 8.71±4.836.06±4.31a
2.3 血清CA199、AFP水平變化
與治療前比較,2組治療后血清CA199、AFP水平均明顯下降差異具有統計學意義(P<0.05);觀察組治療后血清CA199、AFP水平均明顯低于對照組,差異有統計學意義(P<0.05),見表3。
表3 2組治療前后血清CA199、AFP水平比較[n=47,(±s)]Table3 ComparisonofserumCA199andAFPlevelsbefore andaftertreatmentinthe2groups[n=47,(x±s)]
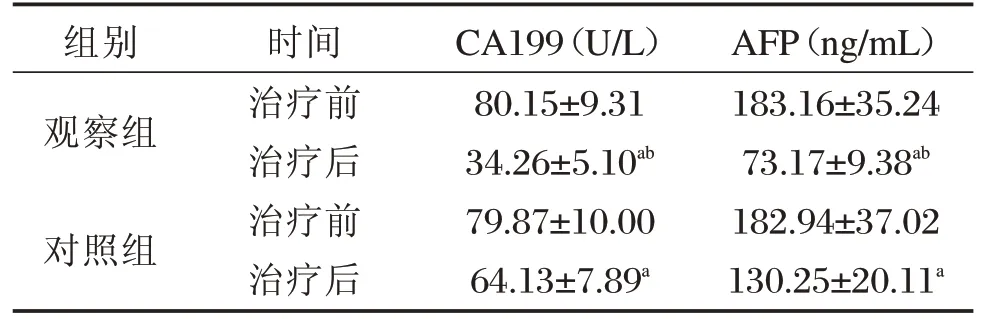
表3 2組治療前后血清CA199、AFP水平比較[n=47,(±s)]Table3 ComparisonofserumCA199andAFPlevelsbefore andaftertreatmentinthe2groups[n=47,(x±s)]
注:與同組治療前比較,aP<0.05;與對照組治療后比較,bP<0.05。
組別觀察組對照組時間治療前治療后治療前治療后CA199(U/L)80.15±9.31 34.26±5.10ab 79.87±10.00 64.13±7.89a AFP(ng/mL)183.16±35.24 73.17±9.38ab 182.94±37.02 130.25±20.11a
2.4 肝組織PTEN通路相關基因表達
觀察組治療后PTENmRNA表達比對照組高,而VEGF、HIF-1mRNA表達比對照組低,差異均有統計學意義(P<0.05)。見表4。
表4 2組治療后PTEN、VEGF與HIF-1mRNA表達量比較[n=47,(±s)]Table4 Comparison of PTEN,VEGF and HIF-1mRNA expression after treatment in the 2 groups[n=47,(±s)]
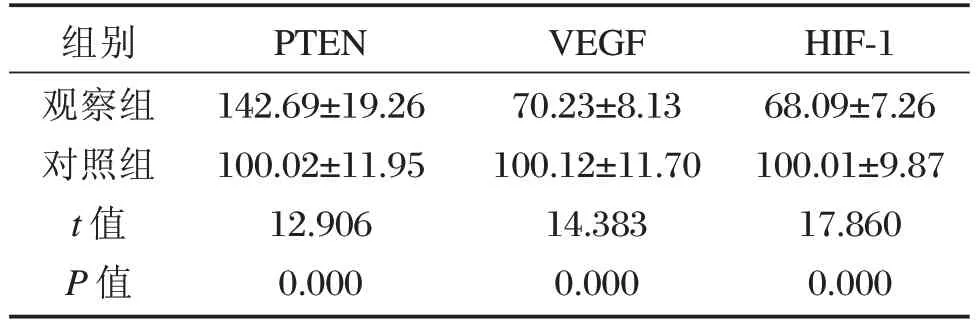
表4 2組治療后PTEN、VEGF與HIF-1mRNA表達量比較[n=47,(±s)]Table4 Comparison of PTEN,VEGF and HIF-1mRNA expression after treatment in the 2 groups[n=47,(±s)]
組別觀察組對照組t值P值PTEN 142.69±19.26 100.02±11.9512.9060.000VEGF 70.23±8.13100.12±11.7014.3830.000HIF-168.09±7.26 100.01±9.8717.8600.000
2.5 不良反應情況
所有患者均無嚴重RFA相關不良反應發生。觀察組化療期間發生白細胞計數減少1例,輕度肝功能損害3例。
3 討論
臨床發現,受肝動脈解剖、側支循環形成等多種因素影響,肝動脈化療栓塞(transcatheter hepatic arterial chemoembolization,TACE)治療原發性肝癌遠期療效不理想[4]。對此建議尋找新的手段或聯合RFA及其他方法治療[5-7]。
RFA以超聲或CT為引導,可直接將電極引入腫瘤內部,經由高頻電流生熱讓局部腫瘤細胞蛋白質變性及凝固性壞死,最終致使腫瘤組織脫落,達到徹底殺傷腫瘤細胞的目的[8]。若溫度不能促使腫瘤組織壞死,腫瘤內附近血管組織因射頻作用會形成反應帶(約10mm),對腫瘤血液供應阻斷,以誘導癌組織死亡,減少轉移風險[9]。苗同國等[10]研究表明RFA能有效改善原發性肝癌患者細胞免疫功能。由于RFA治療范圍有限,為進一步提高原發性肝癌療效,我們采取RFA聯合化療方案治療。mFOLFOX6化療方案包括奧沙利鉑、亞葉酸鈣、氟尿嘧啶成分,其中氟尿嘧啶于細胞內轉化成脫氧核苷酸,抑制并破壞DNA之胸苷酸合成酶合成,且氟尿嘧啶通過轉化進入核糖核酸,對蛋白質合成影響,可對細胞形成各時期作用。臨床發現氟尿嘧啶與奧沙利鉑、亞葉酸鈣合用相對單藥干預效果明顯,且不顯著增加化療不良反應[11]。
本研究結果顯示相比單純RFA治療,RFA聯合mFOLFOX6化療治療近期療效顯著,與胡十齊等[12]研究結果相符。表明RFA聯合化療治療原發性肝癌療效更好,這是因為RFA通過高頻電流殺滅腫瘤細胞,聯合化療藥物能更徹底的殺滅腫瘤細胞。同時本研究發現聯合治療不顯著增加化療毒副反應,患者可耐受。本研究還從血清分子指標及腫瘤生長信號通路方面評價原發性肝癌治療效果及預后。血清指標指標方面,VEGF為臨床常見血管生長因子之一,對血管內皮細胞特異性作用以參與實體瘤血管新生、侵襲及轉移過程。bFGF除了對正常組織影響外,還參與腫瘤間質血管新生、侵襲等。張惠潔等[13]研究發現TACE聯合索拉非尼相比單純TACE能明顯降低肝癌患者血清VEGF、bFGF水平。本研究結果顯示相比單純RFA治療,RFA聯合mFOLFOX6化療能進一步降低血清VEGF、bFGF水平,抑制癌細胞活性,阻斷其轉移。這不但與RFA阻斷血供,抑制腫瘤新生血管形成有關,而且與mFOLFOX6化療藥物促使腫瘤細胞死亡,減輕腫瘤負荷,進而促使VEGF、bFGF水平降低有關。為此筆者認為VEGF、bFGF下降可作為原發性肝癌疾病控制評價指標。AFP、CA199為臨床常見腫瘤標記物[14],也被認為是腫瘤復發相關指標,其中AFP為原發性肝癌診斷敏感性指標。CA199常用于消化系統腫瘤診斷及觀察,相關研究發現大部分原發性肝癌患者血清CA199水平升高,認為CA199可與AFP等指標一同成為原發性肝癌療效判斷指標[15]。本研究結果顯示RFA聯合mFOLFOX6化療相比RFA單獨治療能進一步降低原發性肝癌患者血清CA199、AFP水平,可見聯合治療可徹底殺滅腫瘤細胞,促使血清腫瘤標記物趨于正常,也降低了治療后復發幾率。腫瘤生長信號通路方面,PTEN信號通路被發現參與細胞增殖、凋亡,在腫瘤血管生成中發揮至關重要的作用[16]。PTEN為抑癌基因之一,大部分腫瘤內其表達下降。VEGF、HIF-1屬于PTEN信號通路下游基因,腫瘤缺氧時,HIF-1可作為轉錄激活介質,結合于VEGF啟動相關因子,促VEGF表達及VEGF受體轉錄,進而腫瘤血管新生形成[17]。本研究顯示,mFOLFOX6化療聯合RFA治療能有效增強肝癌組織PTEN表達,抑制VEGF、HIF-1基因表達,阻斷腫瘤細胞血液供應,進而降低血管形成相關指標VEGF、bFGF水平,促腫瘤細胞凋亡及腫瘤標記物下降,提高治療效果。受觀察時間影響,本研究未分析其復發及遠期存活率,有待日后通過延長觀察時間進一步探究。
綜上,mFOLFOX6化療聯合RFA治療原發性肝癌近期療效較好,且較安全,能明顯降低血清bFGF、CA199水平,調節PTNE信號通路。

