肺癌癌組織中M2-PK、和ENO1的表達水平及對其生存期的預測價值
范華穎 張家艷 方怡 高陽
近年來惡性腫瘤成為威脅人類健康的主要疾病之一,其中肺癌已成為我國發病率上升最快的惡性腫瘤,而非小細胞肺癌(non-small cell lung cancer,NSCLC)是患病比例最高的肺癌類型,約占肺癌患者的90%[1-2]。隨著臨床檢測技術的不斷發展,腫瘤標志物檢測已成預測腫瘤發生、診斷及腫瘤治療效果監測的有效參考指標[3]。腫瘤型丙酮酸激酶(tumor M2 pyruvate kinase,M2-PK)和烯醇化酶-α(enolase-α,ENO1)是細胞進行有氧糖酵解途徑的關鍵調節酶[4-5],其在多種腫瘤細胞中存在明顯的異常高表達現象,對腫瘤的發生、發展具有重要意義[6-7]。但關于M2-PK和ENO1在NSCLC患者肺癌組織中的表達,以及對患者生存期預測的研究少有報道。因此,本文以NSCLC患者為研究對象,探討肺癌患者肺癌組織中M2-PK和ENO1的表達水平與患者臨床病理分級及對患者生存期的預測價值。
1 資料與方法
1.1 一般資料
選取2011年1月至2013年6月間本院收治,經病理學檢查確診的182例NSCLC患者。研究組中男性108例,女性74例,患者年齡32~75歲,平均(49.18±9.67)歲,其中鱗癌128例,腺癌54例;腫瘤分期結果(Tumor Node Metastasis,TNM):Ⅰ期32例;Ⅱ期58例,Ⅲ期52例,Ⅳ期40例;高分化87例,低分化95例;其中淋巴結發生轉移患者87例;浸潤深度T1和T2共97例,T3和T4共85例。對照組選擇68例同期醫院就診的肺良性病變患者,男性35例,女性33例,患者年齡31~74歲,平均(48.68±9.52)歲,疾病類型為慢性支氣管炎32例,支氣管擴張22例,肺結核14例。2組入選患者年齡、性別等信息資料差異無統計學意義(P>0.05),具有可比性。
1.2 納入排除標準
肺癌患者納入標準:患者經病理學診斷標準[8]確診為NSCLC患者;入院治療前未接受放療、化療、手術和靶向藥物等治療;術前均存在可測量病灶,臨床資料完整。排除標準:患者存在腫瘤轉移或患有其他腫瘤;合并有其他器官功能異常及嚴重心血管疾病;患有先天性肺功能異常或畸形患者。肺良性病納入標準:經醫院診斷確診為慢性支氣管炎、支氣管擴張、肺結核的患者;無其他重大疾病患者;近3個月未發生嚴重感染患者。排除標準:患者存在其他腫瘤;肺部存在嚴重感染或損傷。所有入選對象均簽署知情同意書,自愿參與本課題研究。
1.2 材料與方法
1.2.1 試劑及儀器
兔抗人ENO1抗體購自美國Proteintech Group公司,貨號:55237-1-AP;兔抗人M2-PK抗體購自中國北京博奧森有限公司,貨號:bs-0101R;圖像采集成像系統(chemiDocTm)及圖像分析系統(Quantity One 1-D分析軟件)購自美國Bio-Rad Laboratories公司。
1.2.2 免疫組化分析
將患者進行病理學診斷時獲得的病理組織由石蠟包埋后連續切片,固定于載玻片上,50℃烘箱中烘1h后,二甲苯、100%乙醇、95%乙醇、80%乙醇及75%乙醇依次進行水化,蒸餾水洗滌3次,然后置于檸檬酸鈉溶液中加熱2次,每次8min,PBS洗滌3次,3%H2O2溶液中浸10min,PBS洗滌3次后,滴加ENO1抗體和M2-PK抗體稀釋液,4℃孵育過夜。PBS洗滌3次后用羊抗兔二抗室溫孵育1h,PBS洗滌3次,免疫組化染色,蘇木精復染,0.1%HCl分化,藍化,梯度酒精脫水干燥,二甲苯透明,中性樹膠封固。
1.2.3 數據對比分析
免疫組化結果評估由兩名專業病理人員采用雙盲法進行判定,每張組織切片高倍鏡下隨機選取5個視野區,每個視野區計100個腫瘤細胞,根據M2-PK蛋白和ENO1蛋白定位結果,進行結果分析,結果一致則記錄結果;不一致則由2人相同意見或第3位更加權威的醫師確定。其中M2-PK定位與胞漿或胞核,ENO1定位與胞漿或胞膜。陽性結果判讀采用免疫組化半定量分析,陽性細胞比例評定>5%患者檢測為陽性[8-9]。
1.2.4 隨訪及信息統計
所有患者以門診、住院復查的方式由主治醫師定期隨訪,隨訪內容包括患者治療方案、復查信息、肺部電子計算機斷層掃描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)檢測、生存信息統計等。時間起始于患者入院治療,隨訪5年,統計患者5年內的存活情況。
1.3 統計學分析
采用SPSS 22.0統計學軟件進行分析,對于服從正態分布的連續型資料,計量資料以()表示表示,組間比較采用單因素方差分析(one-way ANOVA);計數資料以率(%)表示,組間比較應用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 肺組織中M2-PK和ENO1的表達
M2-PK在在肺良性病變組織中的陽性表達22例,陽性率為32.36%;在肺癌組織中陽性表達142例,陽性率為78.02%,顯著高于肺良性病變患者,差異有統計學意義(P<0.05)。ENO1在肺良性病變組織中的陽性表達20例,陽性率為29.41%;在肺癌組織中陽性表達123例,陽性率為67.58%,顯著高于肺良性病變患者,差異有統計學意義(P<0.05)。見表1,圖1。
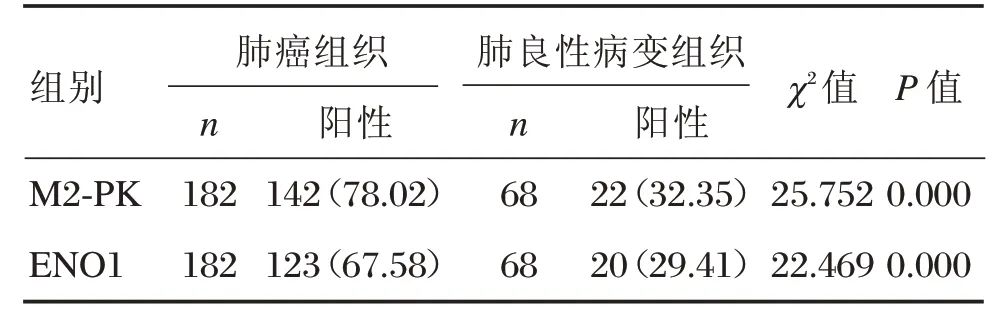
表1 M2-PK、ENO1在肺良性病變組織和肺癌組織中的表達[n(%)]Table1 Expression of M2-PK and ENO1in benign lung lesions tissues and lung cancer tissues[n(%)]
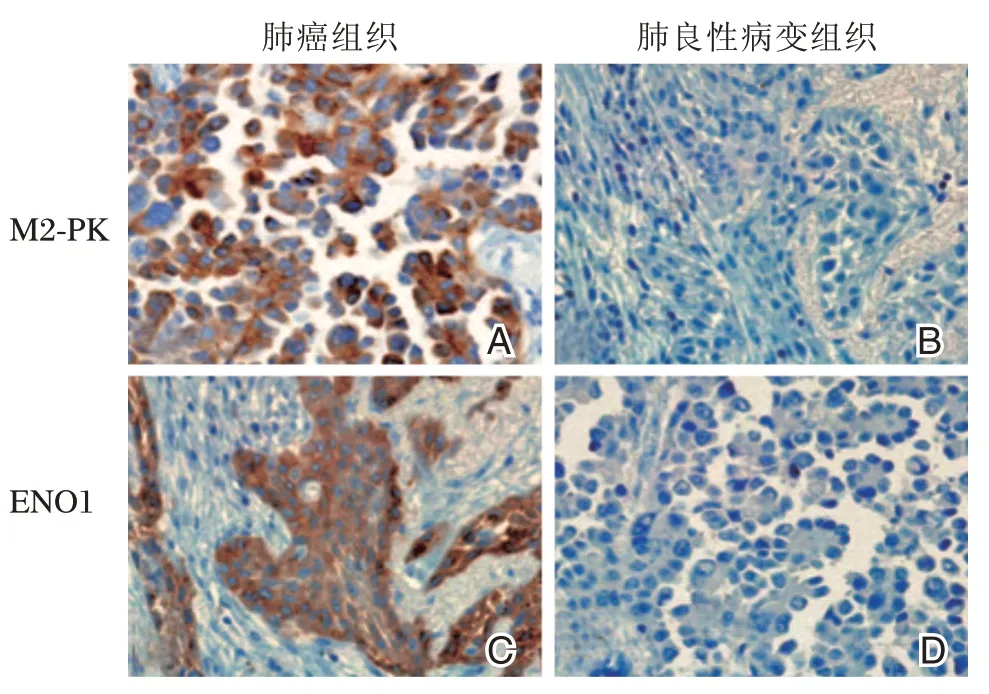
圖1 M2-PK、ENO1在肺組織中的免疫組化分析(×40)Figure1 Immunohistochemicalanalysis of and in lung tissues(×40)
2.2 肺癌組織中M2-PK、ENO1表達與臨床病理特征的關系
分析患者的臨床病理特征與肺癌組織中ENO1、M2-PK表達,結果顯示,肺癌組織中ENO1、M2-PK表達與肺癌的分化程度、浸潤、TNM分期、淋巴結轉移差異有統計學意義(P<0.05),與患者的年齡、性別差異無統計學意義(P>0.05),見表2。
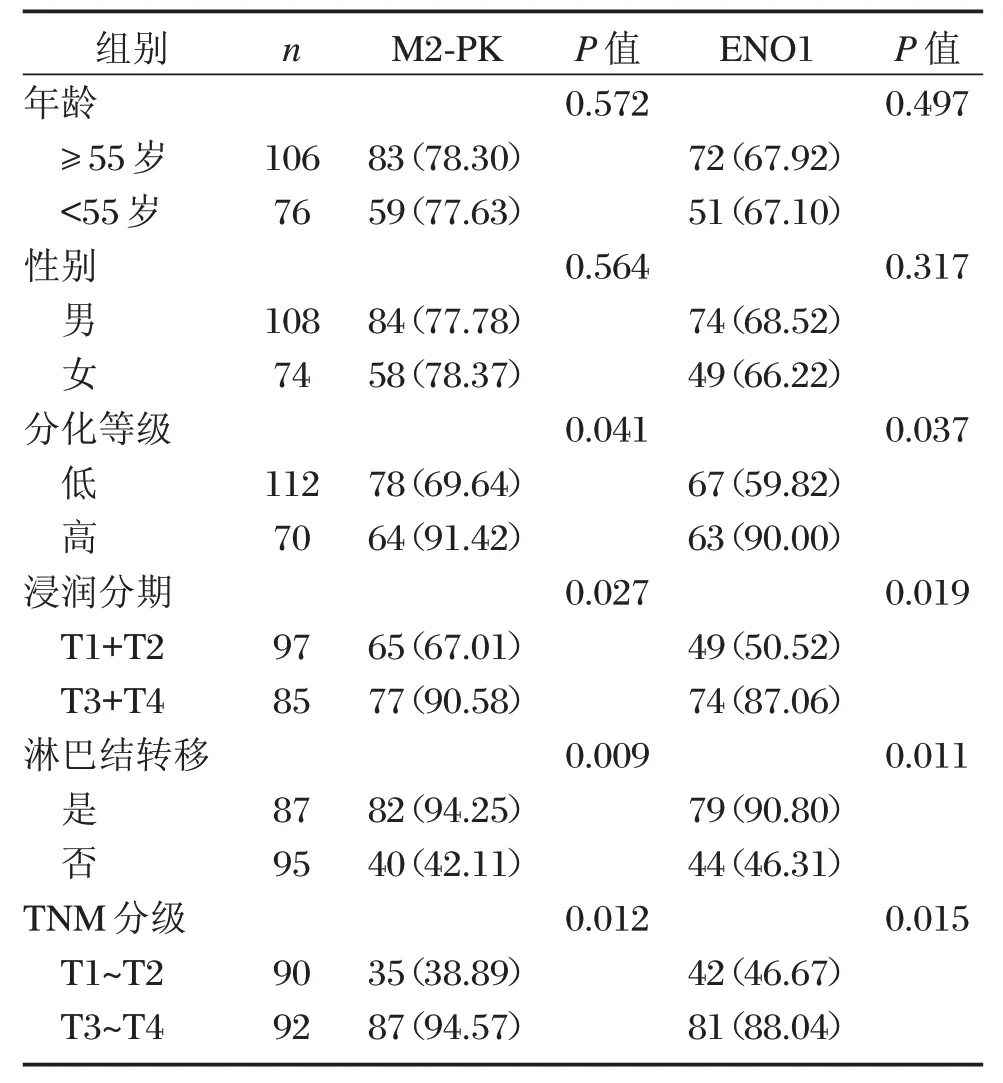
表2 M2-PK、ENO1表達與肺癌臨床病理特征的關系[n(%)]Table2 Relationship between expression ofM2-PK and ENO1and clinicopathological features of lung cancer[n(%)]
2.3 肺癌組織中M2-PK、ENO1表達相關性
肺癌組織中共111例M2-PK、ENO1共陽性表達,28例M2-PK、ENO1共陰性表達,M2-PK單陽性31例,ENO1單陽性12例,相關性分析結果顯示M2-PK與ENO1表達呈正相關(r=0.769,P<0.05)。
2.4 肺癌組織中M2-PK和ENO1高表達與患者生存期的關系
陽性細胞比例達50%以上為高表達,不表達或低于50%為低表達,分析2種蛋白高、低表達對患者5年生存的影響,結果顯示,M2-PK陽性細胞比例≥50%共83例,患者5年存活31例,存活率為37.35%;M2-PK低表達99例,患者5年存活62例,存活率為62.62%,顯著高于M2-PK高表達患者,差異有統計學意義(P<0.05)。ENO1陽性細胞比例≥50%共65例,患者5年存活21例,存活率為32.31%;ENO1低表達117例,患者5年存活62例,存活率為52.99%,顯著高于ENO1高表達患者,差異有統計學意義(P<0.05)。
2.5 肺癌組織中M2-PK、ENO1高表達與患者生存期的關系
選擇ENO1和M2-PK共表達的111例患者為研究對線,2種蛋白陽性細胞比例均在50%以上為共高表達,均低于50%為低表達,分析2種蛋白高表達對患者5年生存率的影響,結果顯示,M2-PK和ENO1共高表達患者52例,5年存活患者15例,存活率為28.8 4%;共低表達患者59例,5年存活患者35例,存活率為59.32%,顯著高于M2-PK和ENO1共高表達患者,差異有統計學意義(P<0.05),見圖2。
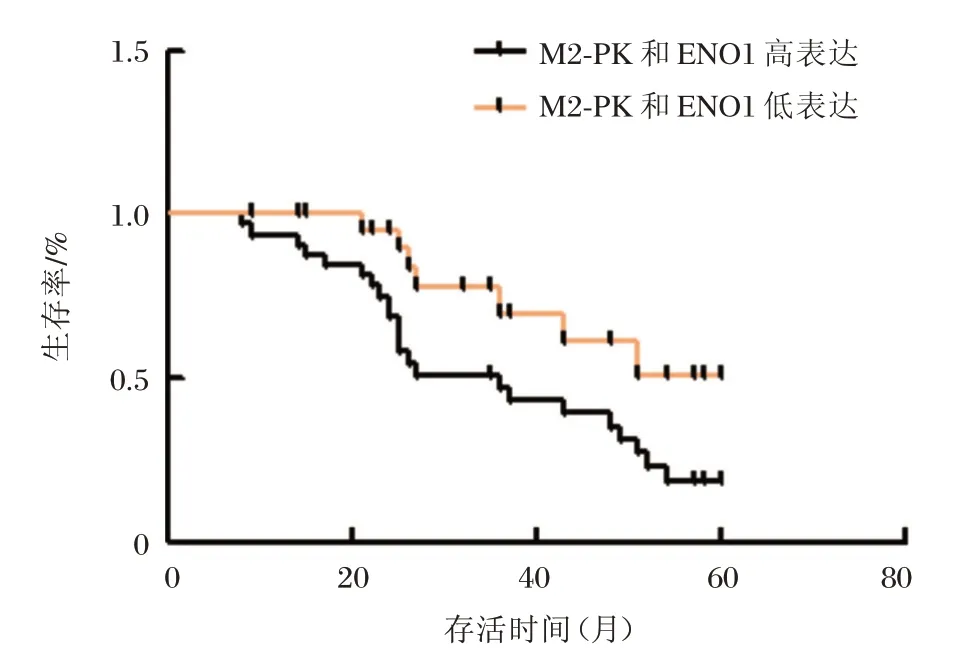
圖2 肺癌組織中M2-PK、ENO1高表達與患者5生存期的關系Figure2 Relationship between high expression of M2-PK and ENO1and 5-year survival time in lung cancer tissues
3 討論
M2-PK是丙酮酸激酶的一種同工酶,對三磷酸腺苷的合成起著重要作用,當M2-PK以二聚體存在時主要調節機體碳水化合物的合成轉態;以四聚體形式存在時調節機體糖酵解的產能狀態[9]。在腫瘤的發生發展過程中,初始組織特異性的丙酮酸激酶會逐漸被M2代替,并以二聚體形式存在于腫瘤細胞中,促使和增強腫瘤糖酵解途徑,在腫瘤細胞增殖與代謝過程中發揮重要作用[10-11]。研究發現正常人血清中M2-PK水平很低,而在腫瘤患者血清中顯著升高,臨床顯示其在肺癌、乳腺癌、宮頸癌等實體腫瘤的診斷中具有重要作用[12-13]。在黑色素瘤的研究發現,M2-PK水平不僅與患者的臨床分期有關,同時而還能在預測患者生存預后發揮重要價值[14]。
ENO1是一種高度保守磷酸烯醇化酶,該蛋白在胞漿中的表達主要作用是參與細胞的糖酵解途徑發揮催化作用,促進磷酸化烯醇式丙酮酸的形成[15],參與體內多種生物學活動,如低氧耐受及炎癥反應。此外許多報道表明,ENO1與腫瘤的發生發展密切相關,如乳腺癌、肺癌、肝癌等多種惡性腫瘤中存在異常高表達現象[16]。Yu等[17]人的研究發現ENO1可以作為早期肺癌診斷標志物。在非小細胞肺癌中,ENO1能夠通過抑制ERK的磷酸化抑制肺癌細胞的上皮間質轉化[18]。在對前列腺癌的研究發現,ENO1能夠刺激血纖維蛋白溶酶體受體的活化促進癌細胞的遷移[17],而腫瘤的侵襲和簽署是患者治療和預后的重要因素[19]。
由于腫瘤細胞在快速增殖過程中的能量代謝主要依賴于葡萄糖的糖酵解途徑,M2-PK和ENO1作為糖酵解途徑的關鍵酶,其表達水平與腫瘤細胞的增殖密切相關。此外,在實體腫瘤組織中,由于腫瘤細胞的快速增殖,往往會造成組織處于低氧狀態促進缺氧誘導因子的表達,進而增強細胞的糖酵解途徑[20-21],在對M2-PK、ENO1的基因研究發現,兩者的啟動區均存在缺氧反應原件;同時缺氧誘導因子的表達能夠促進腫瘤細胞的侵襲和轉移,而ENO1在細胞表面的高表達能夠增強細胞的侵襲能力。本文對NSCLC患者肺癌癌組織中表達水平分析顯示,M2-PK、ENO1肺癌組織中陽性率顯著高于肺良性病變患者(P<0.05);與Yu等[22]和Kobierzycki等[23]的關于M2-PK、ENO1在NSCLC患者中的表達結果一致。
研究證實由于M2-PK和ENO1蛋白能夠通過腫瘤細胞的壞死與細胞更新,分泌到細胞外,其表達水平只與腫瘤的病征有關。本文對2種蛋白的表達相關性分析發現與Gu等[23]的研究結果一致,這可能與兩者均為糖酵解途徑中的關鍵酶有關。同時本文也首次研究患者治療前M2-PK和ENO1共表達水平與患者5年存活率的關系,結果顯示M2-PK和ENO1高表達患者的5年存活率均顯著低于M2-PK和ENO1低表達患者(P<0.05),其原因可能是M2-PK和ENO1高表達水平預示著腫瘤細胞處于較高的增殖活性,患者的腫瘤分化差、晚期患者比例高、遠處轉移風險高,治療難度大,不利于患者的預后和長期生存[25]。
綜上所述,肺癌組織中M2-PK、ENO1的高水平表達與肺癌的發生、發展及預測患者的生存期有一定指導意義。

