沉淀溶解平衡圖象的常見類型和分析方法
◇ 甘肅 楊仕芳
沉淀溶解平衡圖象以二維曲線形式呈現(xiàn):包含“軸”(橫縱坐標(biāo))“線”(圖上的一條或幾條直線、曲線)“點(diǎn)”(線上的點(diǎn)、線外的點(diǎn))之間的關(guān)系,直觀、形象、簡潔地反映溶解規(guī)律,表達(dá)沉淀原理,是近幾年高考考查的熱點(diǎn).本文以MnAm(S)nMm+(aq)+mAn-(aq)為依據(jù),對圖象的類型和特點(diǎn)加以分析.
1 離子濃度圖象
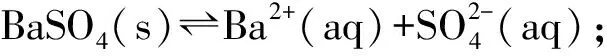
圖1
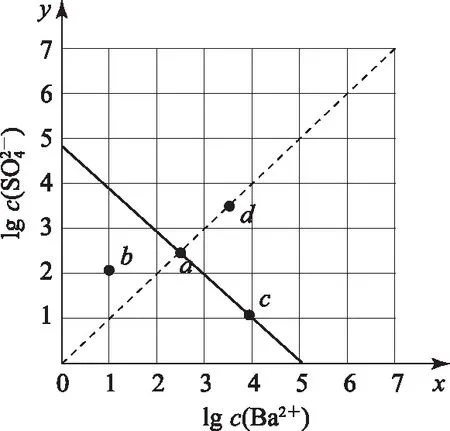
2)由圖中曲線上的任意一點(diǎn)的坐標(biāo)均可計算Ksp(BaSO4).


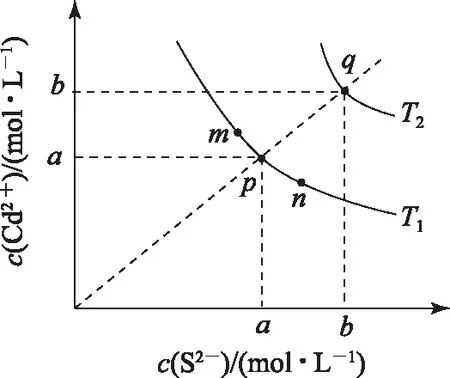
圖2
A. 圖中a和b分別為T1、T2溫度下CdS在水中的溶解度
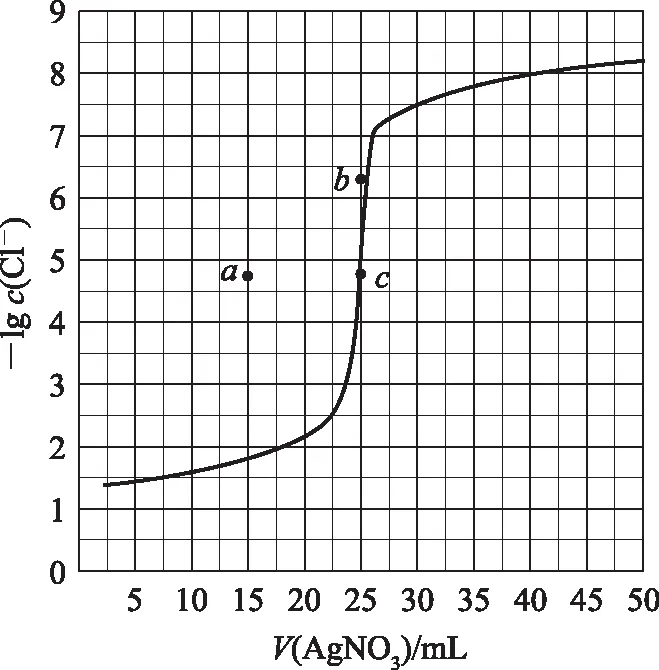
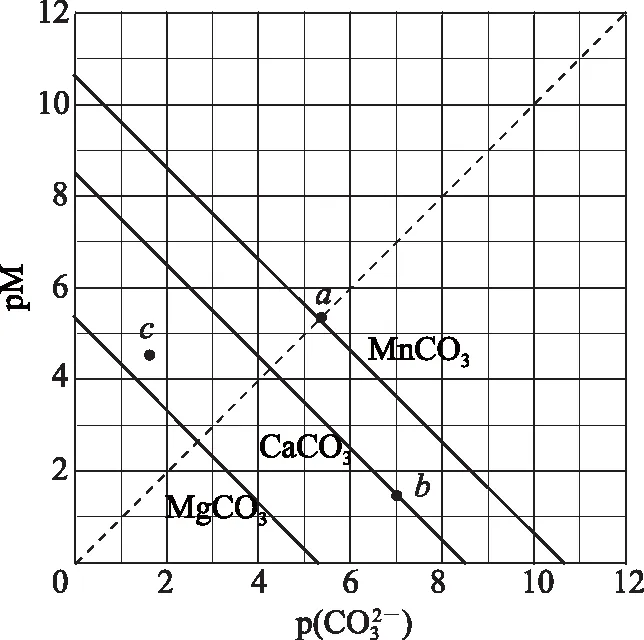
B. 圖中各點(diǎn)對應(yīng)的Ksp的關(guān)系為Ksp(m)=Ksp(n) C. 向m點(diǎn)的溶液中加入少量Na2S固體,溶液組成由m沿mpn線向p方向移動 D. 溫度降低時,q點(diǎn)飽和溶液的組成由q沿qp線向p方向移動 圖3 2)由圖中直線上任意一點(diǎn)的坐標(biāo)均可計算lgKsp(BaSO4). 若將橫、縱坐標(biāo)變?yōu)殡x子濃度的負(fù)對數(shù),同理推導(dǎo)-lgc(Mm+)與-lgc(An-)二者的關(guān)系也應(yīng)是一條直線,但離子濃度的大小與圖線中的數(shù)據(jù)成反比,即圖中的數(shù)據(jù)越大、離子濃度越小. 圖4 A. MgCO3、CaCO3、MnCO3的Ksp依次增大 如果圖象反映的是難溶氫氧化物的溶解度或金屬陽離子濃度與pH的關(guān)系,則平衡曲線中應(yīng)是一條體現(xiàn)溶解度S或離子濃度c隨著pH的增大而減小的曲線. 圖5 A.Ksp[Fe(OH)3] B. 加適量NH4Cl固體可使溶液由a點(diǎn)變到b點(diǎn) C.c、d兩點(diǎn)代表的溶液中c(H+)與c(OH-)乘積相等 D. Fe(OH)3、Cu(OH)2分別在b、c兩點(diǎn)代表的溶液中達(dá)到飽和 c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3], 選項D說法正確.答案為B. 如果圖象反映的是難溶物離子濃度負(fù)對數(shù)或?qū)?shù)與離子物質(zhì)的量的關(guān)系,則平衡曲線應(yīng)是與酸堿中和滴定曲線相似的一條曲線. 圖6 A. 根據(jù)曲線數(shù)據(jù)計算可知Ksp(AgCl)的數(shù)量級為10-10 B. 曲線上各點(diǎn)的溶液滿足關(guān)系式c(Ag+)·c(Cl-)=Ksp(AgCl) C. 相同實(shí)驗(yàn)條件下,若改為0.040 0 mol·L-1Cl-,反應(yīng)終點(diǎn)c移到a D. 相同實(shí)驗(yàn)條件下,若改為0.050 0 mol·L-1Br-,反應(yīng)終點(diǎn)c向b方向移動 沉淀溶解平衡圖象是將難溶電解質(zhì)溶解時的化學(xué)反應(yīng)原理、數(shù)學(xué)關(guān)系與圖象結(jié)合起來設(shè)置的一種數(shù)形結(jié)合題目,要求學(xué)生將抽象思維進(jìn)行形象化表達(dá).在近幾年的高考化學(xué)試題中頻繁出現(xiàn),通過分析、識別、判斷、推理等高階思維進(jìn)行解答,旨在考查學(xué)生的綜合能力.
2 離子濃度對數(shù)或負(fù)對數(shù)圖象
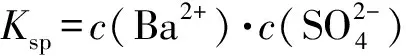


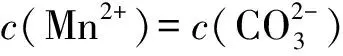
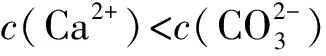
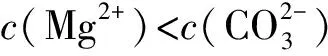

3 溶液pH與溶解度或金屬陽離子濃度圖象
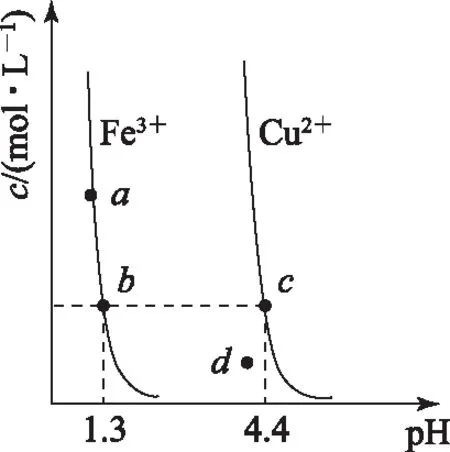


c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2],4 離子物質(zhì)的量與離子濃度負(fù)對數(shù)圖象