淺談全國卷涉及“NA”的基本題型及解題思路
◇ 安徽 尉言勛 徐 楠
阿伏加德羅常數(shù)的相關(guān)知識(shí)充分體現(xiàn)了化學(xué)研究從定性到定量、從宏觀到微觀的學(xué)科特點(diǎn),考查學(xué)生是否具有靈活運(yùn)用基礎(chǔ)知識(shí)解決實(shí)際問題的能力.題目以選擇題的形式出現(xiàn),以物質(zhì)的量為中心結(jié)合阿伏加德羅定律、氣體摩爾體積等知識(shí)進(jìn)行考查,有時(shí)也涉及物質(zhì)結(jié)構(gòu)、電解質(zhì)溶液、可逆反應(yīng)以及氣體混合物等相關(guān)知識(shí)內(nèi)容.本文通過對(duì)近年高考典型試題的對(duì)比分析,歸納了阿伏加德羅常數(shù)的常見考查方式,希望對(duì)復(fù)習(xí)備考有一定的啟發(fā).
1 近年高考典型試題考試內(nèi)容對(duì)比
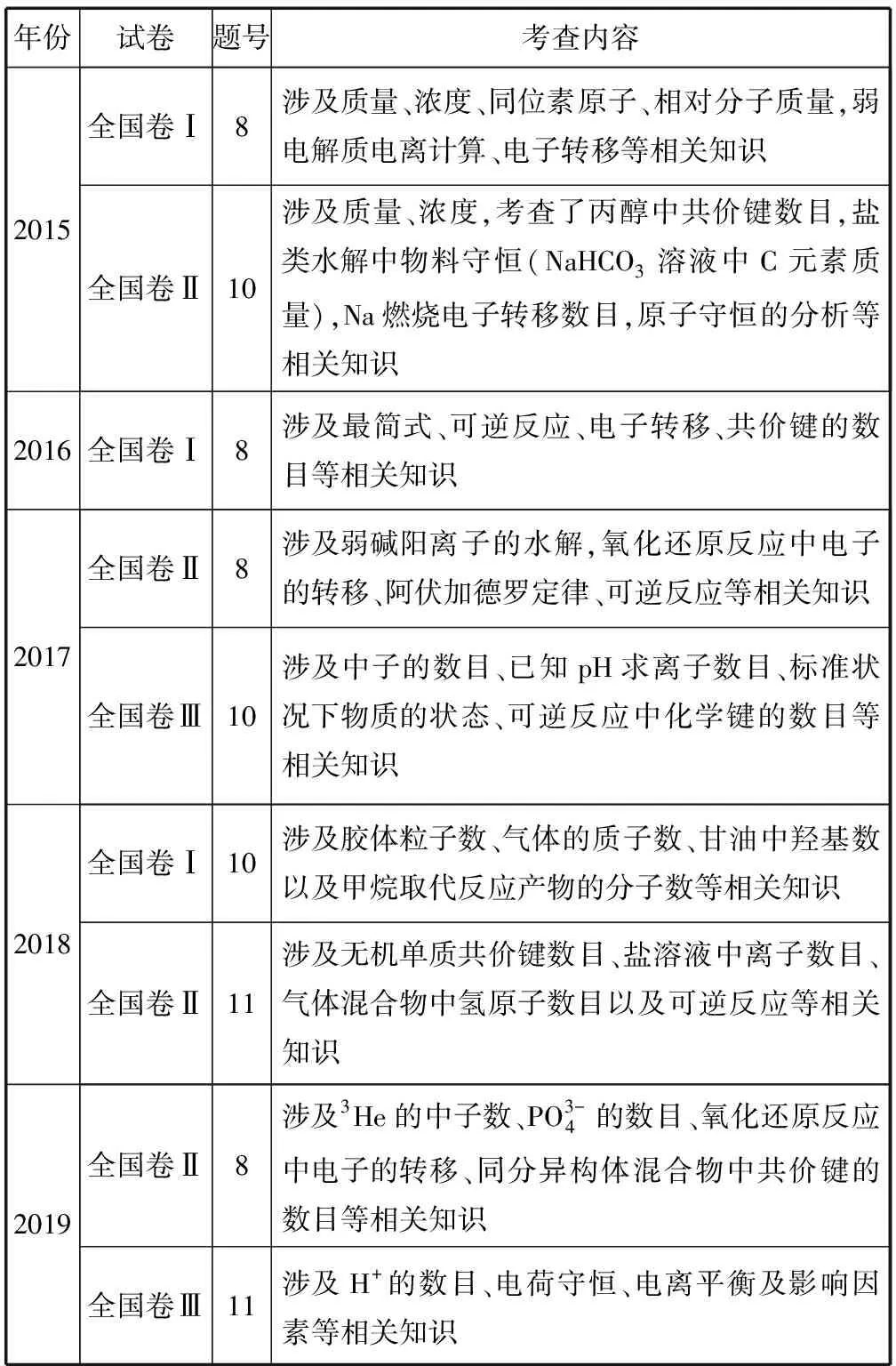
表1
2 關(guān)于阿伏加德羅常數(shù)的考查方式
通過對(duì)比近年高考理綜全國卷試題,不難發(fā)現(xiàn),圍繞阿伏加德羅常數(shù)的命題,主要基于以下5種方式,有的考查基本概念,有的突出考查基礎(chǔ)知識(shí),更多的是對(duì)考生的解題能力、閱讀能力、思維能力和應(yīng)變能力的考查.
2.1 考查考生對(duì)氣體摩爾體積概念的把握
1)關(guān)注氣體的狀況.
涉及與氣體的體積有關(guān)量計(jì)算時(shí),一定要注意題給的條件是不是標(biāo)準(zhǔn)狀況(0 ℃,1.01×105Pa).同時(shí),還要注意溫度和壓強(qiáng)影響氣體的體積,但不影響氣體的質(zhì)量和物質(zhì)的量,在考查物質(zhì)的量、質(zhì)量與微粒數(shù)目的關(guān)系時(shí),與氣體的狀況無關(guān).
2)關(guān)注物質(zhì)狀態(tài).
與氣體體積相關(guān)的運(yùn)算,必須考慮到相應(yīng)物質(zhì)在給定條件下的狀態(tài).

表2

A. (2018年全國卷Ⅰ·10B)22.4 L(標(biāo)準(zhǔn)狀況)氬氣含有的質(zhì)子數(shù)為18NA
B. (2016年全國卷Ⅰ·8D)標(biāo)準(zhǔn)狀況下,2.24 L CCl4含有的共價(jià)鍵數(shù)為0.4NA
C. (2017年全國卷Ⅲ·10C)2.24 L(標(biāo)準(zhǔn)狀況)苯在O2中完全燃燒,得到0.6NA個(gè)CO2分子
D. (2018年全國卷Ⅰ·10D)1.0 mol CH4與Cl2在光照下反應(yīng)生成的CH3Cl分子數(shù)為1.0NA

2.2 考查考生的審題能力
關(guān)于“NA”的命題,在選擇題的題干中往往會(huì)設(shè)下一些陷阱,以此考查考生的審題能力.在解題的過程中,需要注意以下幾個(gè)方面.

2) 物質(zhì)間發(fā)生反應(yīng)引起的體系組成變化.物質(zhì)間的變化具有一定的隱蔽性,有時(shí)需要借助方程式分析才能挖掘出隱含的變化情況.如“NO和O2的混合氣”,不但要考慮2NO(g)+O2(g)=2NO2(g),還應(yīng)考慮2NO2(g)N2O4(g)等.
3)計(jì)量條件不足而無法計(jì)算.如,題目中只給出物質(zhì)的量濃度,沒有給出體積,則無法計(jì)算出物質(zhì)的量,粒子數(shù)則無法計(jì)量.

A. (2018年全國卷Ⅱ·8D)密閉容器中,2 mol SO2和1 mol O2催化反應(yīng)后分子總數(shù)為2NA
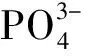
C. (2018年全國卷Ⅰ·10A)16.25 g FeCl3水解形成的Fe(OH)3膠體粒子數(shù)為0.1NA
D. (2017年全國卷Ⅱ·8D)0.1 mol H2和0.1 mol I2于密閉容器中充分反應(yīng)后,其分子總數(shù)為0.2NA

由于氫氧化鐵膠體粒子是分子的集合體,多個(gè)Fe(OH)3聚合為一個(gè)膠體粒子,水解生成的Fe(OH)3膠體粒子數(shù)小于0.1NA,選項(xiàng)C不正確;
H2(g)+I2(g)2HI(g),
反應(yīng)前后氣體物質(zhì)的量不變,選項(xiàng)D正確.答案為D.
2.3 考查考生的粒子觀
粒子觀是化學(xué)的最基本觀點(diǎn)之一,粒子的組成、結(jié)構(gòu)、粒子的區(qū)別、粒子的界定、粒子的存在形式等,都是考查的重點(diǎn).當(dāng)考查一定量的物質(zhì)中含有的微粒數(shù)(分子、原子、離子、質(zhì)子、中子、電子等)、電荷數(shù)之間的關(guān)系時(shí),一定要明確物質(zhì)的微觀結(jié)構(gòu)及組成,需注意以下問題.
1) 區(qū)別不同單質(zhì)的分子組成.
氣體單質(zhì)的組成除常見的雙原子分子(Cl2、O2、N2等)外,還有單原子分子(如稀有氣體Ne)、三原子分子(如O3)、四原子分子(如P4)、五原子分子(如CH4)等.
2) 把握具有相同最簡式物質(zhì)分子的關(guān)系.
如NO2與N2O4、乙烯與丙烯、乙炔與苯、乙酸與葡萄糖、兩種互為同分異構(gòu)體的物質(zhì)等,只要總質(zhì)量一定,則其中所含原子數(shù)與兩者比例無關(guān).
3) 注意不同核素的摩爾質(zhì)量不同.
要注意同位素原子中子數(shù)變化對(duì)質(zhì)量數(shù)變化的影響,核電荷數(shù)和核外電子數(shù)未發(fā)生變化.比如,重水(D2O)和H218O的摩爾質(zhì)量均為20 g·mol-1.
4) 掌握特殊物質(zhì)的原子團(tuán)結(jié)構(gòu).
常考的特殊物質(zhì)有Na2O2(陽離子與陰離子數(shù)目之比為2∶1),CaC2、BaO2(陽離子與陰離子數(shù)目之比為1∶1).

A. (2019年全國卷Ⅱ·8A)3 g3He含有的中子數(shù)為1NA
B. (2015年全國卷Ⅰ·8A)18 g D2O和18 g H2O中含有的質(zhì)子數(shù)均為10NA
C. (2018年全國卷Ⅱ·8C)標(biāo)準(zhǔn)狀況下,11.2 L甲烷和乙烯混合物中含氫原子數(shù)目為2NA
D. (2018年浙江4月選考·20A)10 g2H216O含有的質(zhì)子數(shù)與中子數(shù)均為5NA

0.5 mol×4×6.02×1023mol-1=2NA,
選項(xiàng)C說法正確;10 g2H216O的物質(zhì)的量為0.5 mol,含有的質(zhì)子數(shù)與中子數(shù)均為5NA,選項(xiàng)D說法正確.答案為B.
2.4 對(duì)特殊物質(zhì)中化學(xué)鍵數(shù)的考查
1) 常考無機(jī)物中的共價(jià)鍵數(shù)目.
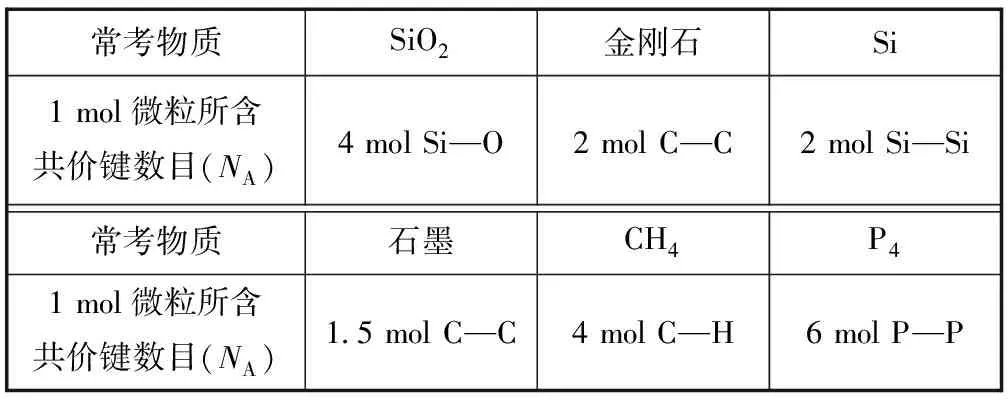
表3
2) 常考的有機(jī)物分子中的化學(xué)鍵.
a)烷烴(CnH2n+2)中, C—H鍵為2n+2(與H原子數(shù)相同),C—C鍵為n-1(比C原子數(shù)少1),總鍵數(shù)為3n+1;
b)烯烴或環(huán)烷烴(CnH2n)中,C—H 鍵為2n(與H原子數(shù)相同),C—C鍵(視雙鍵為2條單鍵)為n,總鍵數(shù)為3n;
c)炔烴(CnH2n-2) 中,C—H 鍵為 2n-2(與H原子數(shù)相同),C—C(視三鍵為3條單鍵)為n+1,總鍵數(shù)為3n-1.

A. (2016年全國卷Ⅰ·8D)標(biāo)準(zhǔn)狀況下,2.24 L CCl4含有的共價(jià)鍵數(shù)為0.4NA
B. (2015年全國卷Ⅱ·10A) 60 g丙醇中存在的共價(jià)鍵總數(shù)為10NA
C. (2018年全國卷Ⅱ·11A)常溫常壓下,124 g P4中所含P—P鍵數(shù)目為4NA
D. (2019年全國卷Ⅱ·8D)48 g正丁烷和10 g異丁烷的混合物中共價(jià)鍵數(shù)目為13NA

2.5 考查氧化還原反應(yīng)中電子的轉(zhuǎn)移數(shù)目
氧化還原反應(yīng)及電極反應(yīng)中,電子轉(zhuǎn)移與反應(yīng)物(生成物)之間存在定量關(guān)系.高頻考點(diǎn)有歧化反應(yīng)、歸中反應(yīng)、變價(jià)金屬(Fe、Cu等)參與的反應(yīng)等.常考反應(yīng)轉(zhuǎn)移的電子數(shù)如表4所示:
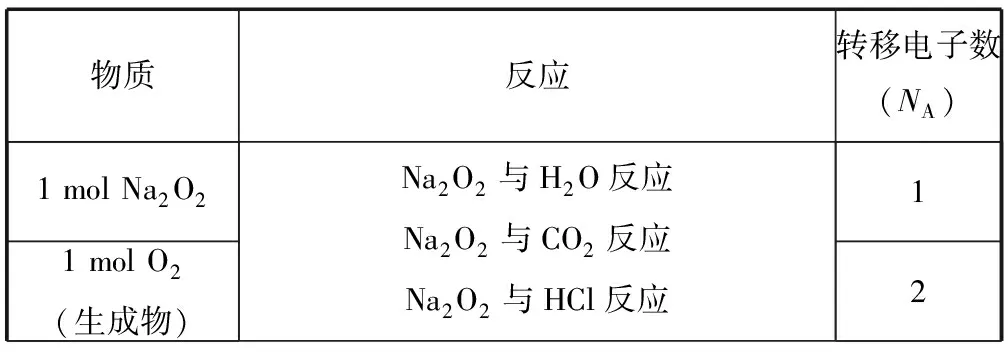
表4
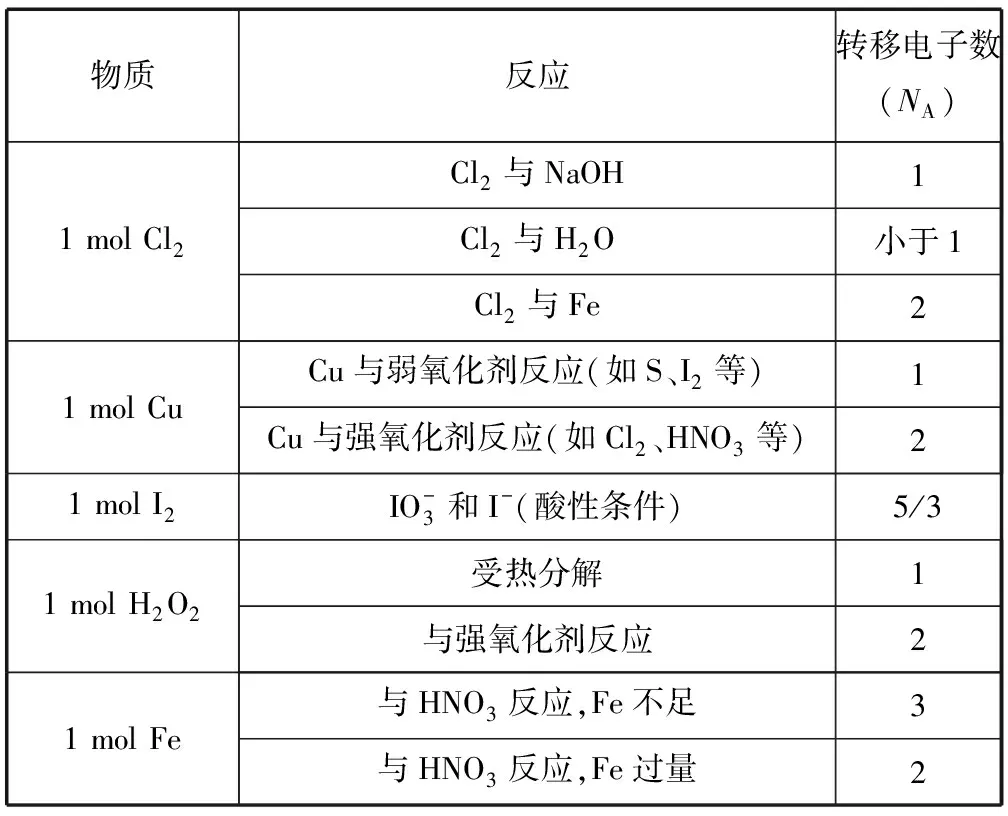
續(xù)表

A. (2015年全國卷Ⅰ·8C) 過氧化鈉與水反應(yīng)時(shí),生成0.1 mol氧氣轉(zhuǎn)移的電子數(shù)為0.2NA
B. (2017年全國卷Ⅱ·8B)2.4 g Mg與H2SO4完全反應(yīng),轉(zhuǎn)移的電子數(shù)為0.1NA
C. (2019年全國卷Ⅱ·8C)1 mol K2Cr2O7被還原為Cr3+轉(zhuǎn)移的電子數(shù)為6NA
D. (2016年全國卷Ⅰ·8C) 1 mol Fe溶于過量硝酸,電子轉(zhuǎn)移數(shù)為2NA

總之,近年全國卷對(duì)阿伏加德羅常數(shù)的考查比較全面,涉及化學(xué)基本理論、元素化合物知識(shí)、物質(zhì)結(jié)構(gòu)以及簡單化學(xué)計(jì)算,涉及的內(nèi)容多、知識(shí)包容性強(qiáng)、涵蓋范圍廣、能力要求高,要加強(qiáng)對(duì)基本知識(shí)的歸納總結(jié),在練習(xí)中不斷反思,在審題細(xì)節(jié)上下工夫,特別要注意試題中一些關(guān)鍵性的字眼,靈活運(yùn)用解題思維方法,才能有效提高解答與NA有關(guān)問題的能力.

