內源性神經營養因子促進冷凍保存大鼠坐骨神經異體移植后神經再生的作用
張松,黃英如,石一峰,劉云霄,冼華
1.重慶醫科大學中醫藥學院針灸骨傷教研室,重慶市 400016;2.中醫藥防治代謝性疾病重慶市重點實驗室,重慶市 400016
周圍神經損傷常引起支配區域運動和感覺功能缺失,致殘率高。近年來,隨著基因治療和組織工程等技術的發展,周圍神經損傷的治療取得長足的進步,但周圍神經缺損的修復與重建仍未取得突破[1-2]。自體神經移植是臨床修復周圍神經缺損(尤其是長段缺損)的金標準,但存在供區能滿足移植需要的神經有限、造成新的失神經損傷等缺點,限制了臨床應用。同種異體神經具有與自體神經相同的組織結構,可以為周圍神經缺損修復提供各種類型的神經移植物;而周圍神經冷凍保存,能夠為周圍神經缺損提供充足的、即時需要的各種類型的神經移植物,從而使同種異體神經代替自體神經修復周圍神經長段缺損成為可能[3-4]。
去細胞神經移植物可體外長期保存,具有較低的免疫原性,異體移植后能支持受者神經軸突再生[5-6]。施萬細胞是周圍神經的主要結構和功能細胞,能合成和分泌多種神經營養因子(neurotrophic factors,NTFs)和黏附分子,對周圍神經損傷后的神經再生極為重要[7]。去除施萬細胞的周圍神經,修復神經缺損特別是長段神經缺損后受者神經再生能力可能有限[8-9]。有學者在去細胞神經移植物中添加施萬細胞,異體移植后的神經再生和功能恢復明顯優于單純去細胞異體移植[10]。因此,周圍神經冷凍保存時維持施萬細胞的生物活性,對神經移植后的神經再生具有積極作用。我們的前期研究證實[11],周圍神經冷凍保存能維持施萬細胞的生物活性,異體移植后的排斥反應較弱,能支持移植后的神經再生。
內源性神經營養因子(endogenous neurotrophic factors,ENTFs)是一類調節神經元生長、存活和分化的多肽類物質,主要由施萬細胞合成和釋放,廣泛存在于動物體內多種組織中[12]。周圍神經損傷后,其遠端發生Wallerian變性,施萬細胞失去與軸突的連接,在轉錄因子c-Jun的作用下去分化,轉變為具有促再生表型的修復施萬細胞,分泌大量活性增強的ENTFs,從而修復受損神經元,加速軸突再生[13-15]。然而,在神經移植后的局部微環境中,由于施萬細胞分泌的NTFs濃度過低,可能不足以維持神經元胞體的存活和軸突再生,出現施萬細胞基底膜破壞,導致遠端軸突長入困難甚至移植失敗[16-17]。
本研究體外預處理大鼠坐骨神經,模擬周圍神經Wallerian變性,誘導施萬細胞表達ENTFs,并觀察施萬細胞的凋亡情況和免疫原性變化,然后將表達ENTFs的周圍神經冷凍保存,觀察冷凍保存后神經的生物活性,及同種異體移植后對神經再生的影響,以探討ENTFs促進冷凍保存周圍神經異體移植后神經再生的可能性。
1 材料與方法
1.1 實驗動物
SPF級雌性Sprague-Dawley大鼠138只,體質量(200±20) g,重慶醫科大學動物中心提供,動物生產許可證號SCXK(渝)2012-0001。SPF級雌性Wistar大鼠153只,體質量(200±20)g,成都達碩實驗動物有限公司提供,動物生產許可證號SCXK(川)2015-030。根據《醫學實驗動物管理實施細則》和重慶醫科大學醫學研究倫理委員會的要求,所用動物實驗研究均嚴格按照動物福利與倫理原則處理。12 h黑白交替,相對濕度為65%~75%,室溫22~24 ℃。
1.2 試劑與儀器
膠質細胞源性神經營養因子(glial cell line-derived neurotrophicfactor,GDNF)、神經生長因子(nerve growth factor,NGF)、主要組織相容性復合體(major histocompatibility complex,MHC)-Ⅱ、CD8單克隆抗體:美 國ABCAM公 司。Bcl-2、Bax、Caspase-3、MHC-Ⅰ單克隆抗體:美國AFFⅠNⅠTY公司。CD68單克隆抗體:美國NOVUS公司。β-actin單克隆抗體:北京博奧森生物技術有限公司。GAPDH單克隆抗體、山羊抗兔ⅠgG二抗、山羊抗鼠ⅠgG二抗:美國EARTHOX公司。神經絲(neurofilament,NF)200單 克隆抗體:武漢博士德生物工程有限公司。高糖型DMEM培養基、胎牛血清(fetal bovine serum,FBS)、DMSO:美國HYCLONE公司。雙抗(青霉素-鏈霉素):上海碧云天生物技術有限公司。海藻糖:北京索萊寶科技有限公司。乙二醇:成都市科龍化工試劑廠。triton X-100:北京鼎國昌盛生物技術有限責任公司。Calcein-AM:日本東仁化學科技有限公司。碘化丙啶(propidium iodide,PⅠ):武漢賽維爾生物科技有限公司。BCA蛋白濃度測定試劑盒:上海碧云天生物技術有限公司。大鼠白細胞介素(interleukin,ⅠL)-2、干擾素(interferon,ⅠFN)-γ、腫 瘤 壞 死 因 子(tumor necrosis factor,TNF)-α ELⅠSA試劑盒:上海滬尚生物科技有限公司。
電泳儀、凝膠成像系統:美國BⅠO-RAD公司。H-7500型透射電鏡:日本HⅠTACHⅠ公司。TCS-SP2型激光掃描共聚焦顯微鏡:德國LEⅠCA公司。BL-420N機能實驗系統:成都泰盟。BX53正置顯微鏡:日本OLYMPUS公司。低溫高速離心機:德國SⅠGMA公司。
1.3 動物造模與分組
1.3.1 坐骨神經取材及體外預處理
將138只Sprague-Dawley大鼠適應性喂養5 d后,隨機取12只備用(9只作為移植階段供體大鼠,3只用作凍存后新鮮神經對照組),余126只2%戊巴比妥鈉30 mg/kg腹腔注射麻醉,無菌條件下切取雙側坐骨神經段15 mm,0.9% NaCl注射液沖洗,切取神經后大鼠斷頸處死。隨機將252條坐骨神經置于含有10%FBS和1%青霉素-鏈霉素的高糖型DMEM預處理液中,37 ℃、5% CO2恒溫培養箱培養1 d (A組,n=42)、3 d (B組,n=42)、7 d (C組,n=42)、14 d (D組,n=42)和21 d(E組,n=42),每2天換液,設置新鮮神經對照組(F組,n=42)。
1.3.2 冷凍保存液配制、坐骨神經冷凍保存及復溫
在高糖型DMEM溶液(含0.2 mol/L海藻糖、10%FBS、1%青霉素-鏈霉素)中分別加入5%乙二醇和5%DMSO、10%乙二醇和10% DMSO、20%乙二醇和20%DMSO,配制成含5%、10%、20%冷凍保護劑的冷凍保存液。
將上述6組坐骨神經依次分別置于含5%、10%冷凍保護劑的冷凍保存液中室溫靜置各10 min,然后置于含20%冷凍保護劑的冷凍保存液中,4 ℃放置30 min,-20 ℃放置1 h,-80 ℃放置1 h,最后將其置于液氮中保存4周。
坐骨神經在液氮中保存4周后,置于37 ℃水浴鍋中復溫3 min,然后依次置于含10%、5%冷凍保護劑的冷凍保存液中各10 min,最后置于高糖型DMEM溶液(含10%FBS和1%青霉素-鏈霉素)中。
1.3.3 移植術受體分組及手術方法
健康成年SPF級雌性Wistar大鼠153只,其中144只作為受體大鼠,9只作為供體大鼠。另取上述9只Sprague-Dawley大鼠為供體大鼠。用上述冷凍保存后的A組、B組、C組、D組、E組、F組坐骨神經(每組取18條)和9只Sprague-Dawley大鼠新鮮坐骨神經(G組,n=18)修復對應Wistar大鼠(A′組、B′組、C′組、D′組、E′組、F′組、G′組)坐骨神經10 mm缺損,設置Wistar大鼠同系移植對照組(H′組),每組18只。
手法方法:受體大鼠術前禁食12 h,2%戊巴比妥鈉30 mg/kg腹腔注射麻醉,剃毛,常規消毒、鋪巾,于右股后外側行斜行切口,沿肌間隙鈍性分離,暴露、游離坐骨神經干,于梨狀肌下緣5 mm處整齊切除坐骨神經造成10 mm缺損;將供體神經段整齊修剪至10 mm,6倍手術顯微鏡下,以9-0帶線縫合針行神經外膜無張力間斷縫合4~6針,0.9%氯化鈉注射液沖洗術區,4-0縫合線逐層縫合,麻醉蘇醒后按組分籠飼養。手術均由同一人操作完成,術后大鼠均不做特殊處理。
1.4 檢測指標
1.4.1 Western blotting
冷凍保存前,取各組神經組織約30 mg (從18條坐骨神經中取出),剪碎,加入10 ml/kg裂解液,冰上裂解15 min,勻漿后4 ℃靜置1 h,4 ℃、12 000 r/min離心15 min,取上清,BCA蛋白濃度測定試劑盒檢測濃度。
上樣量100 μg,12% SDS-PAGE凝膠電泳,70 V電泳30 min后100 V電泳80 min,恒流300 mA轉膜90 min至PVDF膜上,5%脫脂牛奶室溫封閉2 h,TBST洗膜,加一抗(GDNF 1∶5000;NGF 1∶10000;Bcl-2 1∶1000;Bax 1∶1000;Caspase-3 1∶1000;βactin 1∶5000;MHC-Ⅰ1∶2000;MHC-Ⅱ1∶1000;GAPDH 1∶5000)4 ℃孵育過夜,TBST洗膜,加相應二 抗(山羊抗兔ⅠgG 1∶10000;山羊抗鼠ⅠgG 1∶10000)室溫孵育2 h,TBST洗膜,ECL顯色,凝膠成像系統成像,GDNF、NGF、Bcl-2、Bax、Caspase-3以β-actin為內參,MHC-Ⅰ、MHC-Ⅱ以GAPDH為內參;用Ⅰmage J軟件進行定量分析,分別用目的蛋白與內參蛋白的灰度值比值表示蛋白的相對表達量。生物學重復6次。
1.4.2 冷凍保存后坐骨神經生物活性
Calcein-AM/Propidium Ⅰodide熒光染色,激光共聚焦顯微鏡觀察冷凍保存后坐骨神經細胞存活與死亡情況。取上述冷凍保存4周后未用于移植的坐骨神經,每組6條,復溫,另取上述備用3只Sprague-Dawley大鼠,切取坐骨神經6條作為新鮮神經對照組(G組),剪切成長3 mm神經段,室溫下1% triton X-100通透30 min,PBS緩沖液沖洗,Calcein-AM 20 μmol/L避光孵育30 min,PBS緩 沖液沖洗,Propidium Ⅰodide 100 μg/ml避光孵育15 min,PBS緩沖液避光沖洗,防熒光淬滅甘油封片,激光共聚焦顯微鏡觀察熒光強度,激發波長490 nm (綠色熒光)和535 nm (紅色熒光),活細胞呈綠色熒光,死細胞呈紅色熒光。
1.4.3 移植后一般情況
觀察移植后大鼠術口愈合、足趾潰瘍、移植側肌肉萎縮情況,取材時觀察移植神經斷端吻合情況及粘連情況。
1.4.4 移植術后免疫排斥反應
移植術后1周,每組選取6只大鼠,2%戊巴比妥鈉30 mg/kg腹腔注射麻醉,于右股后外側原切口進入,沿肌間隙鈍性分離,暴露、分離移植側坐骨神經段,切取移植神經段8 mm,4%多聚甲醛固定,梯度乙醇脫水,常規石蠟包埋,縱切5 μm;脫蠟后,PBS緩沖液沖洗5 min×4次,山羊血清37 ℃封閉1 h,加一抗(CD81∶100;CD681∶100)孵育過夜,PBS緩沖液沖洗5 min,共4次,加相應熒光二抗37 ℃避光孵育1 h,PBS緩沖液避光沖洗5 min,共4次,滴加防熒光淬滅甘油封片,熒光顯微鏡下觀察拍照。
移植術后1周,上述大鼠截取移植神經段后,心臟取血,室溫下靜置20 min后,3000 r/min離心20 min,取上清,ELⅠSA檢測ⅠL-2、ⅠFN-γ、TNF-α水平。
1.4.5 移植術后電生理檢測
移植術后20周,每組取6只大鼠,2%戊巴比妥鈉30 mg/kg腹腔注射麻醉,于右股后外側原切口進入,沿肌間隙鈍性分離,暴露、分離移植坐骨神經段,于梨狀肌下緣3 mm處神經干放置刺激電極,同側外踝關節上10 mm腓腸肌上放置接收電極,地線遠離兩電極接地,刺激電流4 mA,刺激頻率1 Hz。用BL-420N生物信號采集與分析系統測定肌肉復合動作電位(compound muscle action potential,CMAP)和神經傳導速度(nerve conduction velocity,NCV)。
1.4.6 移植術后腓腸肌肌肉濕重比
電生理檢測后,完整剝離上述大鼠雙側腓腸肌,吸干其表面殘留液體并稱重,以自身非移植側作為對照,計算移植術后各組腓腸肌濕重比。

1.4.7 移植術后再生神經NF200免疫熒光染色
電生理檢測后,切取上述大鼠移植神經段8 mm,按照上述免疫熒光染色法(一抗NF200 1∶100),熒光顯微鏡觀察移植神經NF200熒光強度。
1.4.8 移植術后再生神經組織學分析
移植術后20周,每組取6只大鼠,切取大鼠移植神經段8 mm,2%戊二醛4 ℃固定過夜,1%鋨酸固定2 h,梯度丙酮脫水,環氧樹脂包埋。半薄切片,甲苯胺藍染色,CCD光譜測量系統,每個樣本隨機選5張切片,每張切片隨機取5個視野,采用Ⅰmage-Pro Plus 6.0分析再生有髓神經纖維數量;每組選取兩個樣本,超薄切片、醋酸鈾-檸檬酸鉛雙重染色,透射電鏡觀察再生神經超微結構,Ⅰmage-Pro Plus 6.0計算再生神經髓鞘厚度。
1.5 統計學分析
2 結果
2.1 Western blotting
GDNF蛋白表達從高到低依次為:D組、C組/E組、A組(P<0.05);C組、D組和E組與F組比較均有顯著性差異(P<0.05)。NGF蛋白表達從高到低依次為:D組、C組、E組、A組(P<0.05);C組、D組和E組與F組比較均有顯著性差異(P<0.05)。見圖1、表1。
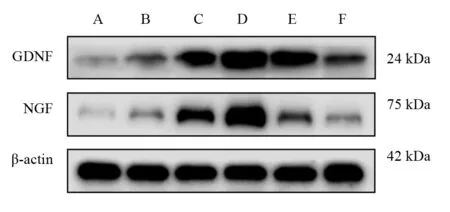
圖1 各預處理組坐骨神經GDNF、NGF蛋白表達
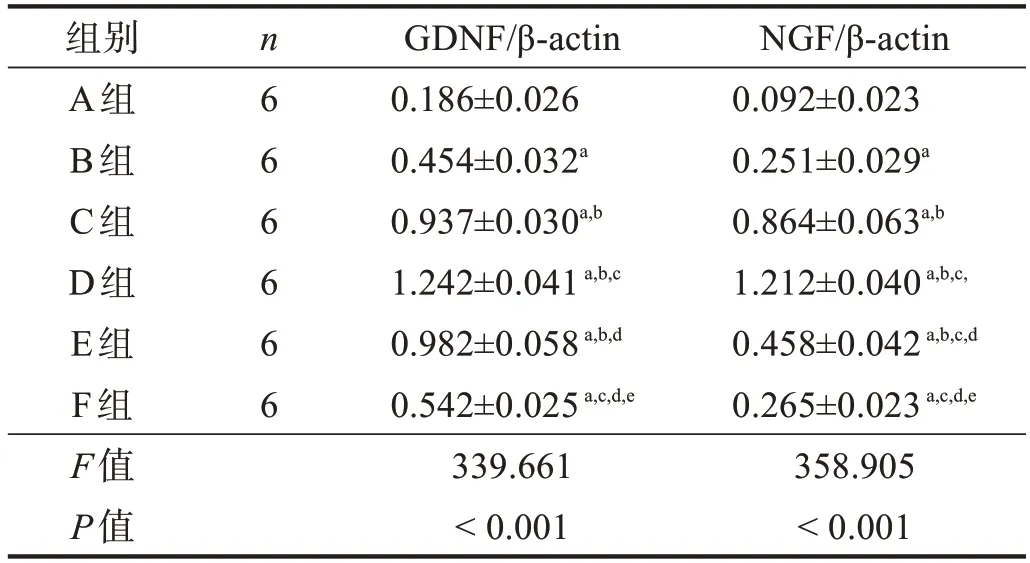
表1 各預處理組坐骨神經GDNF、NGF蛋白表達
Bax蛋白表達從高到低依次為:E組、C組/D組、A組/B組(P<0.05);與F組相比,B組、C組、D組和E組表達均增加(P<0.05),A組與F組比較無顯著性差異(P >0.05)。Bcl-2蛋白表達從低到高依次為:D組/E組、C組、A組/B組(P<0.05);與F組相比,B組、C組、D組和E組表達下降(P<0.05),A組與F組比較無顯著性差異(P >0.05)。Bax/Bcl-2比值與Bax蛋白表達趨勢基本一致。Caspase-3蛋白表達從高到低依次為:D組/E組、B組/C組、A組(P<0.05);與F組相比,B組、C組、D組和E組表達增加(P<0.05),A組與F組比較無顯著性差異(P >0.05)。見圖2、表2。
在預處理組中,MHC-Ⅰ表達從低到高依次為D組/E組、B組/C組、A組(P<0.05);MHC-Ⅱ表達則為E組、D組、A組/B組(P<0.05)。與F組相比,A組~E組MHC-Ⅰ、MHC-Ⅱ蛋白表達均下降(P<0.05)。見圖3、表3。
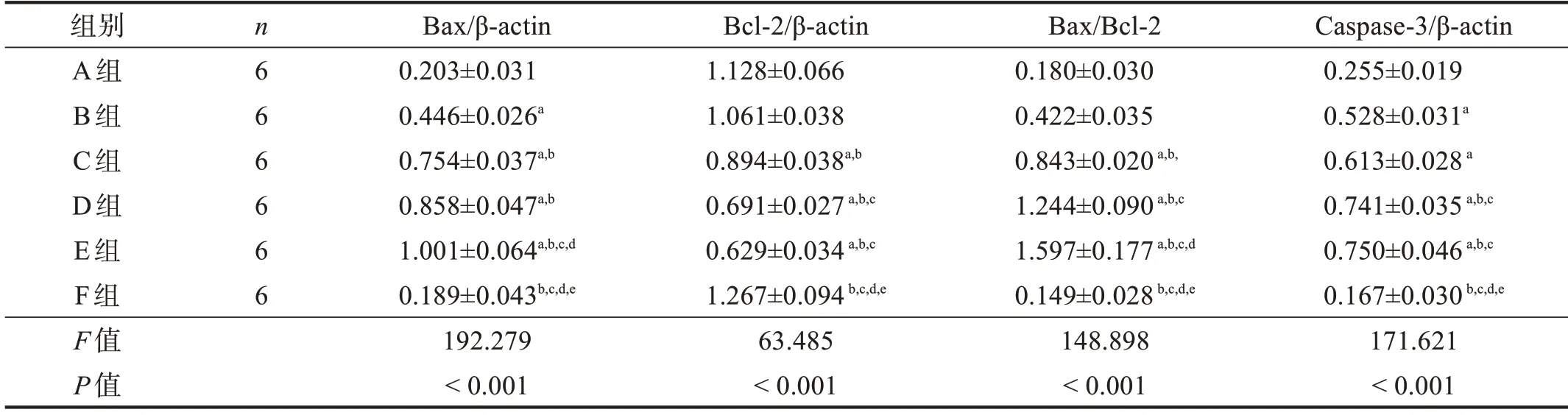
表2 各預處理組坐骨神經Bcl-2、Bax、Caspase-3蛋白表達
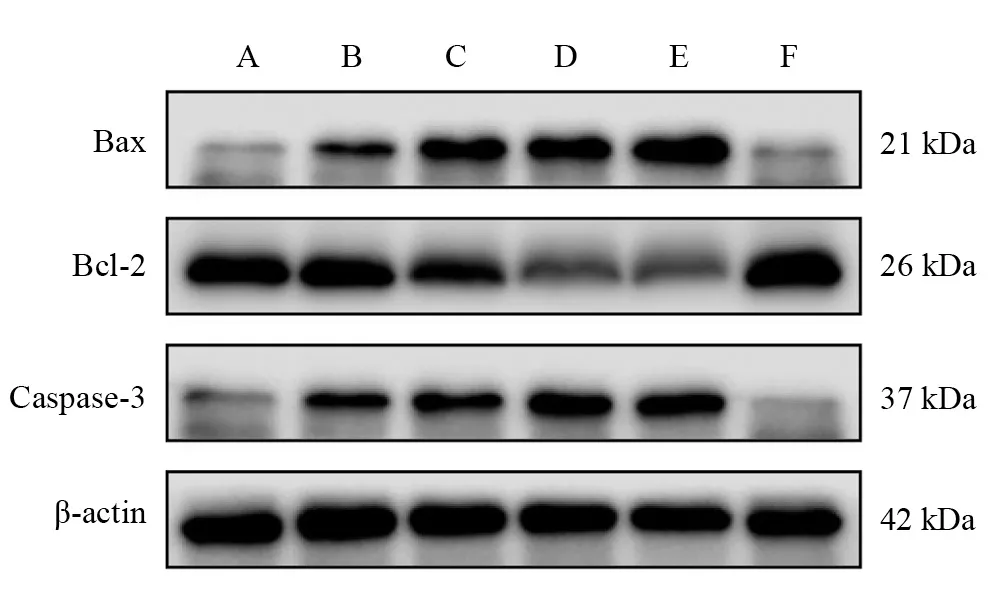
圖2 各預處理組坐骨神經Bcl-2、Bax、Caspase-3蛋白表達
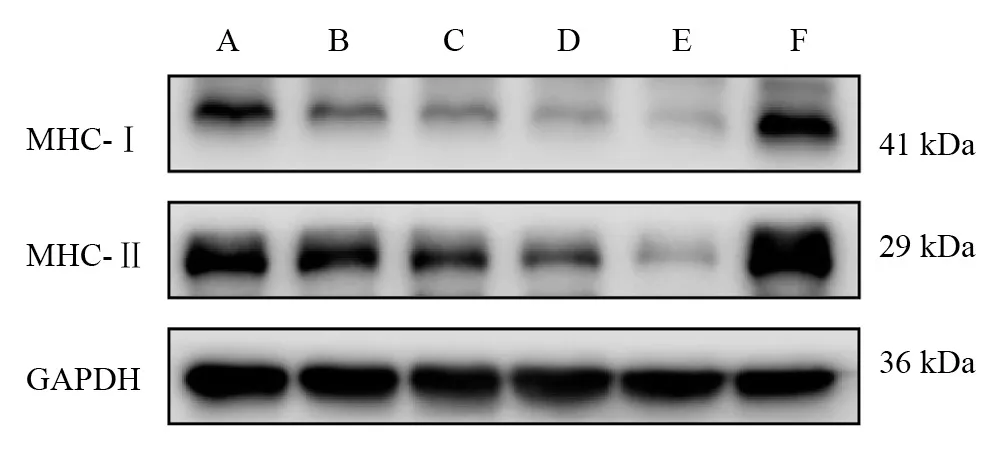
圖3 各預處理組坐骨神經MHC-Ⅰ、MHC-Ⅱ蛋白表達
2.2 冷凍保存坐骨神經細胞生物活性
G組神經纖維綠色熒光強、分布廣泛,可見零星紅色熒光分布。A組~F組仍可見神經纖維綠色熒光,但熒光強度較G組弱,紅色熒光較G組多。與F組相比,A組~E組綠色熒光強度減弱,紅色熒光強度增強,其中,A組綠色熒光強度最強,紅色熒光強度最低,B組次之,C組、D組和E組最差。見圖4。
2.3 同種異體神經移植后檢測
2.3.1 移植后一般情況
實驗期間大鼠無死亡,術后傷口無感染和壞死。同種異體移植術后1周,各組移植神經段稍腫脹,與周圍組織無粘連。移植術后3周,各組右下肢肌肉出現不同程度的萎縮,除H′組外,其余各組(A′組4只、B′組4只、C′組3只、D′組2只、E′組2只、F′組5只、G′組5只)移植側出現足趾紅腫、潰瘍、缺失等改變,術后8~10周以后潰瘍陸續愈合。移植術后20周,各組移植神經段與周圍組織均出現不同程度粘連,G′組粘連最重,F′組次之,H′組最輕,遠近端吻合口稍膨大,無神經瘤形成。
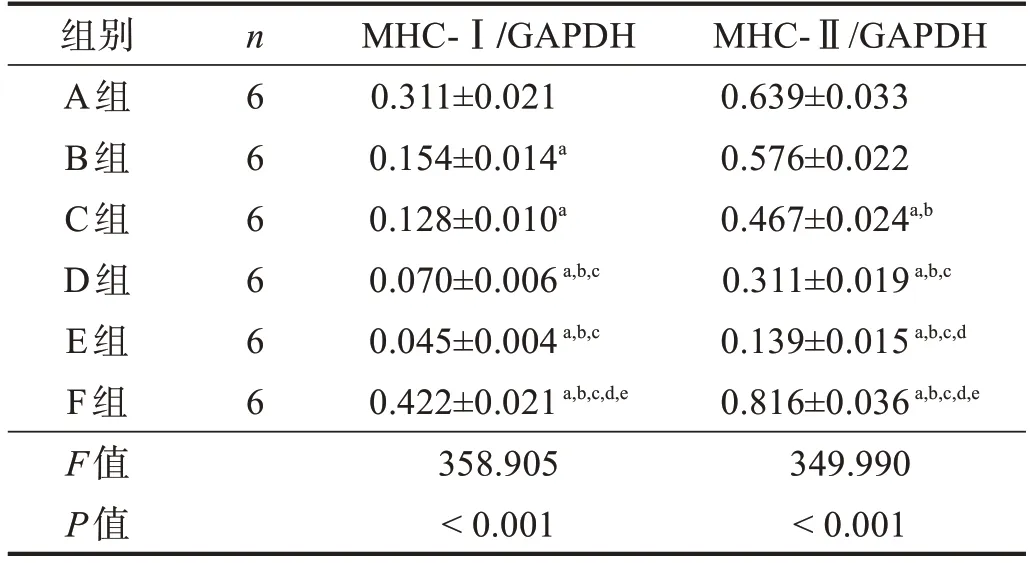
表3 各預處理組坐骨神經MHC-Ⅰ、MHC-Ⅱ蛋白表達
2.3.2 免疫排斥反應
移植術后1周,H′組血清中ⅠL-2、ⅠFN-γ、TNF-α水平較低,G′組較高。與G′組相比,C′組、D′組、E′組ⅠL-2、ⅠFN-γ、TNF-α水平降低(P <0.05)。與F′組相比,C′組、D′組、E′組ⅠL-2水平降低(P <0.05),E′組ⅠFN-γ 水平降低(P <0.05),C′組、D′組、E′組TNF-α水平降低(P <0.05),其他組間比較均無顯著性差異(P >0.05)。在各預處理冷凍保存移植組中,D′組、E′組ⅠL-2水平較低,A′組、B′組、C′組較高(P <0.05);各組間ⅠFN-γ 水平無顯著性差異(P >0.05);D′組、E′組TNF-α 水平最低,C′組次之,A′、B′組最高(P <0.05)。見表4。
2.3.3 電生理檢測
H′組CMAP、NCV較優,G′組和F′組較差,但D′組、H′組間和F′組、G′組間均無顯著性差異(P >0.05)。與F′組相比,B′組、C′組、D′組和E′組CMAP、NCV較優(P <0.05),A′組與F′組間無顯著性差異(P >0.05);在預處理冷凍保存移植組中,D′組CMAP、NCV最優,C′組和E′組次之,A′組和B′組最差(P <0.05)。見圖7、表5。
2.3.4 腓腸肌肌肉濕重比
H′組腓腸肌濕重比較高,G′組和F′組較低,但D′組與H′組間和F′組與G′組間均無顯著性差異(P >0.05)。與F′組相比,C′組、D′組和E′組腓腸肌濕重比較高(P <0.05),但A′組、B′組、F′組間無顯著性差異(P >0.05);在預處理冷凍保存移植組中,D′組腓腸肌濕重比最高,C′組、E′組次之,A′組、B′組最差(P <0.05)。見表6。
2.3.5 再生神經NF200
H′組綠色熒光強度最高、分布均勻,G′組熒光強度最低、散在分布。與H′組相比,A′組~F′組綠色熒光較弱。與F′組相比,A′組~E′組綠色熒光較強;在各預處理冷凍保存移植組中,D′組綠色熒光強度最高、分布均勻,C′組次之,A′組和B′組最差。見圖8。
2.3.6 再生神經組織學分析
H′組有髓神經纖維數最優,G′組最差,但D′組和H′組間無顯著性差異(P >0.05)。與F′組相比,B′組、C′組、D′組和E′組有髓神經纖維數較多(P <0.05),但A′組與F′組間無顯著性差異(P >0.05)。在各預處理冷凍保存移植組中,D′組有髓神經纖維數最多、分布均勻,C′組和E′組次之,A′組和B′組最差(P <0.05)。見圖9、表7。
H′組和D′組可見大量有髓神經纖維,纖維粗細均勻,髓鞘厚;C′組和E′組再生有髓神經纖維數量較多,分布廣泛、髓鞘較厚;A′組和B′組再生有髓神經纖維數量較少,分布較廣泛,髓鞘較薄;G′組再生有髓神經纖維數量少,直徑細,髓鞘薄,分布稀疏。H′組有髓神經纖髓鞘厚度最優,G′組最差,但D′組與H′組間無顯著性差異(P >0.05)。與F′組相比,B′組、C′組、D′組和E′組有髓神經纖髓鞘厚度較優(P <0.05),但A′組與F′組間無顯著性差異(P >0.05)。在各預處理冷凍保存移植組中,D′組有髓神經纖髓鞘厚度最優,C′組和E′組次之,A′組和B′最差(P <0.05)。見圖10、表7。
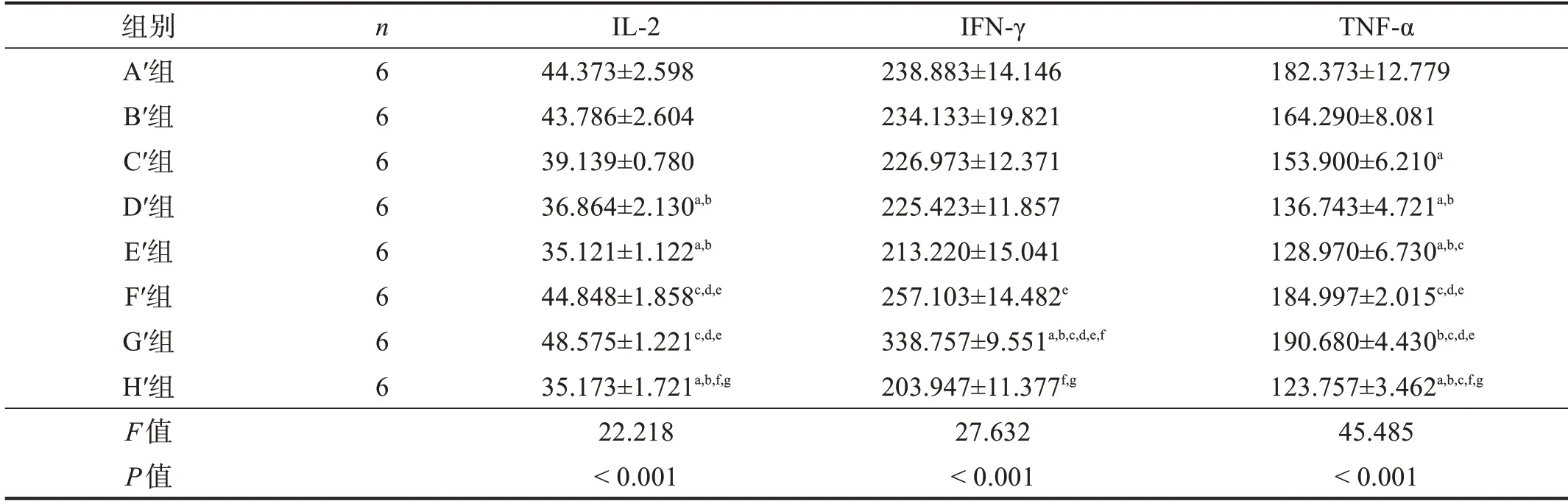
表4 移植術后1周,各組血清IL-2、IFN-γ、TNF-α水平(ng/L)
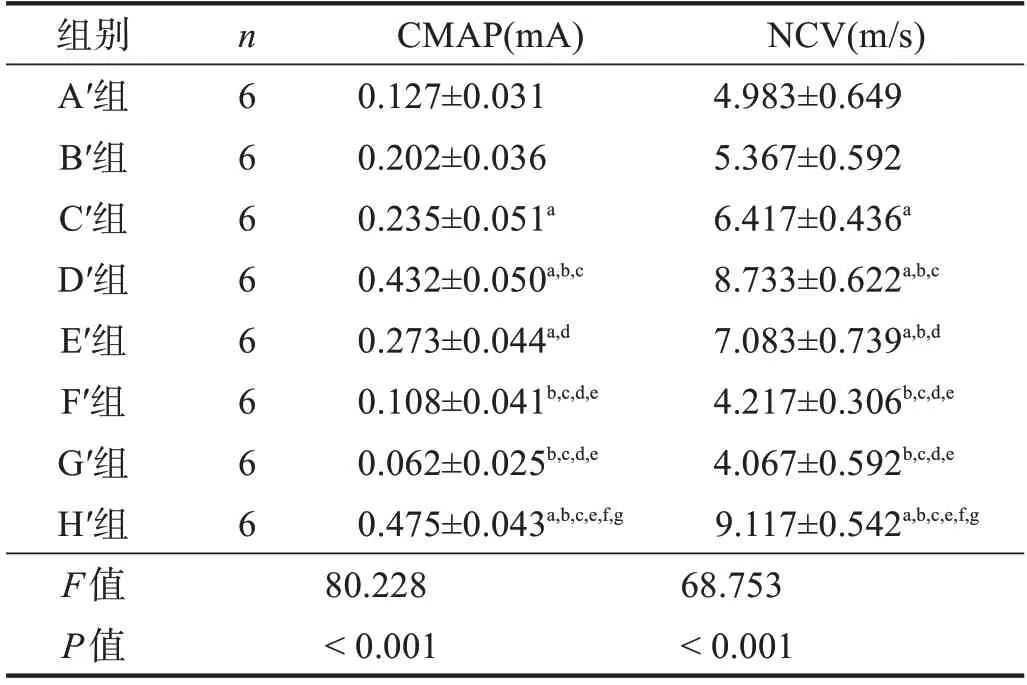
表5 移植術后20周各組CMAP和NCV比較
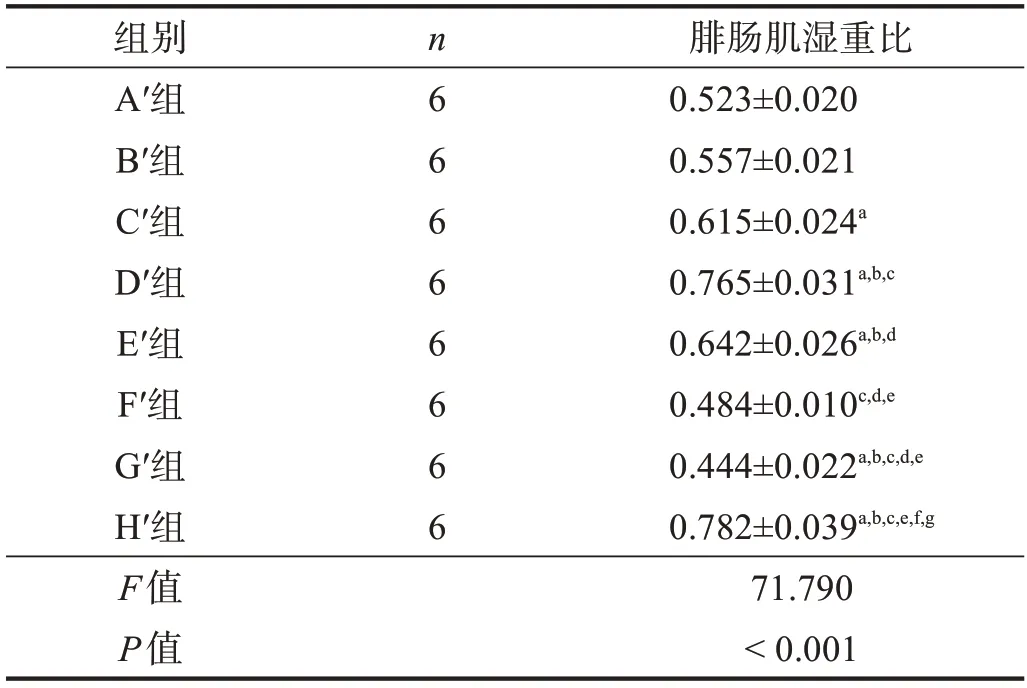
表6 移植術后20周各組腓腸肌濕重比
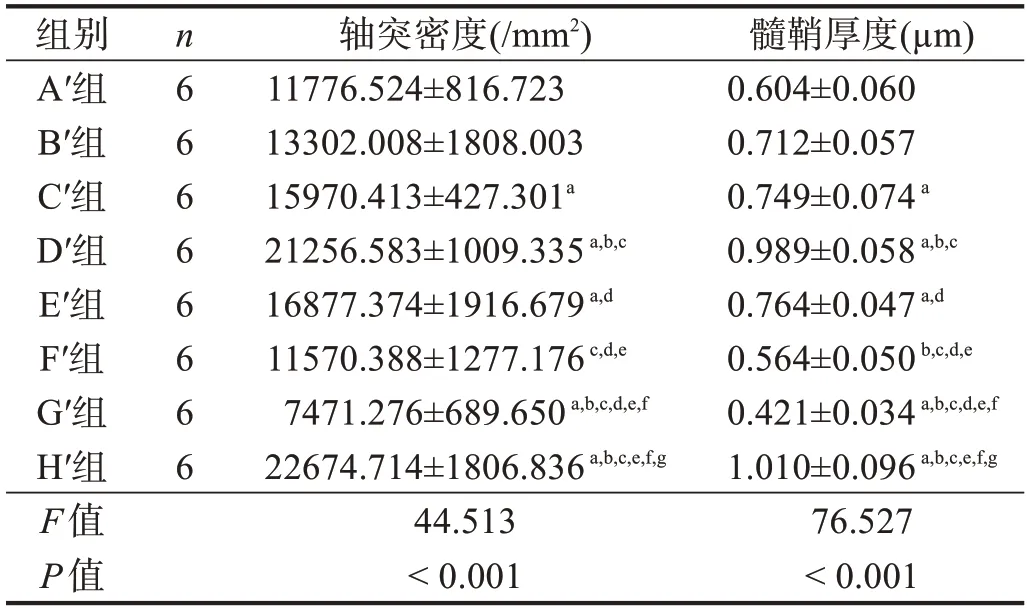
表7 移植術后20周各組軸突密度與髓鞘厚度比較
3 討論
自體神經移植因來源有限、供區并發癥等缺點,不能滿足臨床對周圍神經缺損,尤其是長段缺損修復的需要。同種異體神經具有與自體神經相同的組織結構,可能是自體神經理想的替代物。周圍神經冷凍保存可以為臨床提供神經缺損修復所需要的神經移植物,從而使同種異體神經代替自體神經修復周圍神經長段缺損成為可能[3-4]。
去細胞神經具有低免疫原性,同時神經內部的三維支架結構和細胞外基質的活性成分得以保持,并且可以體外長期保存,異體移植后能支持受者神經軸突再生[5-6]。有學者在去細胞神經移植物中添加NTF,移植后的神經再生優于單純去細胞異體神經移植[18]。然而,NTFs半衰期短,如何在去細胞移植物中長期穩定釋放是運用的難點[19-20]。運用控釋技術將GDNF復合到去細胞神經移植物中,GDNF的長期持續釋放促進移植后的神經再生和功能恢復[21]。因此,NTFs的持久釋放對周圍神經長段缺損修復后的軸突再生尤為重要。
施萬細胞是周圍神經的主要結構和功能細胞,能合成和分泌多種NTFs和黏附分子,對周圍神經損傷后的神經再生具有非常重要的作用[7]。有研究證實,在去細胞的神經移植物中添加施萬細胞,術后受體神經再生明顯優于單純去細胞異體神經移植[10]。因此,周圍神經冷凍保存時維持施萬細胞的生物活性,對神經移植后的神經再生具有積極作用。我們的前期研究發現,周圍神經冷凍保存能維持施萬細胞的生物活性,異體移植后的排斥反應較弱,能支持移植后的神經再生[11]。
本研究體外預處理大鼠坐骨神經,體外模擬周圍神經Wallerian變性,誘導施萬細胞表達ENTFs,然后將表達ENTFs的周圍神經冷凍保存,最后將冷凍保存后的神經進行同種異體移植,結果發現,體外預處理大鼠坐骨神經能誘導其施萬細胞表達ENTFs;高表達ENTFs的坐骨神經Bcl-2表達下降,Bax、Caspase-3表達增加,Bax/Bcl-2比值增高,MHC-Ⅰ、MHC-Ⅱ表達下降;高表達ENTFs的坐骨神經冷凍保存4周后,雖然存活施萬細胞數量減少,但同種異體移植后免疫反應較弱,能促進移植后受者神經再生和功能恢復。

圖4 各組坐骨神經比較(Calcein-AM/Propidium Ⅰodide染色,激光共聚焦顯微鏡,×400,bar=50μm)
ENTFs主要由施萬細胞合成和釋放,施萬細胞作為周圍神經的主要結構和功能細胞,在生理條件下經逆向運輸ENTFs至神經元胞體,提供營養支持,促進神經元成熟、分化[22];周圍神經損傷后,軸突、髓鞘崩解,其遠端發生Wallerian變性,施萬細胞在轉錄因子c-Jun的作用下去分化,轉變為具有促再生表型的修復施萬細胞,釋放大量ENTFs,如GDNF、NGF等,這些ENTFs在周圍神經損傷后對施萬細胞的存活、軸突的生長和走向起著十分重要的營養和誘導作用[23-24]。GDNF能促進運動神經元的存活[25];NGF能促進感覺神經元的存活[26]。然而,在同種異體神經移植后的局部微環境中,由于施萬細胞分泌的NTFs濃度過低,可能不足以維持神經元胞體的存活和軸突再生,出現施萬細胞基底膜破壞,導致遠端軸突長入困難甚至移植失敗[16-17]。因此,促進周圍神經施萬細胞分泌ENTFs可能會改善神經異體移植后的軸突再生和功能恢復。

圖5 移植術后1周A′~D′組移植神經段CD8+T細胞、巨噬細胞入侵情況(免疫熒光染色,×200)
本研究通過體外預處理大鼠坐骨神經不同時間,模擬周圍神經Wallerian變性,誘導其施萬細胞表達ENTFs,結果顯示,體外預處理7 d以上可促進坐骨神經ENTFs表達,以14 d效果最佳。隨后將預處理后表達ENTFs的坐骨神經冷凍保存4周,同種異體移植修復坐骨神經缺損,結果顯示,表達ENTFs的坐骨神經再生有髓神經纖維數量多、髓鞘厚,CMAP高,NCV快,以預處理14 d效果最佳。
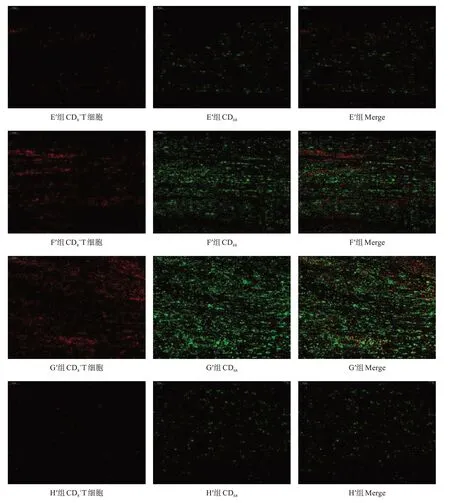
圖6 移植術后1周E′~H′組移植神經段CD8+T細胞、巨噬細胞入侵情況(免疫熒光染色,×200)
ENTFs主要由施萬細胞合成和釋放,施萬細胞的存活情況在一定程度上決定損傷周圍神經的再生潛能。細胞凋亡的發生是在多種凋亡相關基因的調控下進行的,Bcl-2、Bax與神經元的存活關系密切,二者之間的比值決定細胞是凋亡還是存活[27];而Caspase-3的激活在神經元凋亡中起著極其重要的作用,被認為是細胞死亡前的終末事件[28-29]。
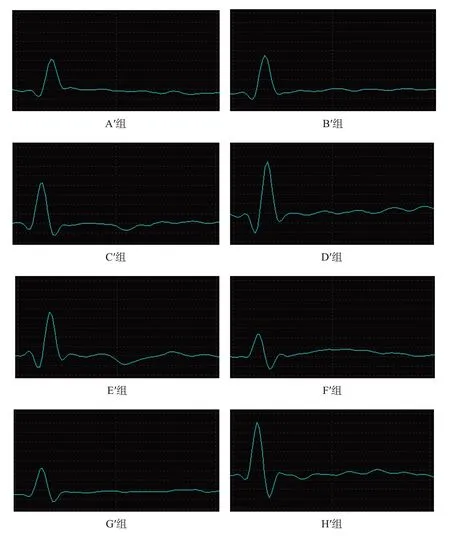
圖7 移植術后20周各組CMAP波形
本研究檢測預處理神經Bcl-2、Bax蛋白表達,結果顯示:與新鮮神經對照組(F組)相比,坐骨神經預處理組中7 d組、14 d組和21 d組Bcl-2表達下降,Bax表達增強,Bax/Bcl-2比值升高。同時,我們還檢測Caspase-3蛋白表達,與新鮮神經對照組(F組)相比,坐骨神經預處理組中7 d組、14 d組和21 d組Caspase-3表達也增強,這與Bax表達、Bax/Bcl-2比值結果一致。將預處理坐骨神經冷凍保存4周后,Calcein-AM/Propidium Ⅰodide熒光染色觀察保存后神經的細胞存活情況,結果顯示,與新鮮神經冷凍保存組(F組)、新鮮神經組(G組)相比,各預處理冷凍保存組神經纖維綠色熒光(代表活細胞)減弱,紅色熒光(代表死細胞)增強;在預處理冷凍保存組中,1 d組綠色熒光強度最強,紅色熒光強度最低,3 d組次之,7 d組、14 d組、21 d組最差。這與預處理神經施萬細胞凋亡情況一致。這些結果表明,預處理時間將影響坐骨神經施萬細胞的存活。
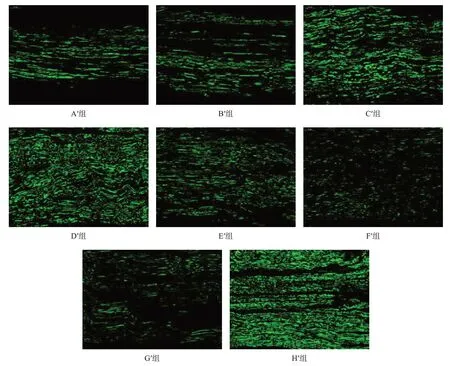
圖8 移植術后20周各組移植神經段再生神經NF200(免疫熒光染色,×400)
免疫排斥反應是異體組織器官移植成功的關鍵。異體組織器官移植后的免疫反應包括體液免疫反應和細胞免疫反應。目前認為細胞免疫應答是同種異體神經移植產生免疫排斥反應的主要機制,T細胞和T細胞是主要的效應細胞[30]。活化的T細胞通過釋放ⅠL-2、ⅠFN-γ 和TNF-α 等炎性細胞因子募集和活化巨噬細胞,引起宿主炎性細胞浸潤和移植組織損傷[31];而T細胞則可通過分泌穿孔素、顆粒酶等物質直接殺傷宿主靶細胞[32-33]。在移植免疫反應中,T細胞識別MHC-ⅠⅠ分子,而T細胞識別MHC-Ⅰ分子[34],移植物MHC-Ⅰ、MHC-ⅠⅠ水平的高低在很大程度上決定移植后排斥反應的強弱[35]。施萬細胞作為周圍神經的抗原提呈細胞(antigen-presenting cell,APC),除了具有表達MHC-Ⅰ類分子外,還具有表達MHC-ⅠⅠ類分子的能力,是異體神經移植后出現免疫排斥反應的主要原因[36]。
本研究檢測預處理神經MHC-Ⅰ、MHC-Ⅱ分子表達,結果顯示:各預處理組神經的MHC-Ⅰ、MHC-Ⅱ蛋白表達均低于新鮮神經對照組(F組),表明預處理后的周圍神經具有較低的免疫原性,這些神經在冷凍保存后可能對減輕神經異體移植后的排斥反應具有重要的作用。同時,本研究還檢測Bcl-2、Bax和Caspase-3蛋白表達,結果顯示:預處理組中7 d組、14 d組和21 d組Bcl-2表達降低,Bax、Caspase-3表達均增加。預處理神經的MHC-Ⅰ、MHC-Ⅱ蛋白表達下降可能與預處理過程中施萬細胞凋亡增加有關。隨后,將預處理后表達ENTFs的坐骨神經冷凍保存4周,預處理組中7 d組、14 d組和21 d組神經的活細胞明顯低于新鮮神經冷凍保存組(F組)和新鮮神經組(G組),這與預處理階段各組施萬細胞凋亡情況一致。最后,本研究觀察預處理冷凍保存的坐骨神經異體移植后排斥反應和受者神經再生情況,結果顯示:移植術后1周,與新鮮神經冷凍保存移植組(F′組)、同種異體新鮮移植組(G′組)相比,預處理冷凍保存移植組(A′~E′組)移植物中T細胞、巨噬細胞入侵及受者血清ⅠL-2、ⅠFN-γ、TNF-α水平較低,尤其是7 d移植組、14 d移植組和21 d移植組更低;移植術后20周,預處理冷凍保存移植組中7 d移植組、14 d移植組和21 d移植組受者神經再生和功能恢復優于新鮮神經冷凍保存移植組(F′組)和同種異體新鮮移植組(G′組)。這些結果說明,冷凍保存后的具有較低免疫原性的預處理神經,異體移植后受者排斥反應降低,促進了移植后受者神經的再生和功能恢復。
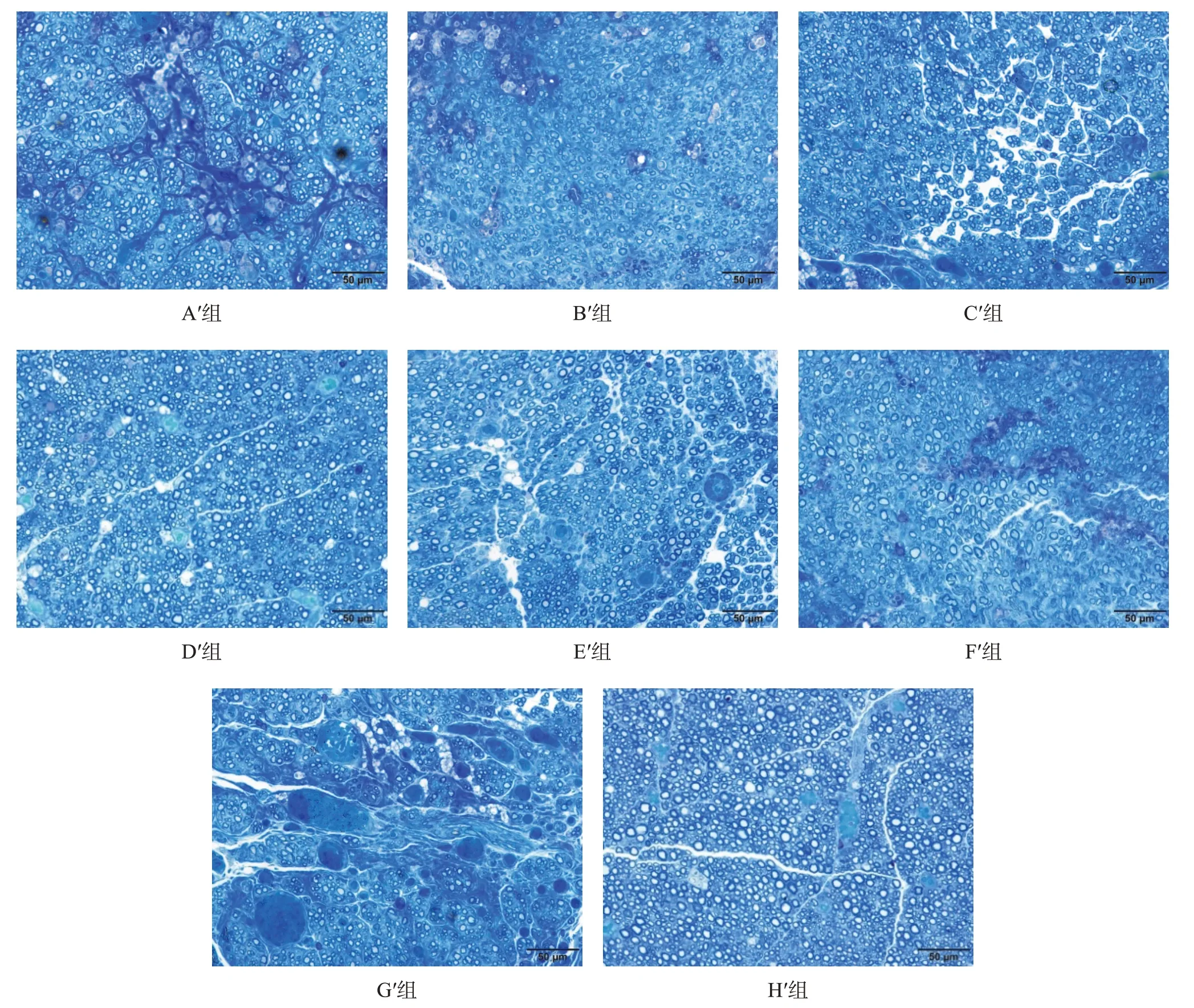
圖9 移植術后20周各組移植神經段再生神經(甲苯胺藍染色,bar=50 μm)
ENTFs主要由施萬細胞合成和釋放,施萬細胞的活性在一定程度上決定周圍神經移植物的再生潛能。然而,施萬細胞作為周圍神經的主要表達MHC-Ⅰ、MHC-Ⅱ抗原分子的細胞,是同種異體移植后出現免疫排斥反應的主要原因[37]。如果將周圍神經施萬細胞的活細胞控制在一定的范圍內,則可能既降低周圍神經免疫原性又保留其存活施萬細胞在異體移植后持續分泌ENTFs的能力,這對異體移植后的受者神經再生和功能恢復具有重要意義。在本研究中,體外預處理大鼠坐骨神經成功地誘導其ENTFs表達,高表達ENTFs的坐骨神經雖然活細胞減少,但其免疫原性也下降,異體移植后排斥反應降低,能促進移植術后受者神經再生和功能恢復。然而,能高表達ENTFs的預處理坐骨神經存活的施萬細胞卻減少,是因預處理時間較長導致坐骨神經的存活施萬細胞減少,還是因預處理液中的營養成分不足以維持長時間體外培養過程中施萬細胞存活?還需進一步研究并探討其可能機制和改進措施。
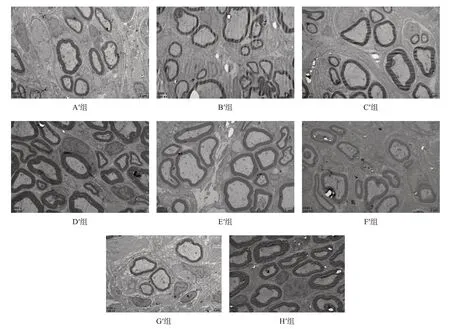
圖10 移植術后20周各組移植神經段再生神經(透射電鏡,×6000,bar=2 μm)

