不同RNA提取及反轉錄方法對環狀RNA聚合酶鏈反應的影響
王建星,聶子元,董金輝,賈新菊
(1.河北醫科大學第二醫院耳鼻喉一科,河北 石家莊 050000;2.河北醫科大學第二醫院血液內科,河北省血液病重點實驗室,河北 石家莊 050000;3.河北醫科大學第一醫院內分泌科,河北 石家莊 050000)
環狀RNA(circular RNA,circRNA)作為重要的非編碼RNA,在真核生物多種生物學過程中發揮關鍵作用,參與包括腫瘤及心血管疾病在內的多種疾病的發生發展[1]。由于環狀RNA的閉合環狀結構大大提高了其穩定性,且其存在組織及疾病特異性,越來越多研究將環狀RNA作為疾病的潛在生物學標志物[2-3]。前期研究發現circFLNA在喉鱗狀細胞癌中高表達并且參與了癌細胞的遷移[4]。盡管環狀RNA普通存在真核生物中,但相對于線性RNA,如mRNA等,其在胞內的豐度較低。此外,目前鑒定環狀RNA的方法主要是聚合酶鏈式反應(polymerase chain reaction,PCR)、Northernblot、原位雜交等,其中前兩種方法就必須基于完整且高質量的總RNA[5]。且由于環狀RNA在細胞內含量相對較低。因此有效提取高質量的RNA成為研究環狀RNA先決條件。本研究通過不同總RNA提取方法及不同反轉錄引物得到的cDNA進行環狀RNA擴增,進一步尋找可靠、省時、高效的環狀RNA擴增手段,為基礎研究及臨床環狀RNA測定提供幫助。
1 材料與方法
1.1細胞培養 人喉鱗狀細胞癌細胞株Hep2細胞由河北醫科大學第二醫院耳鼻喉一科保存。Hep2細胞培養在含10%胎牛血清的RIPM1640培養液中培養,放于溫度為37 ℃,5% CO2培養箱內培養。每1~2 d觀察細胞形態及密度,進行傳代并放回培養箱繼續培養。
1.2miRNeasy Mini試劑盒提取總RNA 根據miRNesay Mini Kits(Qiagen)操作手冊進行。具體如下,向1×107個Hep2細胞中加入1 mL QIAzol裂解液,室溫放置5 min,加入200 μL氯仿劇烈震蕩15 s,室溫靜置2~3 min,4 ℃ 12 000 g離心15 min,將上層清液轉移到一個新的EP管中,加入1.5倍體積的無水乙醇,混勻。吸取700 μL樣本轉移到miRNeasy Mini 柱內,室溫8 000 g離心15 s,棄掉收集管中的液體。向離心柱內加入700 μL的Buffer RWT,8 000 g離心,15 s,棄濾液。吸取500 μL的Buffer RPE于離心柱內,8 000 g離心15 s,棄濾液。吸取500 μL的Buffer RPE于離心柱內,8 000 g離心2 min,棄濾液。將miReasy Mini柱轉移到新的1.5 mL EP管內。于柱內加入40 μL DEPC水,室溫12 000 g離心1 min,得到的RNA溶液用于進一步實驗。每組實驗重復3次。
1.3Trizol抽提法提取總RNA方法 向1×107個Hep2細胞中加入1 mL Trizol抽提裂解液,充分混勻,室溫靜置5 min,加入200 μL氯仿劇烈震蕩15 s,靜置2 min;4 ℃ 12 000 g離心15 min,取上清500 μL,并在上清中加入500 μL異丙醇,將管中液體輕輕混勻,室溫靜置10 min。4 ℃ 12 000 g離心10 min,棄上清。加入1 mL 75%的DEPC-乙醇,洗滌沉淀。4 ℃ 8 000 g離心5 min,棄上清,可見白色RNA沉淀,濾紙吸干沉淀物,40 μL DEPC水溶解RNA沉淀,RNA溶液用于進一步實驗。每組實驗重復3次。
1.4RNA濃度及質量檢測 使用Nanodrop 2000紫外分光光度計測定總RNA的濃度、RNA純度由OD260/280,OD260/230進行判讀,具體如下:Nanodrop 2000用2 μL DEPC水調準基線,取2 μL不同方法提取的總RNA溶液,讀取RNA濃度,OD260/280及260/230比值,比值在1.8~2.0范圍內證明RNA純度高,達到下一步實驗的要求。
1.5反轉錄反應和過程 使用5 μg不同方法提取的Hep2細胞的總RNA進行反轉錄,依據M-MLV First Strand Kit操作手冊進行反轉錄合成cDNA。反應體系為20 μL。具體如下:0.2 mL微量離心管中加入總RNA 2 μg,通用引物1 μL或隨機引物1 μL,10 mmol/L dNTP 1 μL,后用DEPC水將體系補足至12 μL;65 ℃變性5 min,迅速置于冰上冷卻;短暫離心后分別加入4 μL的5×第一鏈合成緩沖液、2 μL 0.1 mmol/L DTT和1 μL RNaseOUT核酸酶抑制劑,離心混勻,置于PCR反應儀中37 ℃孵育2 min,隨后常溫下加入1 μL M-MLV逆轉錄酶(200 U/μL),離心混勻。重新放回PCR儀中,預設程序37 ℃反應50 min,接著70 ℃處理15 min以滅活逆轉錄酶,最后4 ℃冷卻。制備的cDNA -20 ℃保存備用。
1.6實時定量PCR(real-time quantitative PCR) Realtime PCR反應在QuantStudioTM7 Flex Realtime,PCR System(Applied Biosystems,美國)上進行,反應體系為20 μL。cDNA按照1∶10稀釋,反應體系如下:SYBR Green qPCR預混液10 μL,模板DNA 2 μL,上下游因為各1 μL,無RNA酶水7 μL,離心混勻后,按照如下反應條件,進行實時定量PCR反應:上游引物,下游引物,無RNA酶水7μL,離心混勻后,進行PCR反應。相對定量法采用比較Ct法,以線性GAPDH作為內參,采用△Ct(Ct目的-Ct內參)法進行相對定量分析,用2-△Ct計算所得值作為目的RNA的相對表達量。引物序列如下:circFLNA-F:CCAGCTGAGGCTCTACC-GTGCC; circFLNA-R:GAGGCGTCAGCATCCC-CAACAG;circHIPK3-F:TGGAGACTGGGGGA-AGATGA;circHIPK3-R:CACACTAACTGGCT-GAGGGG。
1.7瓊脂糖凝膠電泳 配置1.5%瓊脂糖凝膠,取上述PCR產物5 μL,120 V 30 min進行電泳,用凝膠成像儀成像取圖,檢測PCR擴增產物。
1.8統計學方法 應用SPSS 13.0統計軟件分析數據。計量資料比較采用獨立樣本的t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1miRNeasy Mini試劑盒法與Trizol抽提法提取細胞總RNA的濃度及總量比較 用miReasy Mini試劑盒法與Trizol抽提法分別提取1×107Hep2細胞中的總RNA,Nanodrop 2000紫外分光光度計測定總RNA濃度和計算RNA總質量。Trizol抽提法提取的總RNA的濃度為總質量均高于miRNeasy Mini試劑盒法,差異有統計學意義(P<0.01),見表1。
2.2miRNeasy Mini試劑盒法與Trizol抽提法提取細胞總RNA的純度比較 用miReasy Mini試劑盒法與Trizol抽提法提取1×107個Hep2細胞總RNA,Nanodrop 2000紫外分光光度計測定總RNA的A260/280及A260/A230。兩種提取試劑盒法提取的總RNA的A260/A280,A260/A230比值均在1.8~2.0,表明所得的RNA純度比較高,而miReasy Mini方法提取的總RNA的A260/A280,A260/A230更接近2.0,說明RNA純度更高,所含雜質含量較少。兩種方法提取的總RNA的純度差異有統計學意義(P<0.05),見表2。
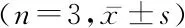

方法 RNA濃度(mg/L)RNA總量(μg)Trizol抽提法 1 160.000±33.4604.772±0.042miRNeasy Mini試劑盒法 924.000±22.8703.696±0.091t值 10.08618.595P值 <0.001<0.001
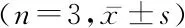

方法 A260/A280A260/A230Trizol抽提法 1.893±0.0091.807±0.031miRNeasy Mini試劑盒法2.043±0.0262.010±0.006t值 6.3129.098P值 <0.001<0.001
2.3隨機引物及通用引物進行反轉錄對對環狀RNA擴增的影響 miReasy Mini試劑盒法與Trizol抽提法提取總RNA,2 μg RNA分別利用隨機引物及通用引物進行反轉錄,普通聚合酶鏈反應擴增circHIPK3及circFLNA,瓊脂糖凝膠電泳檢測PCR產物,利用隨機引物進行反轉錄后,可順利擴增出circHIPK3及cirFLNA,而通用引物反轉錄所得到的cDNA進行PCR,circHIPK3及circFLNA均不能被擴增,見圖1。

圖1 隨機引物及通用引物進行反轉錄對對環狀RNA擴增的影響
A.瓊脂糖凝膠電泳檢測circHIPK3的表達;B.瓊脂糖凝膠電泳檢測circFLNA的表達
Figure 1 Effects of Random primers and oligodT primers on the amplification of circular RNA
2.4不同方法提取總RNA對環狀RNA實時定量PCR相對表達量的影響 利用miReasy Mini試劑盒法與Trizol抽提法提取總RNA,2 μg RNA進行反轉錄,反轉錄引物為隨機引物,實時定量聚合酶鏈反應檢測circHIPK3及circFLNA在Hep2細胞中的相對表達量,以線性GAPDH作為內參,miReasy Mini試劑盒法提取總RNA后circHIPK3相對GAPDH的CT值為 -(9.717±0.166),circFLNA相對GAPDH的CT值為 -(11.69±0.213),Trizol抽提法提取總RNA circHIPK3相對GAPDH的CT值為 -(11.67 0.079),circFLNA相對GAPDH的CT值為 -(12.5±0.249),miReasy Mini試劑盒提取方法總RNA進行PCR所得的circHIPK3及circFLNA相對表達明顯高于Trizol抽提法,差異有統計學意義(P<0.05),見表3。
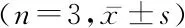

方法 circHIPK3circFLNATrizol抽提法 -(11.670±0.079)-(12.500±0.249)miRNeasy Mini試劑盒法-(9.717±0.166)-(11.690±0.213)t值 23.7168.798P值 <0.001<0.001
3 討 論
目前很多的研究指出,生命的本質也可能由RNA所決定。除了經典的轉運RNA(tRNA),信使RNA(mRNA)和核糖體RNA(rRNA)之外,越來越多類型的RNA被發現,包括微小RNA(miRNAs),長鏈非編碼RNA(lncRNAs),小干擾RNA(siRNAs)和其他非編碼的RNA,而RNA多樣的生物學功能也逐漸被揭示[6]。環狀RNA是一類廣泛存在于真核細胞內具有多種生物學功能的內源性非編碼RNA[7]。在20世紀70年代,環狀RNA首先被當做類病毒的遺傳物質在植物中被發現,隨后的研究表明環狀RNA可以存在于多種生物體內,包括真核生物、酵母菌、病毒、四膜蟲等。但當時觀點認為,環狀RNA可能是由于前體mRNA錯誤剪切形成的,含量較少,作為RNA垃圾,可能并沒有實際意義,因此未能引起足夠重視[8-9]。
隨著聚合酶鏈反應及RNA測序技術的迅速發展,越來越多環狀RNA被鑒定并賦予新的意義。Barrett等[10]首先證實了前體mRNA的環化特征,指出環狀RNA是由mRNA前體經反向剪接產生的環狀轉錄本,并確定其在正常細胞及腫瘤細胞中發揮相應作用。目前研究證實,環狀RNA不同于其他非編碼RNA,主要來源于蛋白質編碼的外顯子,通過剪接體作用減去前體mRNA中的內含子,同時下游的5′剪接位點與上游的3′剪接位點含有互補結構,通過共價鍵連接形成外顯子環狀RNA[11]。此外,也有研究證實,內含子,非編碼區及不連續的外顯子也可能通過其他形式形成環狀RNA[12]。另外,包括RNA結合蛋白驅動及套索驅動模式也被證實在環狀RNA環化中起了一定作用[13]。由于環狀RNA不含有5′端的帽子結構及3′端的PolyA尾,不容易被RNA酶結合,因此其表達穩定不易破壞。研究證實,環狀RNA的半衰期超過48 h,較其線性的mRNA明顯增長。由于環狀RNA的特性及越來越多的功能被發現,環狀RNA也稱為多種疾病的分子標志。通過高通量測序的方法,孔德沛等[3]在喉鱗狀細胞癌中發現302種環狀RNA上調,有396中環狀RNA下調,提示著環狀RNA可能參與了喉鱗狀細胞癌的發生發展過程。
此外,環狀RNA顧名思義是一個閉合的環狀結構,與線性的mRNA不同,環狀RNA不存在5′端帽子和3′端的PolyA尾,因此RNA反轉錄為cDNA過程中的引物選擇過程中不能使用與PolyA互補結合通用引物,而是使隨機引物或特定基因的特異性引物。本研究結果顯示,當利用通用作為反轉錄引物時,不能擴增出目的環狀RNA,原因是由于環狀RNA沒有3′ PolyA尾,通用引物不能識別環狀RNA,而將隨機引物作為反轉錄引物后能順利擴增出所需要的環狀RNA。
雖然高通量測序是目前批量鑒定環狀RNA的理想方法,但該方法成本較高,周期長。而且測序結果仍需要通過PCR進一步驗證。盡管環狀RNA普遍存在于真核生物中,但其在胞內的豐度仍比較低。此外,目前最常用的鑒定方法仍然是PCR、Northern blot,這2種方法都必須基于完整RNA[14]。因此,有效提取高質量的RNA成為研究環狀RNA先決條件。本研究通過對比Trizol抽提法和miReasy Mini試劑盒法2種總RNA,發現用傳統Trizol抽提提取的RNA濃度要高于miReasy Mini試劑盒提取的。原因之一是,Trizol抽提方法是利用核酸沉淀原理,基本上能將所有的RNA沉淀下來,因此其RNA濃度較高,但也因為該方法,除了RNA之外,還有部分其雜質被沉淀下來,如蛋白質或DNA等;而試劑盒是利用膜與RNA的結合方式進行分離,該膜與RNA結合受到量的限制,當RNA過量時,膜的結合能力有限達到飽和,所以該方法分離到的RNA濃度相對Trizol抽提方法的要低[15]。同樣,利用膜分離的方法可以排除其他雜質的影響,在提取RNA過程中,不能與膜結合的物質,如蛋白質和DNA就被洗掉,因為miRNeasy Mini試劑盒提取到的RNA純度較高。雖然環狀RNA較線性RNA穩定,它不容易受RNA外切酶的消化,但仍然屬于RNA,易受無處不在的RNA酶消化而降解。因此,所提取出來的RNA純度對環狀RNA的穩定性影響較大。Trizol抽提法提取的RNA濃度雖高,但雜質較多,總RNA降解速度快,而miRNeasy Mini試劑盒提取的RNA純度高,降解較慢。此外,絕大部分環狀RNA均為長鏈RNA,容易被膜結合方式分離,所以用相同量的總RNA進行反轉錄時,經試劑盒提取的RNA,其中環狀RNA的比例相對高,間接地提高了環狀RNA的比例,因此,在低豐富的環狀RNA中,miRNeasy Mini試劑盒提取到的RNA更容易被鑒定出來。
但是本研究僅局限于喉鱗狀細胞癌Hep2細胞株對不同RNA提取方法及不同反轉錄引物進行反轉錄PCR效果差異分析,可能存在一定局限性,應該在更多不同類型細胞、不同細胞和不同組織樣本進行更進一步研究以尋找出環狀RNA擴增最為有效、經濟的方法。
綜上所述,應用miRNeasy Mini試劑盒法提取總RNA純度更高,更有利于環狀RNA的擴增,利用隨機引物進行反轉錄而非通用引物,可順利擴增出環狀RNA,為環狀RNA的進一步研究提供了省時、高效、穩定的擴增方案。

