酞菁鋅光動力治療誘導大腸癌Lovo細胞產生活性氧
李濤,王玉△,陳偉,夏春輝,倫志強
由于酞菁類配合物在紅光照射下產生的.O2自由基與.OH具有很高的化學活性,能與腫瘤細胞內的有機物進行強氧化反應,殺死癌細胞,因此酞菁類配合物成為具有潛在前景的新一代抗腫瘤光敏劑[1-2]。線粒體凋亡途徑是光敏劑治療的主要作用途徑,與光敏劑的光動力治療(PDT)原理密切相關,具有中心樞紐和放大作用,因此線粒體的調節作用在腫瘤的治療中具有重要作用。線粒體作為細胞供能的主要場所,發生損傷時會釋放活性氧(Reactive oxygen species,ROS)等有毒化學物質到細胞質中,從而引起細胞凋亡、自噬的發生[3-4]。P38MAPK是細胞內主要的信號系統之一,參與多種刺激引起的信號級聯反應,與ROS氧化應激損傷密切相關[5-7]。
本課題組已初步證明四-α-(對羧基苯氧基)酞菁鋅(TαPcZn)光敏劑在大腸癌Lovo細胞中具有良好的富集能力,并且能明顯抑制Lovo細胞生長,誘導細胞凋亡[7],但TαPcZn-PDT誘導腫瘤細胞線粒體凋亡過程中各級聯反應中的具體環節和作用機制尚未清楚。鑒于前期的研究結果顯示P38MAPK參與了TαPcZn-PDT誘導Lovo細胞凋亡的作用[8],因此本實驗以P38MAPK基因為靶目標,探討P38MAPK在ROS損傷中的作用,為今后光敏劑的臨床應用提供理論基礎。
1 材料與方法
1.1 實驗材料 DMEM培養基、opti-MEM培養基購自美國ThermoFisher scientific公司,Silencer select Negative siRNA、Silencer select P38MAPK siRNA購自美國ThermoFisher Scientific公司,胰蛋白酶購自德國Sigma公司,JC-1和Hoechst33342購自美國Genmed Scientifics公司,RT-PCR試劑盒購自日本TaKaRa公司,抗P38MAPK抗體購自美國Cell Signaling Technology公司,Lovo細胞購自中科院動物研究所。MuseTM細胞分析儀購自美國默克密理博公司。
1.2 方法
1.2.1 細胞培養 取對數生長期的細胞(5×105個/L)接種于培養瓶中,分成5組:對照組、siRNA-陰性對照組、siRNAP38MAPK 轉染組、TαPcZn-PDT組、TαPcZn-PDT/siRNAP38MAPK組。細胞在經不同因素處理后進行紅光照射,紅光的波長范圍為600~700 nm,光動力為53.7 J/cm2。紅光照射結束后,細胞孵育3 h,然后進行各項檢測。
對照組:紅光照射10 min。siRNA-陰性對照組:在Lovo細胞中轉染siRNA-陰性對照(12.5 nmol/L)48 h后紅光照射10 min。siRNA-P38MAPK(正向5'-GAAGCUCUCCAGACCAUUUtt-3',反向5'-AAAUGGUCUGGAGAGCUUCtt-3')轉染組:在Lovo細胞中轉染siRNA-P38MAPK(12.5 nmol/L)48 h后紅光照射10 min。TαPcZn-PDT組:在Lovo細胞中添加TαPcZn(54μmol/L)2 h后紅光照射10 min。TαPcZn-PDT/siRNA-P38MAPK組:在Lovo細胞中轉染siRNA-P38MAPK(12.5 nmol/L)48 h后添加TαPcZn(54μmol/L),2 h后紅光照射10 min。
1.2.2 RT-PCR檢測siRNA沉默后P38MAPK、GAPDH mRNA表達情況 取對數生長期的Lovo細胞,將密度為5×105個/L細胞加入到培養瓶中,于37℃、5%CO2、飽和濕度培養箱中培養。培養24 h后棄去上清,以脂質體包裹的siRNA轉染細胞。設對照組、siRNA陰性對照組、siRNA-GAPDH陽性對照組、siRNAP38MAPK組,分別于轉染48 h后紅光照射10 min,繼續培養3 h后收集細胞,進行RT-PCR檢測。反應條件:94℃變性30 s,58℃退火30 s,72℃延伸1 min,32個循環;另加72℃延伸10 min。GAPDH引物:上游5'-GAAGGTGAAGGTCGGAGTC-3',下游5'-GAAGATGGTGATGGGATTTC-3'。P38MAPK引物:上游 5'-GACAATCTGGGAGGTGCC-3',下游 5'-GACCCAGTCCAAAATCCA-3'。PCR產物進行15 g/L瓊脂糖電泳,凝膠成像圖像分析系統采集圖像(BIORAD公司)。實驗重復3次。
1.2.3 免疫印跡檢測siRNA沉默后P38MAPK、GAPDH表達情況 處理結束后收集細胞,提取總蛋白[13],檢測P38MAPK及GAPDH。收集細胞后,加入適量的細胞裂解液150μL,超聲粉碎,4℃12 000×g離心1 h。用Lowry法測定蛋白濃度,30μg總蛋白/孔上樣,經SDS-PAGE分離并轉移至PVDF膜上。用含5%脫脂奶粉室溫封閉1 h,分別孵育于一抗P38MAPK(1∶1 000)抗體及及GAPDH(1∶400),4 ℃過夜,用TBST漂洗5 min×3次,加1∶5 000的辣根過氧化物酶結合的二抗,室溫孵育1 h,用TBS漂洗5 min×2次,TBST漂洗10 min×1次,ECL發光。凝膠成像圖像分析系統采集圖像(中國,上海天能公司Tanon 5200 Multi)。實驗重復3次。
1.2.4 線粒體膜電位(Mitochondrial membrane potential,ΔΨm)的檢測 培養于6孔板中的各組Lovo細胞,PBS洗2次,加入 1 mL 培養基,然后加入 1 mL JC-1(5,5’,6,6’-tetrachloro-1,1,3,3’-tetraethyl benzimidazolylcarbocyanine iodide,JC-1)染色工作液和7-氨基放線菌素(7-aminoactinomycin D,7-AAD)染液,充分混勻。于細胞培養箱中37℃孵育20 min結束后,吸除上清,用冰浴的JC-1染色緩沖液洗滌2次,經細胞分析儀檢測。實驗重復3次。
1.2.5 細胞活性氧ROS檢測 細胞接種6孔板,參照1.2.1分組實驗。光照前加入無熒光的2',7'-二氯二氫熒光素二乙酸酯(2',7'-Dichlorodihydrofluorescein diacetate,DCFH-DA),終濃度10μmol/L。光照結束后培養30 min,然后加入1 mL Hoechst33342,培養 30 min,PBS洗 2次。鏡下觀察,Hoechst33342染色,核藍色顯示凋亡(深染,團塊狀),DCFH被氧化成 2',7'-二氯熒光素(2',7'-Dichlorofluorescein,DCF),在細胞質內黃綠色熒光(表明有ROS,否則無色)。收集細胞,經細胞分析儀檢測。實驗重復3次。
1.2.6 Annexin V&Dead Cell雙標檢測細胞凋亡 各組細胞處理結束后收獲細胞,PBS洗2次,用100μL結合緩沖液重新懸浮細胞,調節細胞濃度為1×105/mL,加100μL(Annexin-V和7-AAD),室溫下閉光染色20 min,經細胞分析儀檢測并分析。實驗重復3次。
1.3 統計學方法 采用SPSS 22.0統計軟件進行分析。符合正態分布的計量資料以均數±標準差()表示,多組間比較采用單因素方差分析,組間多重比較應用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 siRNA沉默P38MAPK表達 轉染siRNAP38MAPK 48 h后,轉染效率達到90%以上,見圖1A,P38MAPK mRNA和蛋白的表達明顯被抑制,提示轉染成功。見圖1B和1C。
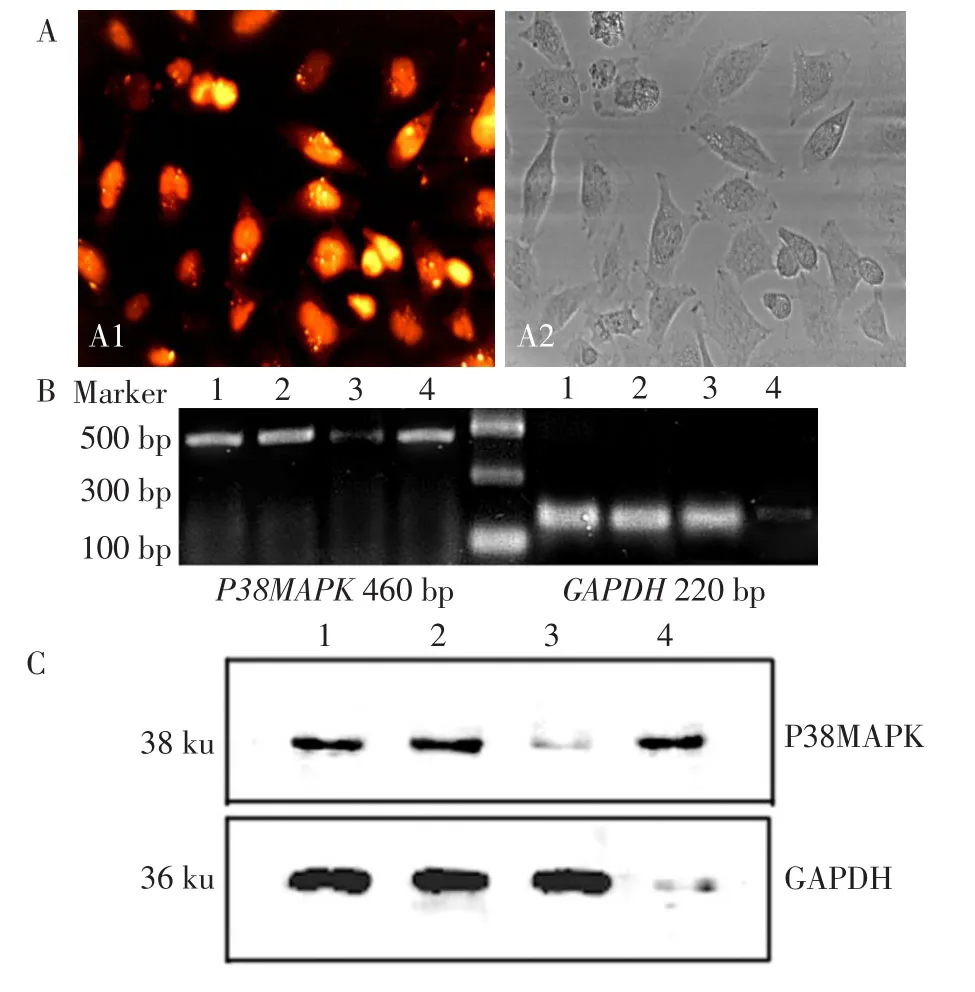
Fig.1 The silencing of P38MAPK in Lovo cells圖1 siRNA沉默Lovo細胞P38MAPK表達
2.2 siRNA-P38MAPK介導 TαPcZn-PDT誘導的Lovo細胞線粒體損傷
2.2.1 siRNA-P38MAPK 影響 TαPcZn-PDT激發Lovo細胞產生ROS 倒置顯微鏡下觀察發現,對照組、siRNA-陰性對照組、siRNA-P38MAPK組的Lovo細胞形態較好,為梭形、三角形,TαPcZn-PDT組和TαPcZn-PDT/siRNA-P38MAPK組的Lovo細胞部分收縮變圓。通過熒光顯微鏡下觀察發現,對照組、siRNA-陰性對照組、siRNA-P38MAPK組產生ROS的Lovo細胞很少,TαPcZn-PDT組和TαPcZn-PDT/siRNA-P38MAPK組產生ROS的Lovo細胞較多且處于凋亡狀態。見圖2A。細胞流式結果分析顯示,TαPcZn-PDT能明顯誘導Lovo細胞產生ROS(P<0.05),siRNA-P38MAPK能部分阻礙TαPcZn-PDT誘導Lovo產生ROS(P<0.05)。見圖2B和表1。
2.2.2 siRNA-P38MAPK影響 TαPcZn-PDT誘導Lovo細胞線粒體膜電位ΔΨm的改變 流式結果分析發現,TαPcZn-PDT 組和 TαPcZn-PDT/siRNAP38MAPK組線粒體膜電位發生去極化的細胞非常多(P<0.05),且 TαPcZn-PDT/siRNA-P38MAPK 組發生去極化的細胞少于TαPcZn-PDT組(P<0.05)。見圖3、表1。
2.3 siRNA-P38MAPK影響TαPcZn-PDT誘導Lovo細胞凋亡 流式結果分析發現,TαPcZn-PDT組和TαPcZn-PDT/siRNA-P38MAPK組的凋亡細胞較多(P<0.05),且 TαPcZn-PDT/siRNA-P38MAPK 組的凋亡細胞比TαPcZn-PDT組的凋亡細胞少(P<0.05)。見圖4、表1。
3 討論

Fig.4 Effects of TαPcZn-PDT on the apoptosis of Lovo cells with siRNA-P38MAPK圖4 在siRNA-P38MAPK作用下TαPcZn-PDT對Lovo細胞凋亡的影響
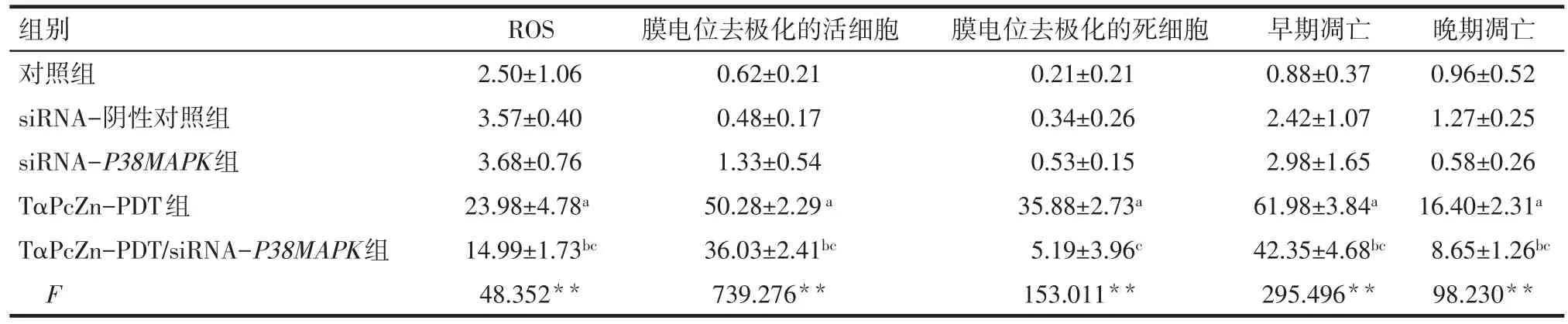
Tab.1 Effects of TαPcZn-PDT on ROS,ΔΨm and apoptosis level of Lovo cells after transfection with siRNA-P38MAPK表1siRNA-P38MAPK轉染后TαPcZn-PDT對Lovo細胞ROS、ΔΨm和凋亡的影響 (n=3,%,x±s)
目前已有研究證實TαPcZn-PDT具有誘導腫瘤細胞凋亡的作用,且P38MAPK參與此過程[8-9],但是P38MAPK影響凋亡過程的具體機制尚不清楚。因此,本文以P38MAPK為靶目標,探討了TαPcZn-PDT誘導Lovo細胞凋亡過程中P38MAPK在線粒體損傷中的作用。實驗初期,在對照部分設立siRNA-陰性對照組,鑒于siRNA-陰性對照組與空白對照組無差異,另外考慮到合成的TαPcZn較少,因此未在TαPcZn-PDT作用下設立siRNA-陰性對照組,只分別 設 了 TαPcZn-PDT 組 和 TαPcZn-PDT/siRNAP38MAPK組。
3.1 P38MAPK參與TαPcZn-PDT誘導Lovo細胞線粒體的損傷 線粒體的變化在凋亡過程中最先出現,因而探討TαPcZn-PDT誘導Lovo細胞線粒體的損傷具有重要意義。線粒體損傷先從線粒體膜通透性孔道(mitochondrial permeability transition pore,MPTP)開放和ROS產生開始,MPTP的開放導致線粒體ΔΨm的降低,產生的ROS釋放到細胞質中,從而損傷細胞器、細胞核,導致細胞凋亡的產生。ROS包括超氧自由基、過氧化氫及其下游產物過氧化物和羥化物等,參與細胞生長增殖、發育分化、衰老和凋亡以及許多生理和病理過程[10]。本研究發現,TαPcZn-PDT 能明顯誘導 Lovo產生 ROS,且在siRNA-P38MAPK作用下產生的ROS明顯減少,說明P38MAPK介導了TαPcZn-PDT誘導Lovo細胞產生ROS,這與前期研究基礎TαPcZn-PDT具有誘導腫瘤細胞凋亡的作用,且P38MAPK參與此過程相呼應[8-9]。
由于線粒體ΔΨm的去極化是細胞凋亡早期的一個標志性事件,因此線粒體的損傷最先體現在線粒體ΔΨm的變化[11]。因此,本研究又對線粒體的ΔΨm的變化進行了研究,探討siRNA-P38MAPK介導TαPcZn-PDT誘導的Lovo細胞線粒體損傷的機制。本研究發現,TαPcZn-PDT導致早期凋亡和晚期凋亡的Lovo細胞ΔΨm發生去極化,而這種去極化現象可被siRNA-P38MAPK抑制,主要是在早期凋亡的發生去極化的細胞大量減少,從而導致晚期凋亡的發生去極化的細胞也大量減少。這與P38MAPK參與TαPcZn-PDT具有誘導腫瘤細胞凋亡的作用相一致。
本研究發現P38MAPK介導TαPcZn-PDT誘導的Lovo細胞的線粒體凋亡途徑是通過影響ROS的產生和線粒體膜電位ΔΨm的改變來實現的。沉默P38MAPK基因可明顯減弱TαPcZn-PDT誘導的ROS釋放,阻礙了線粒體膜電位去極化,從而降低了TαPcZn-PDT誘導的細胞凋亡。
3.2 P38MAPK參與TαPcZn-PDT誘導Lovo細胞凋亡 線粒體的變化在凋亡過程中最先出現,因此在研究線粒體損傷的同時,也檢測了細胞凋亡的情況。研究結果再一次證明了TαPcZn-PDT誘導的Lovo細胞凋亡的作用,且主要發生在早期凋亡,這與TαPcZn-PDT誘導的Lovo細胞線粒體ΔΨm去極化相一致,更加證明了TαPcZn-PDT通過誘導Lovo細胞線粒體損傷從而誘導Lovo細胞凋亡,與Panel等[12]的研究結果一致,說明線粒體在細胞凋亡中具有重要作用。本研究結果還顯示,siRNA-P38MAPK部分抑制了TαPcZn-PDT誘導Lovo細胞凋亡的作用,這與siRNA-P38MAPK部分抑制ΔΨm發生去極化的作用相一致。因此,認為P38MAPK參與TαPcZn-PDT誘導Lovo細胞凋亡的過程。
本項目組前期研究結果顯示,在此凋亡過程中還有線粒體相關的蛋白也參與到此過程,如細胞凋亡誘導因子(apoptosis inducing factor,AIF)、促凋亡蛋白BAX、細胞色素C(Cytochrome C,Cyto-C)等參與[7-8],與Kello等[15]研究結果一致,均促進了細胞凋亡過程。BAX參與MPTP孔道的開放,引起ΔΨm去極化加劇,同時開放的孔道引起AIF、Cyto-C的釋放,繼而加劇了細胞凋亡的進程[16]。P38MAPK作為應激反應通路起到重要作用,它不僅通過caspase-3通路參與凋亡,還可通過線粒體通路參與到凋亡中[17],因此siRNA-P38MAPK減弱了ROS的釋放,降低了凋亡率,但是凋亡細胞中形成的線粒體-caspase-線粒體的正反饋放大回路還在起作用,因此凋亡還存在[18-19]。
ROS、線粒體膜通透性及線粒體凋亡途徑三者之間存在著緊密的聯系,ROS與線粒體膜MPTP孔道的開放之間的關系一直存在爭議[11-12]。當細胞受到ROS刺激時,線粒體MPTP開放,線粒體膜電位丟失,繼而引起ROS大量釋放,進一步加劇了MPTP的開放,又加劇了ROS的釋放和累積,不斷往復引起線粒體損傷,最后導致線粒體途徑的細胞凋亡[13,19],這與本研究結果一致,即TαPcZn-PDT誘導ROS產生,同時伴有線粒體膜電位ΔΨm去極化,進而導致細胞凋亡。
綜上,TαPcZn-PDT通過誘導ROS產生,引起線粒體膜電位去極化,導致Lovo細胞凋亡,P38MAPK通過影響ROS產生和釋放從而影響上述凋亡過程。
(圖2見插頁)

