無導線心臟起搏現狀
關 付, 李廣平, 2
(1. 首都醫科大學附屬北京世紀壇醫院 心內科,北京 100038;2. 天津市心血管病離子與分子機能重點實驗室,天津醫科大學第二醫院心臟科,天津心臟病學研究所,天津 300211)
目前全球每年起搏器置入數量超過一千萬,大多為傳統起搏器,即皮下置入起搏器脈沖發生器連接經靜脈置入的電極導線。但傳統起搏器面臨的一些局限和不足值得關注。起搏器患者發生并發癥的概率約10%,其中大多與電極導線或起搏器囊袋相關。電極導線多導致急性期并發癥如氣胸或上肢深靜脈血栓形成等,也偶有慢性并發癥如中心靜脈阻塞,三尖瓣關閉不全以及感染等。即使是單腔起搏器,其并發癥風險雖然比雙腔起搏器低,卻也有1/40患者在術后3個月內發生嚴重的并發癥需要外科干預,其一半以上與電極導線有關[1]。
目前新興的無導線心臟起搏(leadless cardiac pacing, LCPs),通過精細的遞送系統將無導線起搏器置入右心室,很大程度上克服了上述傳統起搏器的局限性和不足。在外觀上,無導線起搏器的無線設計精巧,無需外科切口制作皮下囊袋[2]。1979年文獻中首次報道了經頸靜脈遞送導管,經導管將無導線起搏器置入完全性房室傳導阻滯的豬右心室,并維持了2個月的起搏治療。之后的20年里研究者們陸續做臨床前試驗,進一步證實了無導線單腔起搏的可行性。目前無導線起搏有兩種基本設計,一種是心內膜下起搏電極和皮下能量傳輸器兩部分元件的組合,另一種是脈沖發生器和起搏電極組合為一個元件。目前有兩家商業化的無導線起搏器,即Micra(Medtronic, Minneapolis, Minnesota) 和Nanostim (St. Jude Medical, St. Paul, Minnesota)[3]。
鑒于近年來無導線起搏在單腔起搏、雙腔起搏以及左心室起搏方面有很多臨床應用,尤其在單腔起搏以及左心室起搏方面的研究和優勢凸顯,本文擬就無導線起搏器的應用進展做一綜述。
1 無導線起搏器在右心室單腔起搏中的應用
無導線右心室單腔起搏是一體化設計,即脈沖發生器和感知/起搏電極合為一體,完全去掉了電極導線、囊袋制作以及系統內連接元件。術者以患者股靜脈為入路,將設備送入右心室間隔部位,獲得穩定持續的感知和起搏參數后釋放固定。如前所述,目前臨床上有兩種無導線起搏器已經正式應用,即Nanostim LCP(St. Jude Medical, Inc., St. Paul, Minnesota)和Micra Transcatheter Pacing System (TPS) (Medtronic, Inc., Minneapolis, Minnesota)。圖1顯示了TPS的保護鞘、固定機制和雙極感知和起搏特性, 而圖2示例了TPS置入[4]。裝置可經導管回收。
LEADLESS研究(Nanostim Safety and Performance Trial for a Leadless Cardiac Pacemaker System, LEADLESS)首次對LCPs臨床效果和安全性進行了多中心臨床研究。入選患者均具備單腔右心室起搏(VVI/VVIR)適應證,即:①永久性心房顫動伴房室傳導阻滯(AVB)(包括心房顫動伴慢心室率);②正常竇性心律下存在Ⅱ度或Ⅲ度AVB,體力活動少或預期壽命短者;③竇性心動過緩伴不規律停搏或電生理檢查無法解釋的暈厥。排除標準包括起搏器依賴、明顯肺動脈高壓或三尖瓣置換術后、起搏器/ICD電極置入術后或下腔靜脈濾網置入者。共有33例患者入選,平均手術時間是(28±17)min,94%(33例中31例)無任何并發癥。術后隨訪3個月和1年,起搏閾值、阻抗和感知保持穩定,未發生起搏裝置相關的并發癥,無電池提前耗竭或過感知、感知不良等,且19例患者達到充分的頻率適應[5]。
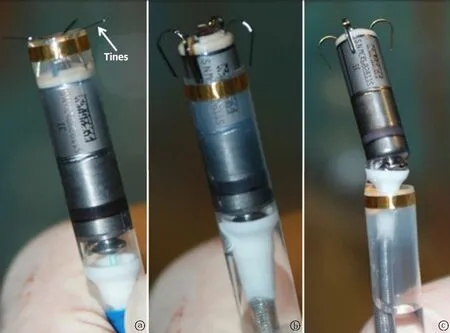
圖1 經導管置入無導線起搏器的固定機制。Micra在退出保護鞘時,暴露齒爪,但末端與遞送鞘管接口處連接 a.為退保護鞘,暴露齒爪;b.為齒爪完全反折暴露,Micra仍在鞘內;c.示退鞘,Micra系著于遞送導管接口
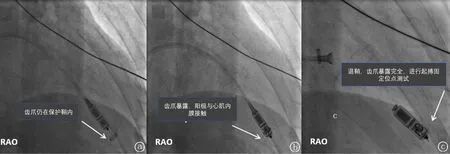
圖2 無導線起搏器的置入 a.遞送鞘和起搏器置于右心室心尖;b.齒爪暴露,陽極與心肌接觸;c.起搏器末端與遞送鞘管連接時進行位點測試(牽拉試驗)。RAO:右前斜投照體位
在無導線單腔右心室起搏的安全性和有效性方面,LEADLESS Ⅱ和TPS研究(Micra Transcatheter Pacing Study, TPS)中也進行了進一步評估。LEADLESS Ⅱ研究共納入526例患者,Nanostim-LCP置入成功率95.8%,術后6個月隨訪,電池平均壽命是15年,器械相關嚴重不良事件發生率6.7%,其中包括器械脫位后靜脈回收(1.7%),心臟穿孔(1.3%),以及起搏閾值增加后需要經靜脈回收及重置(1.3%)[6]。同樣,TPS試驗中來自19個國家的56個中心的共725名患者術后隨訪結果顯示,術后6個月起搏閾值低且穩定,無1例裝置脫位,而主要并發癥如心臟損傷、靜脈穿刺并發癥及血栓栓塞等較對照組無顯著增加[7]。近年來臨床上大量研究已經證實了無導線單腔右心室起搏的長期有效性、安全性以及可回收性[8]。對于臨床上有單腔起搏適應證而又不適合經靜脈置入傳統起搏器的患者,這足以作為醫生選擇替代治療的有利依據。但關于無導線起搏能否替代傳統經靜脈起搏或心外膜起搏的前景問題,尚需更加充分的實驗證據支持。
無導線起搏器最明顯的優勢是無靜脈電極導線[9]。脈沖發生器的感知電極的整體結構體積小,一體化的設計使得整個操作無需外科切口或皮下囊袋,減少了切口相關并發癥,當然也更加美觀。除了體積小,在電池續航時間上LCP與傳統經靜脈單腔起搏器相當。LCP采用高密度單氟化鋰碳電池, 遙測采用節能的傳導技術而非感應技術。電池剩余壽命通過特定算法精確預測,能夠在提示起搏器電池耗竭需更換時依舊保障6個月的正常功能。LCP和TPS均可以在特定條件下進行MRI(Magnetic Resonance Imaging, MRI)檢查。對于操作本身,常用的股靜脈途徑置入無導線起搏器時放射球管距離術者較遠,可減少術者放射線的暴露。由于其在設計和置入方法上的優勢,對于股靜脈入路無法應用者亦可經頸內靜脈入路成功置入[10]。不僅如此,對于目前臨床上合并其他心臟血管有創性治療的患者,如股靜脈濾器置入術后或三尖瓣置換術后患者,目前均有Micra成功置入經驗[11-12]。
2 無導線起搏器在雙腔起搏中的應用
上述的LCP和TPS無導線起搏僅局限于單腔右心室起搏。對于大多數有雙腔起搏適應證的患者,右心室起搏比率減低會有更多獲益。在心臟再同步化治療適應證人群,單腔無導線起搏并不適宜[13]。因此,雙腔無導線起搏的需求和獲益更加值得關注,由此衍生了多部位無導線起搏。
圖3所示,多部位無導線起搏的概念是雙腔無導線起搏協同工作[14]。為了達到同步化,這些裝置需建立無線連接。典型的無導線雙腔起搏工作模式為:心房的無導線起搏器刺激右心房后,將同步信息輸送到心室的無導線起搏器,后者接收信息并形成房室傳導延遲,產生一個心臟周期的激動。無導線起搏每次要消耗5~10 mV的能量,因此對電池容量的要求比較嚴格,所以這種房室連接需要節能以免影響電池壽命。傳統心臟置入裝置在體內的無限數據連接通常采用射頻遙測和誘導偶聯技術。對比而言,原電池(伽凡擬電池)偶聯的體內連接是在兩個置入器械之間進行信息傳輸,組織(心肌和血液)將作傳導介質,電流在組織內擴散至另一個裝置接收[15]。該起搏器的安全性和多位點起搏的可行性已經在體內進行了測試并達到較滿意結果。在3例體外試驗中,該工作原型起搏器達到了穩定的雙腔DOO模式起搏。圖4中ECG顯示了無導線雙腔起搏模式下心房和心室的起搏信號。類似雙心室起搏也在左心室和右心室的檢測中得到較好結論。
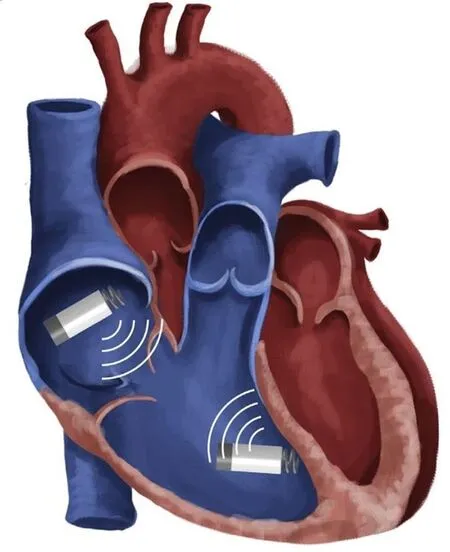
圖3 雙腔無導線起搏器。右心房、右心室分別置入無導線起搏器,二者通過無線連接而達到工作同步化
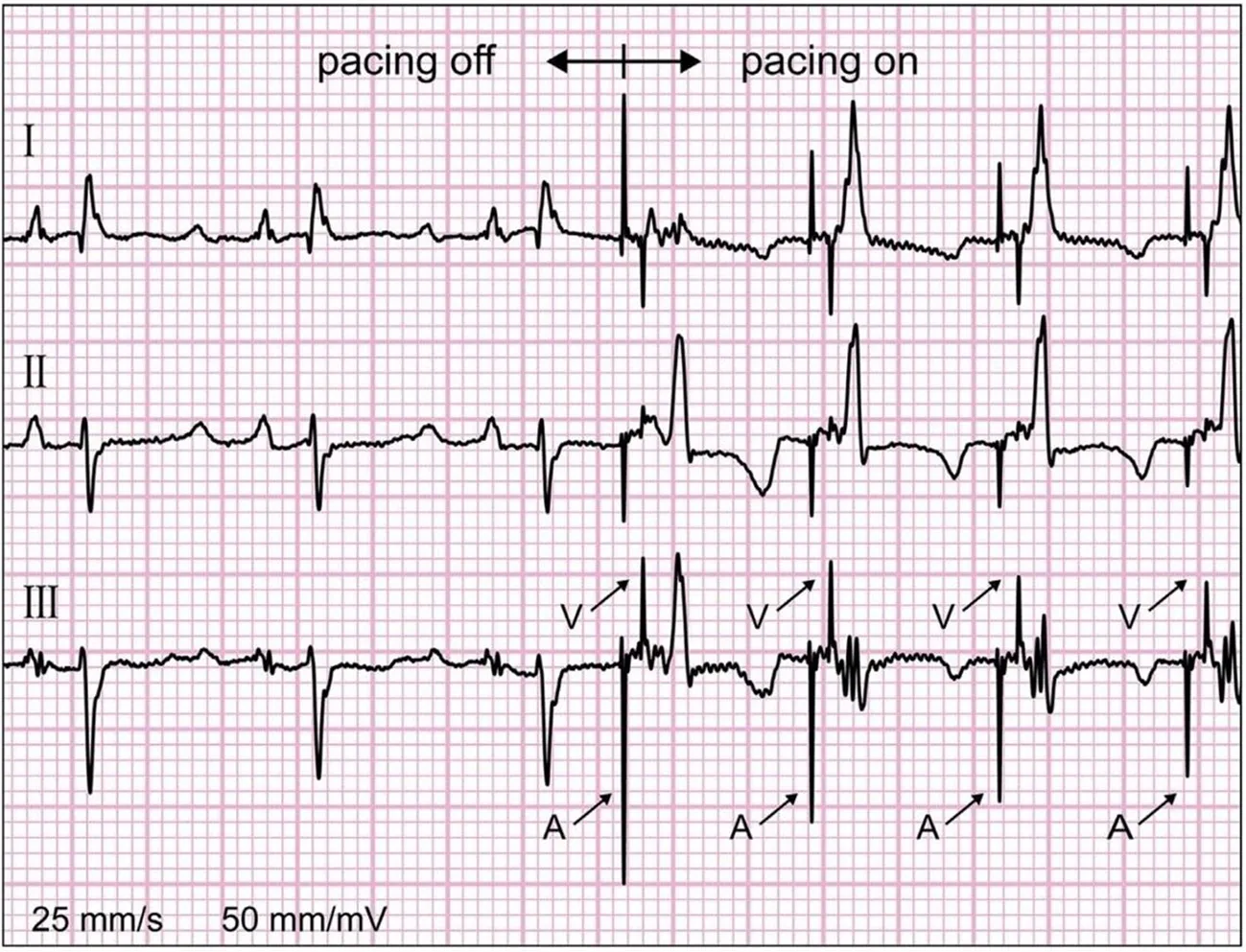
圖4 雙腔無導線起搏器工作時記錄到的體表心電圖。右心房右心室分別置入無導線起搏器后雙腔起搏記錄的心電圖,自身心率98次/min,雙腔DOO起搏頻率為120次/min,其AV間期為50ms。箭頭指示為A(心房)和V(心室)起搏信號
目前無導線連接技術的關鍵在于整合。裝置需要導管輔助下置入,所以心臟空間限制是技術上的主要困難。目前基本設計顯示電極距離越遠、表面積越大,電極的信號衰減越低。商業化無導線起搏器的電極距離(Nanostim: >10 mm; Micra: 18 mm)比較樂觀,這樣可以避免周圍組織因素對起搏參數和感知信息的干擾。另外,低頻信號可以阻止傳統無線傳輸(如藍牙、紫蜂)的非正常侵入造成的干擾。設想一下,該無線雙腔起搏模式再加上一個左心室的無導線起搏,無導線起搏概念可以延伸至心臟再同步化治療中。但是雙腔無導線起搏器仍然需要進一步的深度測量和研究,目前僅有3例動物模型成功案例,可見這種實驗原型起搏器在心內膜起搏的長期工作需要進一步證實。相對而言,目前有一些單腔無導線起搏Nanostim和Micra聯合全皮下ICD(implantable cardioverter defibrillator, ICD)的報道。如果將其列入雙腔無導線起搏(除顫)治療范疇,則雙腔無導線起搏治療已有臨床可行性證據。臨床上有治療成功的案例,如2017年報道的Micra聯合全皮下ICD置入,患者自發室速后Micra支持下ICD完成有效除顫,這足以證實該技術的前景[16]。
3 無導線起搏器在左心室起搏中的應用
2001年發表的MUSTIC(Multisite Stimulation in Cardiomyopathy, MUSTIC)研究顯示了CRT(cardiac resynchronization therapy)使癥狀性心衰伴左心室射血分數減低、QRS時限延長的患者獲益。研究提出CRT通過協調左右心室收縮以及房室傳導時間來改善左心室收縮功能、逆轉負性重塑,明顯減低心力衰竭相關住院率及死亡率,并改善患者生存率和生活質量[17]。通過冠狀竇(coronary sinus, CS)電極進行左心室心外膜起搏是CRT的首選方法,但30%~40%的患者卻對這種傳統的CRT無反應[18]。CRT反應是多因素決定的,其中包括了適應證的選擇、器械程控、合并癥以及心力衰竭的藥物治療等。8%~10%的CRT適應證患者存在解剖異常,包括沒有合適的CS靶點、上腔靜脈堵塞、膈神經刺激或瘢痕區起搏導致的閾值異常升高等,這些都會導致CRT反應不佳甚至不得不放棄傳統CRT治療。在CARE-HF研究(Cardiac Resynchronization-Heart Failure study)中首次置入CRT患者就有12%存在左心室電極無法植入問題,這其中50%是由于無法找到CS或合適靶靜脈,而且即便是CS電極置入成功也無法達到收縮最延遲部位存活心肌而無法獲益于雙室起搏[19]。在冠狀靜脈起搏失敗患者中,可以嘗試外科心外膜電極置入以及穿間隔的方法,雖然方法有效但是亦要警惕其并發癥和死亡率增加的風險。
基于上述問題,無導線左心室心內膜起搏在心臟再同步化治療領域逐漸顯現優勢。無導線左心室起搏(WiSE-CRT, EBR Systems, Sunnyvale, California)意為將小型無導線起搏電極經股動脈置入左心室心內膜,這一操作簡便且無需長期抗凝。WiSE-CRT在左心室心內膜置入接收電極,通過皮下置入肋間的脈沖發生器來傳輸超聲波進行無導線起搏。WiSE-CRT需要與同時安裝的傳統右心室起搏器配合工作組成雙心室心內膜起搏(BiV ENDO)才能發揮CRT功能。WiSE-CRT感知右心室起搏后,傳輸聲能到達左心室電極引起左心室起搏,從而完成右心室和左心室的幾乎同步起搏。WiSE-CRT(Wireless Stimulation Endocardially for CRT)研究證實了無導線超聲介導左心室心內膜起搏的可行性[20]。研究中,入選患者均已置入起搏裝置如起搏器或ICD,并符合以下條件:①之前冠狀竇電極置入失敗;②之前冠狀竇電極成功置入但是臨床無反應或③需要升級成CRT。裝置細節和置入過程如圖5所示[21]。首先經導管置入左心室起搏電極后再行外科皮下置入脈沖發生器。WiSE-CRT裝置需要同時置入標準的起搏器、經靜脈ICD或傳統CRT裝置達到同步化雙室起搏。傳輸器和電池包膜的外面有感知電極,用以感知置入起搏器的右心室起搏脈沖。當右心室起搏脈沖被感知后,WiSE-CRT系統即刻觸發超聲波轉化接收轉換為電能,起搏左心室。整個過程幾乎同時發生,足以達到雙室起搏(右心室起搏脈沖的感知時間和左心室起搏的時間延遲差僅為3~5ms)。從有效性看WiSE-CRT的結果很好,在術后6個月隨訪中患者左心室功能得到明顯改善,且無需終身抗凝,70%患者術后心功能得到明顯改善。雖然最初進行到第17例時心包壓塞發生3例,導致其安全性遭到質疑,但經過后續技術設備改良結果樂觀。
如上所述,經過不斷探索,為避免置入過程中遞送鞘管對左心室心內膜面的損傷,起搏器的遞送系統設計得到不斷改進。在SELECTIVE-LV研究(Safety and Performance of Electrodes Implanted in the Left Ventricle)中,遞送鞘管遠端設計的球囊裝置可以大大減少對左心室心內膜的創傷。對于傳統CRT左心室電極無法置入的患者,SELECTIVE-LV研究結果如下:①左心室無線起搏置入成功率高(97%);②85%患者術后心力衰竭臨床綜合評分改善;③52%患者術后6個月心臟超聲顯示CRT超反應(左心室收縮末容積減低≥15%)。在PROSPECT(Predictors of Response to CRT)研究中,69%患者臨床綜合評分得到改善,56%患者左心室收縮末容積縮小>15%[22]。另外在SELECTIVE-LV研究中,也有再同步化治療后心臟電重構的證據,可能與CRT超反應相關。該試驗中無術后心包積液病例,也沒有術中相關的即刻不良事件發生,證實了WiSE-CRT系統的臨床可行性。可見,對于需要CRT升級、或從未接受CRT治療或已接受CRT治療后無反應的患者,他們有CRT適應證卻由于上述原因無法置入傳統左心室電極,左心室無導線起搏治療在這類人群中的應用有廣闊前景。
圖5 左心室內膜下無導線起搏器 a~b.逆向遞送鞘管輸送起搏電極至左心室內膜并定位后釋放;c.起搏電極的實際照片和尺寸;d~f.示無導線起搏裝置,以及整個裝置置入術后1天拍攝的后前位及側位X線影像,虛線圈內為無導線左心室起搏電極
如前所述,在臨床研究中獲益的患者均是傳統CRT無反應或者由于解剖因素不能進行傳統左心室電極置入者。值得關注,心內膜下左心室起搏的前景靈活,尤其在選擇避開瘢痕組織以及膈神經刺激等靶點方面心內膜左心室起搏更有優勢。心內膜下起搏在心肌激活模式上更加接近生理性起搏,因此在改善血流動力學及縮窄QRS時限方面較心外膜起搏具有更多臨床獲益,且左心室心內膜起搏減低心室復極化離散度,與心外膜起搏比較亦可更好的減少心律失常發生[23]。CRT無反應的因素并非單一,但至少無導線起搏器會有助于解決其中左心室電極置入困難、左心室瘢痕或冠狀竇解剖異常等相關的問題,從而增加CRT手術成功率。WiSE CRT系統可謂走向無導線CRT的第一步,緊接著出現的新型心律調節系統(Boston Scientific Inc, USA)也已經開始臨床試驗應用,這一系統是由抗心動過速左心室無導線起搏與皮下除顫器通過無線連接協調工作組成[24]。總之,無導線雙心室起搏心內膜與傳統CRT孰優孰劣,目前的研究結果仍很樂觀。
4 總 結
目前的一體化無導線起搏器最主要的局限性是只能提供單腔起搏,即右心室單腔起搏,其頻率適應功能的可靠性和安全性尚需要長期隨訪。作為新興技術,我們需要專業的培訓機制以期達到置入技術的精細化和正規化。如果考慮其長期的性能和未來拔除的需要,無導線起搏器固定機制仍需進一步探索優化。對于大多數竇房結功能障礙的患者,無導線右心室單腔起搏器因為需要從雙腔起搏/感知獲益所以并不適宜[25]。隨著多腔起搏(房室和雙室)逐漸發展,無導線多腔起搏從原型變成臨床應用所面臨的挑戰也在增加,比如器械之間的通訊以及固定機制(在組織結構特殊的右心房)等。毋庸置疑,心臟起搏器的未來方向仍是最小化,無導線起搏器作為這一階段的變革性技術,不論從安全性角度還是從遠期起搏和感知功能上都應優于傳統起搏器,故仍需進一步技術性探索和臨床隨機試驗來迎接尚未解決的問題。

