新型冠狀病毒肺炎重癥患者合并急性腎損傷的發病機制及用藥建議
賴水容,安會杰,蕭偉斌,2,季 波,2
(1. 中國人民解放軍南部戰區總醫院,廣東 廣州 510010; 2. 軍隊支援湖北醫療隊,湖北 武漢 430000)
新型冠狀病毒(SARS-CoV-2)屬于冠狀病毒科,可通過血管緊張素轉換酶2(ACE2)侵入靶細胞[1]。《新型冠狀病毒肺炎診療方案(試行第七版)》(簡稱《第七版方案》)指出,SARS-CoV-2 感染可累及肺、心肌、肝臟、腎臟、腦、消化道等多個器官[2]。急性腎損傷(acute kidneyinjury,AKI)會加快新型冠狀病毒肺炎(COVID-19)重癥患者病情進展,是患者死亡的獨立危險因素。AKI是一種常見臨床急癥,以腎功能迅速下降為臨床特點,最終導致急性腎衰竭,病因多樣,如缺血再灌注、腎毒性物質、感染等[3]。現結合COVID-19 重癥患者的臨床特征及AKI 的常見病因,對重癥患者合并AKI 的可能機制進行分析,同時對腎功能損傷患者的用藥進行總結,供抗疫一線醫師與藥師參考。
1 臨床特征
錢志成等[4]回顧性分析了50 例重型和危重型COVID-19 病例的流行病學及臨床資料,臨床表現以發熱(100%)、咳嗽(90%)為主;實驗室檢查多數白細胞正 常(72% ),淋 巴 細 胞 減 少(30% ),炎 性 因 子 升 高(73.9%),可伴有肝、腎功能障礙(10%和14%)和細胞免疫功能下降(42.3%和37.8%);44%的患者入院時有中重度低氧血癥,需要高流量和無創通氣及以上呼吸支持治療。
徐申等[5]研究了62 例危重型COVID-19 患者的病情特征及其發生AKI 的特點,18 例患者出現AKI,發生率為29.0%,其中9 例接受連續性腎臟替代治療(CRRT);所有COVID-19 患者均接受呼吸支持治療,AKI 患者的呼吸支持力度高于非AKI 患者;危重型COVID-19 患者病死14 例,總體病死率22.6%,合并AKI 患者病死率為44%。
盧子龍等[6]研究了101 例COVID-19 患者臨床特征、免疫功能表現及其在病情分級中的作用,重癥組患者平均年齡、伴有基礎疾病的比例顯著增加;重癥組患者中細胞免疫檢測CD3,CD4,CD8,CD19,CD16+CD56細胞計數明顯低于非重癥組(P <0.05),體液免疫檢測IgG,IgM,IgA,IgE,補體C3,補體C4則無明顯差異。
可見,COVID-19 重癥患者以發熱、咳嗽為主要臨床表現,伴有外周血淋巴細胞減少、炎性因子水平升高、肝腎功能障礙,以及細胞免疫功能下降,多數需要呼吸支持治療,合并AKI 的患者需接受CRRT。
2 致AKI 的可能機制
2.1 缺血再灌注損傷(IRI)
IRI 是臨床AKI 的重要發病機制,常見于器官移植手術、中毒性休克、彌漫性血管內凝血和急性失血等過程中[3-6]。國內首例COVID-19 患者尸檢病理報告顯示,肺部有大量透明膜形成,符合急性呼吸窘迫綜合征(ARDS)的病理變化[7]。ARDS 患者肺泡的炎性滲出及透明膜覆蓋阻礙了空氣中的氧氣順利交換入血,導致腎臟氧供不足,進而使腎功能受損。為改善患者氧合情況,減少肺泡的水腫滲出,ARDS 患者通常需要限制液體入量[8],但又可能導致患者易因灌注不足而出現腎前性腎損傷。此外,ARDS 患者在氧合不佳情況下通常需要呼吸機輔助通氣供氧,有研究發現,有創通氣治療是AKI的危險因素[9]。可見,IRI 很可能是COVID-19 重癥患者發生AKI 的機制。
2.2 藥物損傷
大多數藥物主要經腎排泄,藥物的不合理使用甚至濫用有可能導致藥源性腎損傷。藥物誘導的腎損傷可影響腎血管、腎小球、腎小管和腎間質[10]。藥源性腎損傷的發生機制主要涉及直接作用、氧化應激作用、免疫炎癥作用、酸堿平衡紊亂、藥物影響轉運蛋白5 類[11]。1)藥物直接毒性作用:藥物的排泄主要經過腎小球濾過、腎小管分泌和吸收,腎臟有濃縮尿液的功能,易形成高濃度的藥物或其代謝物溶液,破壞腎小管運輸作用,破壞蛋白合成等損害腎臟,特別是近端小管更易遭受損傷;2)氧化應激作用:氧化應激的主要特點是活性氧簇和活性氮簇的增加,其直接和間接影響腎臟的各個方面,如損傷細胞組織功能,影響腎血流動力學、腎小球濾過、腎小管再吸收和分泌;3)免疫炎癥作用:藥物或其代謝物通過激活適應性免疫而導致腎臟疾病;4)酸堿平衡紊亂:藥物可通過外源性酸負荷、內源性酸增加、胃腸道或腎臟中碳酸氫鹽減少、胃酸排泄減少等途徑引起體內代謝性酸中毒;5)藥物作用于轉運蛋白:通過作用于轉運蛋白,增加藥物攝取或減少藥物排泄,從而導致藥物的蓄積造成腎損傷。
目前,SARS-CoV-2 尚無特效的疫苗和治療藥物,感染患者以支持治療為主。《重癥新型冠狀病毒感染肺炎診療與管理共識》中,重癥患者治療推薦意見包括呼吸支持、激素、抗病毒藥物、抗菌藥物,其他支持治療及預防并發癥治療。其中,治療相關的抗病毒藥物與抗菌藥物使用不當可能會導致腎功能損傷。
2.3 膿毒癥
膿毒癥是感染引起的全身炎性反應。膿毒癥引發系統性細胞因子-趨化因子響應,有可能導致腎臟終末器官損傷。急性腎小管壞死一般是由IRI 和細胞因子介導的炎癥反應共同驅動的膿毒癥引起的。膿毒癥的發生過程中,腎小管細胞損傷是由于AKI 的蔓延,腎小管細胞凋亡,胞內線粒體功能異常導致的氧化應激,以及局部微循環障礙等系統性膿毒癥的應答反應,在膿毒癥AKI的病理過程中發揮了重要作用[3]。目前,已有大量研究明確,COVID-19 重癥患者的淋巴細胞水平呈進行性下降[4,12],患者免疫功能受損,易合并多種細菌、真菌感染,甚至進展為膿毒癥。因此,SARS-CoV-2 感染引發的炎性因子風暴及因免疫功能受損導致的繼發感染可共同導致炎性因子對腎功能的損害。
3 合理用藥建議
AKI 是一組臨床綜合征,按照病因作用于腎組織的不同部位,可分為腎前性、腎后性、腎性。腎前性AKI 主要與血容量減少、心輸出量減少、腎血管嚴重收縮、腎動脈機械閉鎖等引起的腎臟灌流不足有關;腎后性AKI是指腎盂到尿道任一水平引起尿道梗阻所導致的AKI;腎性AKI 通常是指腎實質或腎血管疾病相關性AKI。目前的臨床證據表明,SARS-CoV-2 感染可引起腎臟損傷,而COVID-19 重癥患者導致AKI 的機制尚不清楚。
AKI 的治療措施主要包括盡早識別并糾正可逆病因、維持內環境穩定、營養支持、防治并發癥及腎臟替代治療等。《第七版方案》對腎功能衰竭和腎替代治療的建議是,重癥患者可選擇CRRT。臨床實踐證實,CRRT 可清除炎性因子、減輕炎癥相關的腎臟損傷,可為AKI 患者提供及時的腎臟替代,保證液體和營養補充及維持內環境的穩態[13-14]。
根據《第七版方案》,總結了指南治療藥物中避免應用與慎用的有腎毒性的抗病毒藥物與抗菌藥物,以及AKI 患者的劑量調整方案[15-17]。詳見表1 至表3。
4 結語
腎臟作為SARS-CoV-2 棘突蛋白受體ACE2 高表達的器官,首當其沖成為主要損傷靶點,感染者的尸檢腎臟病理提示嚴重的急性腎小管壞死[18]。腎臟損傷臨床指標包括血清肌酐、尿素氮升高,以及AKI、蛋白尿、血尿等,均是患者死亡的危險因素[13]。從IRI、藥物、膿毒癥等病因探討COVID-19 重癥患者導致AKI 的可能機制,可由此尋找相應的救治策略。腎功能損傷患者應首選無腎毒性的藥物,同時應根據肌酐清除率水平調整用藥,用藥全過程嚴密監測腎功能。對于COVID-19重癥合并AKI 患者,盡早行CRRT 干預治療,可能有助于改善患者預后。
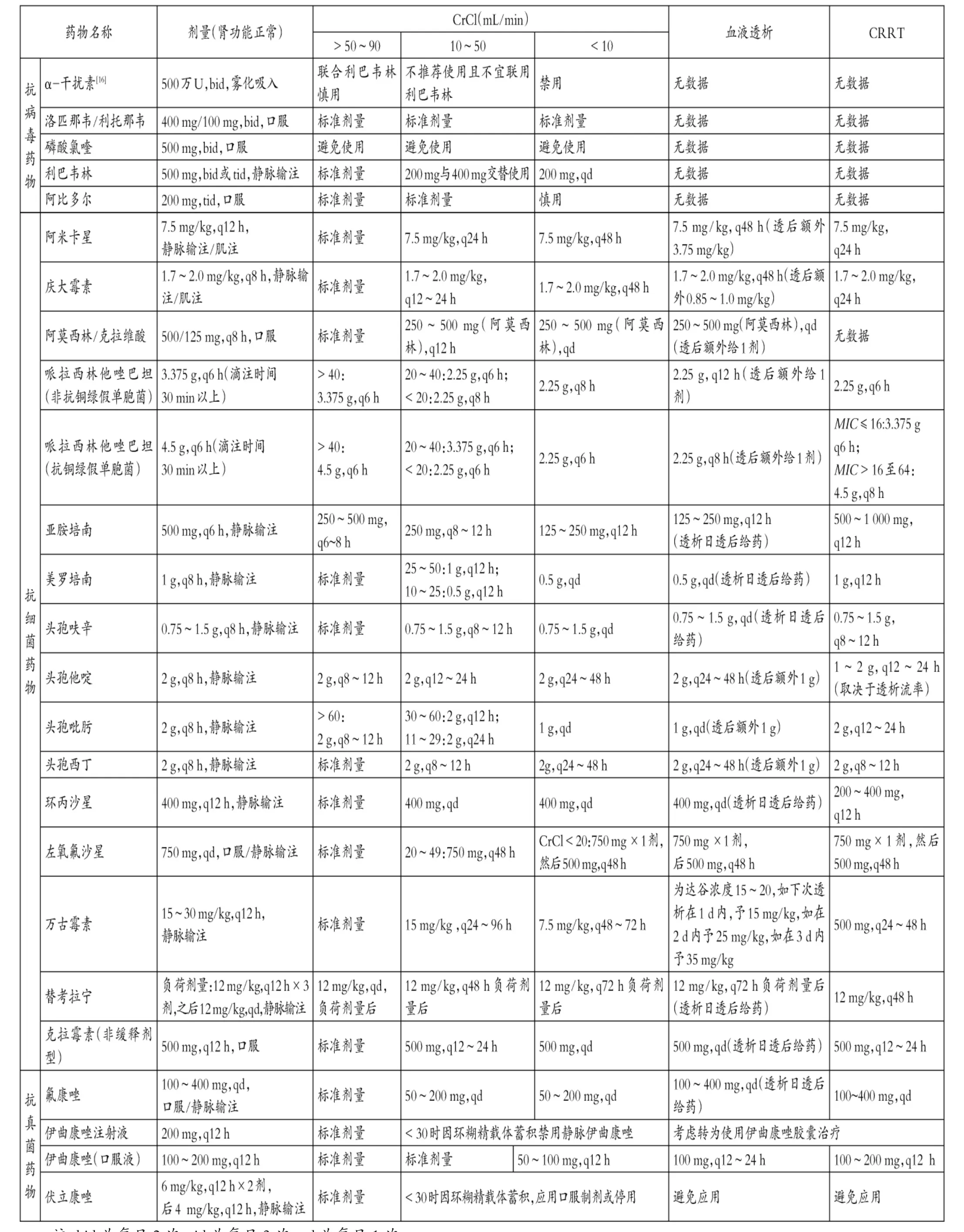
表1 需根據肌酐清除率(CrCl)水平調整的抗病毒藥物與抗菌藥物

表2 無需根據CrCl 水平調整劑量的抗病毒藥物與抗菌藥物

表3 避免應用與慎用的有腎毒性的抗病毒藥物與抗菌藥物

