健骨顆粒含藥血清調控miR-141對小鼠骨髓間充質干細胞成骨分化的影響
張楚天 張文明,2 林燕萍* 魏振樸 楊娟 張志恒 孫攀 王志強
1.福建中醫藥大學中西醫結合研究院,福建 福州 350122 2.河南省洛陽正骨醫院鄭州院區,河南 鄭州 450016 3.福建中醫藥大學針灸學院,福建 福州 350122
骨質疏松癥是一種發病廣泛而又隱蔽的退行性疾病,我國骨質疏松患者近九千余萬,其發病誘因多樣而絕經后骨質疏松癥是最常見的病型,所占比例高達80%[1-2]。骨質疏松癥的病理機制是骨骼吸收-重建動態平衡失調引起全身骨量降低和骨骼細微結構惡化[3],骨髓間充質干細胞(BMSCs)是骨髓基質內具有多種分化潛能的干細胞,作為成骨細胞的來源細胞之一,是影響骨骼吸收-重建動態平衡的重要因素。MiRNA是細胞內普遍存在的小分子RNA,在基因表達和傳遞中有著廣泛作用,當敲除小鼠BMSCs內一個miRNA合成必需的核酸內切酶后,BMSCs失去成骨分化功能[4],這一實驗提示miRNA與成骨分化有著相關性,進一步研究發現miRNA在BMSCs分化的各個階段均有著不同的影響[5]。Runx2是BMP信號通路中的關鍵成骨轉錄因子,其表達量被Dlx5及其同源異形基因Msx2共同調控,同時Runx2可以直接調控BMSCs細胞成骨分化[6]。課題組前期研究結果顯示:miR-141通過對Dlx5/Msx2/Runx2信號通路的負性調控作用來影響BMSCs的成骨分化。本文基于以上基礎,使用傳統補腎健脾方劑健骨顆粒提取含藥血清干預去卵巢模型小鼠BMSCs,從miR-141及其下游Dlx5/Msx2/Runx2信號通路的角度出發,探究健骨顆粒影響BMSCs成骨分化的可能機制。
1 材料和方法
1.1實驗藥物
健骨顆粒組方:煅狗骨、山茱萸、淫羊藿等藥物。藥物原材料福建省藥材公司,成藥由福建中醫藥研究院中試車間加工制備,顆粒劑含原生藥比率2.9∶1。
1.2實驗細胞及動物
雌性C57小鼠10只(清潔級),4周齡,體重23±2 g,購至中科院動物實驗中心(上海),動物合格證編碼:SCXK(滬)2013-0005,用于BMSCs細胞提取。雌性SD大鼠30只(SPF級),3月齡,體重265±20 g,購至中科院動物實驗中心(上海),動物合格證編碼:SCXK(滬)2012-0002,用于含藥血清制備。以上動物均飼養及實驗于福建中醫藥大學動物實驗中心SPF級實驗室(合格證編碼:閩SYXK 2009-0001)。
1.3主要實驗材料和試劑
青/鏈霉素、胰蛋白酶、PBS緩沖液由Hyclone公司提供,胎牛血清、α-MEM培養基由Gibco公司提供,CD29、CD34、CD44、CD45單克隆抗體由Abcam公司提供,茜素紅由Sigma公司提供,ALP檢測試劑盒由南京建成公司提供,Dlx5、Msx2、Runx2抗體由Santa Cruz公司提供,β-actin、鼠二抗、兔二抗、TRIZOL由北京全氏金生物技術有限公司提供,封閉液、5×蛋白上樣緩沖液、一抗稀釋液、SDS-PAGE凝膠試劑盒、SDS-PAGE電泳緩沖液、BCA蛋白濃度測定試劑盒、PMSF、RIPA、 Beyo plus超敏化學發光試劑盒由碧云天生物技術研究所提供,反轉錄試劑盒,SYBR Premix Ex TaqTM PCR Kit由大連寶生物公司提供。
1.4主要實驗儀器
倒置相差顯微鏡由TKO光學儀器株式會社提供,流式細胞儀由BD公司提供,Q-PCR儀由美國ABI公司提供。
1.5實驗方法
1.5.1含藥血清制備:30只三月齡大鼠,分別健骨顆粒和生理鹽水灌胃1周,通過大鼠體重按2 g/kg計算藥量,生理鹽水每日灌服量為2 mL。腹主動脈采全血后3 000 r/min離心15 min取上層血清,56 ℃水浴30 min,過濾除菌,-20 ℃冷凍備用。
1.5.2BMSCs細胞的培養和鑒定:卵巢切除法造摸,microCT三維圖像采集分析骨質疏松指標數據確認小鼠建模成功后取雙側股骨,α-MEM培養基(10% FBS)沖出骨髓,制備單細胞懸液置于37 ℃,5% CO2的培養箱培養10 d,待細胞鋪滿瓶底后棄培養液以1.25%胰酶消化傳代,鏡下觀察BMSCs形態變化。取第三代BMSCs制成單細胞懸液,加入抗體上流式細胞儀檢測。
1.5.3含藥血清誘導BMSCs分化情況:取第3代BMSCs加入成骨誘導培養液(β-磷酸甘油10 μmol/L、地塞米松10 μmol/L、維生素C 50 μmol/L、10% FBS)和10%濃度的含藥血清和空白血清成骨誘導,分別在誘導后第3、8、13天鏡下觀察兩組細胞形態變化;第8天,行ALP染色及定量;第13天,茜素紅染色檢測鈣鹽結節分布情況。
1.5.4實時熒光定量PCR檢測miR-141及DLx5、Msx2、Runx2的基因表達情況:成骨誘導第3代BMSCs,第13天提取總RNA,反轉錄后與相應的引物(如表1)結合,上機,反應均為20 μL體系。以U6作為miR-141的內參,β-actin作為Runx2、Dlx5、Msx2 mRNA的內參,校正各組樣品后對基因相對表達量進行計算。

表1 引物序列表Table 1 Primer sequence table
1.5.5Western blot檢測DLx5、Msx2、Runx2的蛋白表達情況:提取BMSCs總蛋白并用BCA法測取蛋白濃度,每泳道上樣蛋白樣品和預染蛋白標準品,電泳,電泳結束后濕轉法轉移膠上蛋白到PVDF膜。轉膜后將膜浸入封閉液,搖床上孵育2 h。加入一抗4 ℃過夜,取出PVDF膜,浸入TBST搖洗3次。加入二抗室溫下孵育1 h,取出PVDF膜,浸入TBST搖洗3次。顯影,使用Image Pro-plus program version 5.0圖象分析系統分析條帶。
1.6統計學處理
2 結果
2.1細胞表型鑒定
BMSCs表型鑒定結果(見圖1):CD29(88.8%)、CD44(94.3%)表達陽性;CD34(1.54%)、CD45(1.04%)表達陰性。
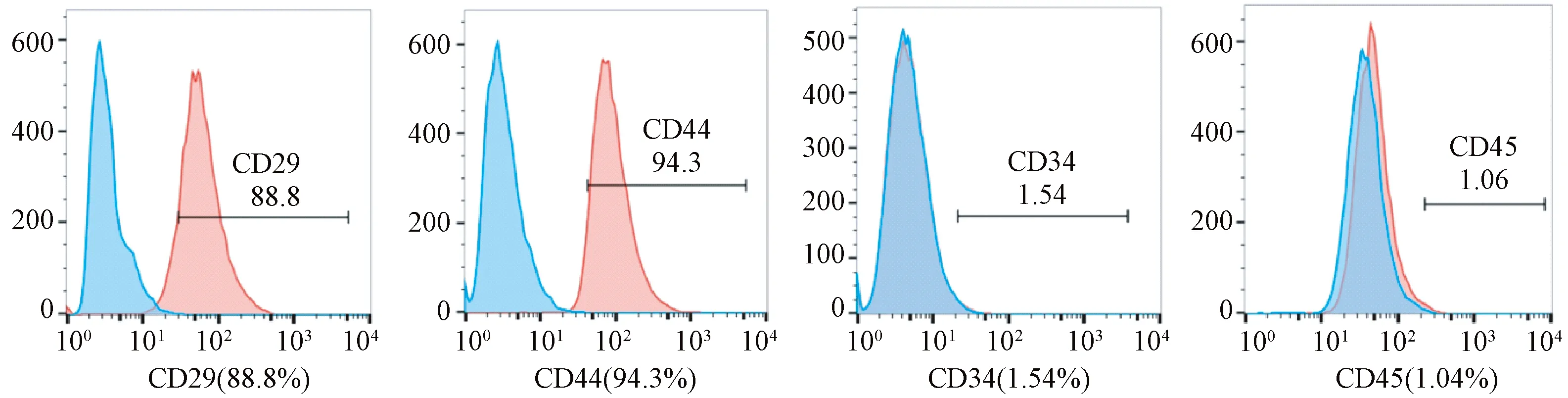
圖1 BMSCs細胞表型鑒定結果Fig.1 BMSCs cell phenotypic identification results
2.2BMSCs成骨分化結果
第2天,兩組細胞數量均稀少且無明顯差異,細胞形狀呈梭形或不規則形;第4天,兩組細胞數量有所增加,且些許細胞出現成對核,細胞形狀為圓形或不規則形的多核細胞出現,空白血清組多核細胞出現較少;第6天,細胞數量密集,含藥血清現成群的細胞開始聚集且在群落中散布有結晶顆粒,而空白血清組細胞數量明顯低于含藥血清組,且細胞群落間結晶群稀疏(見圖2)。

圖2 BMSCs成骨分化結果Fig.2 BMSCs osteogenic differentiation results
成骨誘導后第8天進行ALP染色,空白血清為淺藍色,含藥血清組顯示藍紫色(見圖3)。ALP定量檢測顯示,含藥血清組的ALP定量結果顯著高于空白血清組(P<0.05)。第13天行茜素紅染色,染色后有深紅色鈣化結節散布,但空白血清組鈣化結節較少,呈點狀分布,無大的鈣化結節;含藥血清組鈣化結節明顯增多,呈珠狀廣泛分布,有大面積的甚至成片連接的鈣化結節出現(見圖4)。
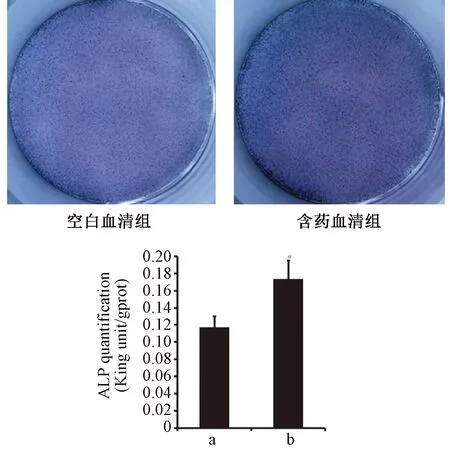
圖3 ALP染色及定量結果注: a 空白血清組; b 含藥血清組;與空白血清組比較,*P<0.05。Fig.3 ALP staining and quantitative results
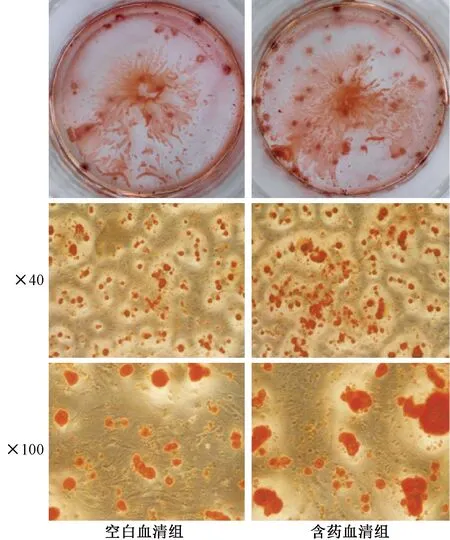
圖4 茜素紅染色結果Fig.4 Alizarin red staining results
2.3RT-PCR檢測成骨基因表達結果
RT-PCR檢測miR-141及Dlx5、Msx2、Runx2的基因表達情況(見表2):含藥血清組和空白血清組比較,含藥血清組miR-141及Msx2的基因表達較空白血清組明顯下降(P<0.01),Dlx5、Runx2的基因表達顯著升高(P<0.01)。
表2RT-PCR檢測成骨基因表達結果
Table2Detection of osteogenic gene expression results by RT-PCR

組別miRNA-141Dlx5Msx2Runx2空白血清組1.0001.0001.0001.000含藥血清組0.500±0.021??2.390±0.106??0.330±0.014??3.620±0.241??
注:與空白血清組比較:*P<0.05,**P<0.01。
2.4Western blot檢測成骨蛋白表達結果
Western blot檢測成骨誘導第13天DLx5、Msx2和Runx2蛋白表達情況:含藥血清組Msx2較空白血清組稍有下降(P<0.05),而Dlx5和Runx2的蛋白表達相對升高(P<0.01),三者的蛋白變化情況與RT-PCR結果基本一致(見圖5,表3)。

圖5 Western blot檢測成骨蛋白表達結果Fig.5 Western blot analysis of osteogenic protein expression results
表3Western blot檢測成骨蛋白表達結果
Table3Western blot analysis of osteogenic protein expression results

組別Dlx5Msx2Runx2空白血清組0.330±0.0120.800±0.0250.532±0.046含藥血清組0.430±0.019??0.498±0.096?0.830±0.043??
注:與空白血清組比較:*P<0.05,**P<0.01。
3 討論
BMSCs作為成骨細胞的主要來源細胞之一在骨質疏松的研究中有著至關重要的地位,雌激素降低影響著BMSCs的命運,其成骨分化降低導致骨量丟失是絕經后骨質疏松的病理機制,因此BMSCs可以作為闡釋補腎健脾類中藥治療絕經后骨質疏松機理的切入點[7]。中藥或復方水提取液干預體外細胞是中藥研究的常用方法,但是這種方法的嚴謹性目前存在爭議,主要矛盾集中于藥物在體內代謝后的產物不確定性和藥物成分自身的復雜性,這兩點的存在會一定程度上影響實驗結果的準確性[8]。含藥血清就是對以上不足的改進,通過模擬體內代謝的方法減少了實驗的誤差,使實驗更加科學[9]。miRNA是維持干細胞特征和特性的關鍵遺傳因子[10],對干細胞生長和分化的各個階段有著綜合性的調節作用[11]。研究發現miR-141-3P作為Wnt靶基因通過Wnt通路抑制人間充質干細胞的增殖和成骨分化[12],同時課題組前期研究也明確了miR-141與BMP/Smad信號通路及骨代謝中間的關聯[13]。因此,以miRNA為“鑰匙”來揭示中醫藥抗絕經后骨質疏松癥的機理成為了當前研究的重心[14]。
流式細胞計數法鑒定提取的BMSCs細胞顯示:造血干細胞及白細胞表型的CD 34、CD 45表達為陰性,細胞間充質干細胞表型的CD 29、CD 44表達均呈陽性,既全骨髓培養法提取的細胞滿足實驗需要。課題組前期研究表明,健骨顆粒有促進成骨分化的功效,且含藥血清濃度為10%時干預效果最佳,該功效歸因于健骨顆粒的類植物雌激素樣作用[15]。此類作用在成骨分化的多個階段均有體現,ALP染色及定量的實驗中含藥血清組明顯優于空白血清組,同時茜素紅染色結果同ALP染色結果一致,進一步印證健骨顆粒的促成骨分化作用。該作用可能歸功于健骨顆粒組方中淫羊藿、煅狗骨、山茱萸等補腎壯骨中藥,朱曉峰等[16]通過研究傳統補腎陽中藥淫羊藿發現,其主要藥理成分淫羊藿苷在體內可代謝為淫羊藿素,淫羊藿素可以發揮類雌激素樣作用激活BMP/Smad信號通路促進成骨細胞分化。Smads蛋白作為胞內信號傳遞的中介因子,是BMP 信號傳動及轉導的關鍵一環,Smads蛋白整合多種不同信號進而轉換成一種總的效應來調節目標靶基因的轉錄[17]。BMP與細胞表面受體結合后,細胞內Co-Smad與Phosho-R-Smad形成復合物后進入細胞核內結合于DNA序列上,協同其他轉錄因子相互作用,促進Dlx5表達,而Dlx5增高可以激活Runx2的表達[18],而這一系列反應中的共激活因子可能就是miR-141類的短基因片段[19]。RT-PCR結果顯示,含藥血清組miR-141及Msx2的基因表達量明顯低于空白血清組,而Dlx5、Runx2的基因表達結果剛好相反,Western blot檢測結果同RT-PCR結果一致,說明健骨顆粒可以通過影響miR-141表達水平來調節BMSCs成骨分化,即健骨顆粒的類雌激素作用可以抑制miR-141的表達,從而降低miR-141對Dlx5表達的抑制,高表達的Dlx5競爭結合能力增強,相對地降低了其同源異形基因Msx2對Runx2表達的抑制作用,Runx2表達水平升高促進BMSCs成骨分化。
總之,健骨顆粒可以通過抑制BMSCs中miR-141的內源性表達水平來緩解去卵巢早期雌激素急劇下降導致的Dlx5/Msx2降低,進而調高的Runx2表達,促進成骨分化,達到防治絕經后骨質疏松的目的。

