注射劑一致性評價關鍵技術要點
文/ 張亞蘭,陳艷,石可欣,黃勁,劉文利,陳洪
企業在注射劑一致性評價研究過程中,會遇到與包材選擇的諸多問題——本文將結合國內外注射劑包材生產研發現狀以及研發項目經驗,討論注射劑包材質量對產品關鍵質量屬性的影響。本討論僅限于包材選擇對關鍵質量屬性的影響。
2017年10月8日,中共中央辦公廳、國務院辦公廳印發《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》。2017年12月22日和2018年3月14日,國家食品藥品監督管理總局藥品審評中心相繼發布《已上市化學仿制藥(注射劑)一致性評價技術要求(征求意見稿)》和《藥物注射劑研發技術指導意見》的通知。業內期待已久的注射劑一致性評價正式啟動。
2019年10月15日,國家藥品監督管理局綜合司再次公開征求《化學藥品注射劑仿制藥質量和療效一致性評價技術要求(征求意見稿)》《已上市化學藥品注射劑仿制藥質量和療效一致性評價申報資料要求(征求意見稿)》意見,關于注射液一致性評價的技術要求更加明確。

《化學藥品注射劑仿制藥質量和療效一致性評價技術要求(征求意見稿)》中,對注射劑一致性評價的總體要求、參比制劑、處方工藝、原輔包質量控制、質量研究與控制、穩定性等各個方面做出了較為詳細的技術要求和指導。其中,關于包材的選擇與研究最為核心的要求是:注射劑使用的包裝材料和容器的質量和性能不得低于參比制劑,以保證藥品質量與參比制劑一致。
依據以上指導原則,未要求注射液包裝材料必須與參比制劑相同,包材的選擇重點是為了保證產品質量與參比制劑一致,包材的性能不低于參比制劑,達到保證產品質量穩定的目的。
1 玻璃安瓿和玻璃小瓶
根據BEROE的市場調查報告[1],安瓿和玻璃瓶在非胃腸道給藥包裝中占最大的市場,高達70%以上。在過去幾年里,玻璃分層脫片,以及市售藥品中可見和亞可見的薄片顆粒物的問題大大增加,導致了許多召回事件,如:注射用夫西地酸鈉(立思丁)產品的玻璃瓶內發現玻璃碎片,少量甲氨喋呤注射液產品的藥液內存在玻璃碎屑,Hospira公司的卡鉑、阿糖孢苷、紫杉醇等系列產品出現可見異物。以上召回事件的主要原因在于包材脫片產生玻屑,然而其他許多的召回事件如穩定性留樣檢驗不合格,也與包材有一定的關系。
實際上,分層是玻璃表面化學侵蝕的結果,除了導致形成玻屑脫片之外,還可以產生與藥物制劑的相互作用以及藥物功效的降低影響,甚至會出現玻璃元素浸入制劑中引起不可預測的副作用,比如某些生物制品的蛋白質吸附會導致其貨架期縮短,又或者玻璃浸出的金屬離子會影響未緩沖藥物制劑的pH值,導致穩定性下降,從而導致治療功效的下降。
玻璃包材中發生的化學反應取決于許多因素,包括玻璃包材的類型、玻璃的組成、藥液pH值范圍、化合物性質、儲存時間和溫度、包材的生產工藝以及滅菌過程,即使僅改變一個變量,也會影響玻璃表面的性質。玻璃通過離子交換(酸性藥物制劑)和溶解(堿性制劑)被水侵蝕。離子交換使得水浸入玻璃,導致玻璃中的堿離子被交換釋放進入藥液中,堿性制劑的溶解是通過氫氧根分解硅酸鹽的主鏈,兩種機制都可輕易導致玻璃表面分離出浸出層。即使pH值偏中性的制劑也會與玻璃發生效應,比如某些用磷酸鹽緩沖液配制的藥物,其中的磷酸鹽會與玻璃反應,形成易剝落的浸出層。
玻璃成分和制造工藝會影響玻璃表面抵抗與藥液相互作用的能力。與國內指導原則相同,美國、歐洲所有注射制劑必須儲存在I型玻璃容器中[2],并滿足耐水性的要求。即使這樣,來自不同制造商的I型玻璃的成分也可能有很大差異。
關于成型工藝,模制瓶的制作過程為一步高溫工藝,該工藝導致玻璃表面具有較高的堿性物質,而管制瓶則分兩步成型,通常是由硅含量較高的玻璃制成的。一般情況下管制瓶比模制瓶更耐化學腐蝕。以下我們將從玻璃成分以及制造工藝方面淺析對藥物制劑的影響。
(1)玻璃瓶成分對產品質量的影響
參考ISO 12775:1997分類方法,根據三氧化二硼含量和平均線熱膨脹系數的不同將玻璃分為硼硅玻璃和鈉鈣玻璃,本處僅討論中硼硅玻璃。通常藥用玻璃包含二氧化硅、三氧化二硼、三氧化二鋁、氧化鈉、氧化鉀等成分,每種比例在一定范圍內波動,不同的制造商的配比也不相同。表1列出的是國外某公司藥用玻璃成分[3],玻璃類型均符合歐美藥典和ASTME-438的I型玻璃容器標準。
玻璃中不同的組分含量可對藥物制劑的穩定性產生影響,比如配方3中的三氧化二鐵。對于光敏感的制劑,包材的選擇可考慮遮光容器來減小光照帶來的影響,常規的遮光包材如棕色的玻璃容器,是加入鐵、錳、鈦等過渡金屬氧化物形成著色玻璃以產生遮光效果。
對于金屬離子敏感的制劑,棕色包材往往會影響成品的有關物質。例如,某鹽酸注射液對光和金屬離子均敏感,表2為采用相同的藥液、不同的包材篩選出的研究數據,不同包材均來源于同一包材廠家。研究數據可見,棕色玻璃安瓿的批次與其他批次相比,滅菌后,有關物質較大,穩定性更差。
對于以上類型問題的建議是選擇不含三氧化二鐵等氧化成分的包材,采用包材外部覆膜方法阻隔光線接觸藥液。比如采用玻璃小瓶盛裝的某注射劑,FDA原研說明書中提到,該藥品所采用的西林瓶外有一層覆膜,該膜為避光保護膜,材料是PET膜,可解決金屬離子敏感的問題。
玻璃的成分還影響玻璃的分層脫片,使藥物制劑產生可見異物問題。美國康寧公司研究表明,雖然中硼硅玻璃比傳統玻璃呈現較好的性能,但還是存在分層脫片問題,而玻璃脫片的根本原因在于硼。在玻璃管加工小瓶過程中,小瓶底部切割會導致硼元素和鈉元素的蒸發,引起脫片問題。這也是某些特殊產品與硼硅玻璃存在相容性問題的原因。解決這種特殊產品相容性問題的方法之一是使用無硼的含硅鋁酸鹽配方的玻璃材質,與硼硅酸鹽相比可消除分層,且對于濃度小的藥液具有穩定作用。圖1為硼硅玻璃和鋁硅玻璃燒制樣圖。圖中可明顯觀察到不同玻璃成分在燒制過程中會導致玻璃表面附著的金屬離子不同,進而影響產品質量。
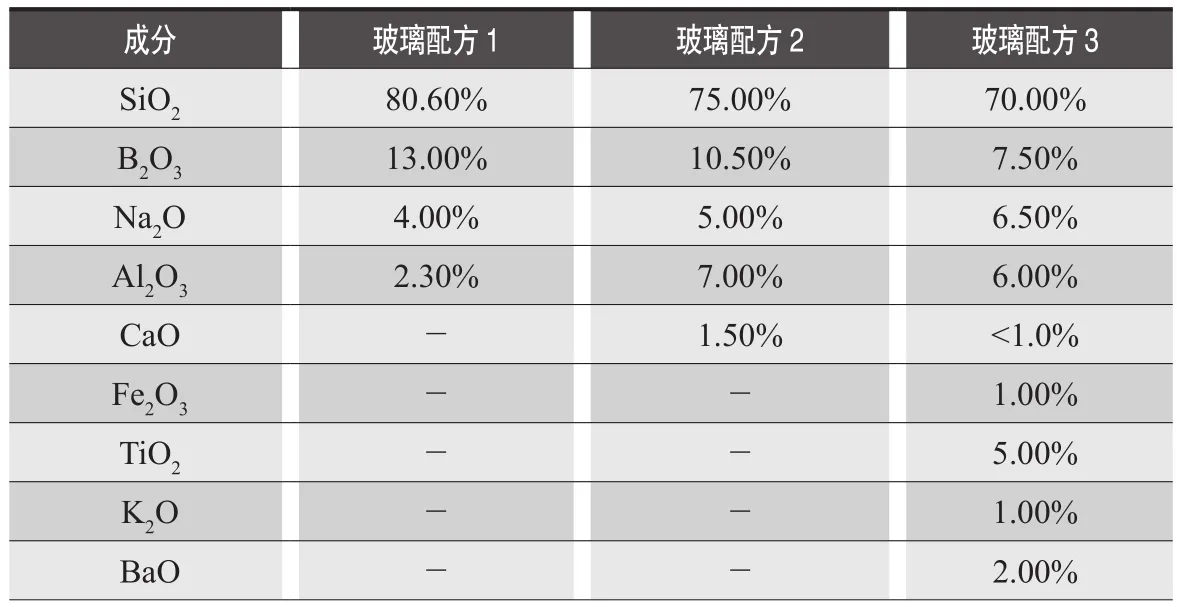
表1 國外某公司藥用玻璃成分

表2 不同包材對相同藥液的影響
(2)玻璃瓶制備工藝對產品質量的影響
中硼硅玻璃含硼量較大,有的配方鋁含量較多,在玻璃融化過程中面臨著粘度大,熔化溫度較高等問題。由于對成型的玻璃管材尺寸要求嚴格,其玻璃氣泡含量,玻璃溶體的化學均勻性,溫度均勻性要求較高。國內外多采用全氧燃燒電助熔輔助工藝,配合丹納法或維羅法拉管成型。表3為國外玻璃生產廠商的制作方法[4]。

圖1 硼硅玻璃和鋁硅玻璃燒制樣圖
國內廠家由于旋轉管等管材質量不穩定,基本進口德國肖特、美國康寧、日本NEG等公司的玻管進行后加工處理,后加工處理包括成型和覆膜工藝。管制瓶的成型工藝大致分為加熱、拉伸、退火、切割、二次退火、冷卻,其中加熱溫度、時間,拉伸力度、機器運行速度以及退火溫度和切割速度均會影響成型質量,同時安瓿生產方向(立式/臥式),生產線與玻璃廠家的選擇相關。
成都苑東生物制藥股份有限公司正在研究的一個注射液產品易氧化,pH值穩定性差,在包材廠家的篩選試驗中顯示同一管材不同廠家對制劑影響明顯不同,如表4所示。
除了成型工藝外,生產廠家還可以對玻璃內壁進行覆膜。對包材內部進行涂層覆膜是一種有效解決藥液與包材相互作用的方案。
目前市面上可提供各種覆膜用以改善藥用玻璃的耐化學性。比如在退火步驟之前將硫酸銨噴入玻璃內側,以降低玻璃表面的堿度。或使用薄石英(SiOx)涂層來抑制水擴散。特別對于生物制品,均勻的二氧化硅膜可以有效地阻止API與玻璃表面之間的相互作用,從而最大程度地減少API的吸附并延長保質期。有玻璃制造商采用等離子脈沖化學氣相沉積(PICVD)將幾層二氧化硅分子(厚度為100~200 nm)附于玻璃瓶的內表面。這種膜不影響小瓶的尺寸,可以提供有效的屏障以防止水的擴散。據該公司稱經過檢測驗證,該涂層覆膜可減少放射性診斷產品和蛋白質的吸附,提高包裝材料的耐化學性和穩定性,此外它還可以降低離子從玻璃表面的浸出率小于檢測水平。
另一種是用于藥物小瓶的疏水涂層,該涂層也可通過PICVD進行涂覆。疏水涂層的表面光滑,非常適合凍干產品以延長其保存期限。帶有疏水涂層的小瓶的表面均勻,可防止凍干成分粘附到瓶的內壁。使用這種玻璃瓶的凍干產品具有良好的外觀,并能在水中更快地重新溶解。同時另一個好處是,抽取時幾乎沒有藥物制劑殘留在小瓶中。使用傳統的藥用容器時,有10%~20%的成分會粘附在粗糙的玻璃內表面上,藥品生產商須增加藥液填充量,確保可抽取體積合格。當使用帶有疏水涂層的小瓶時,過量填充量可大大減少,從而節省大量成本。
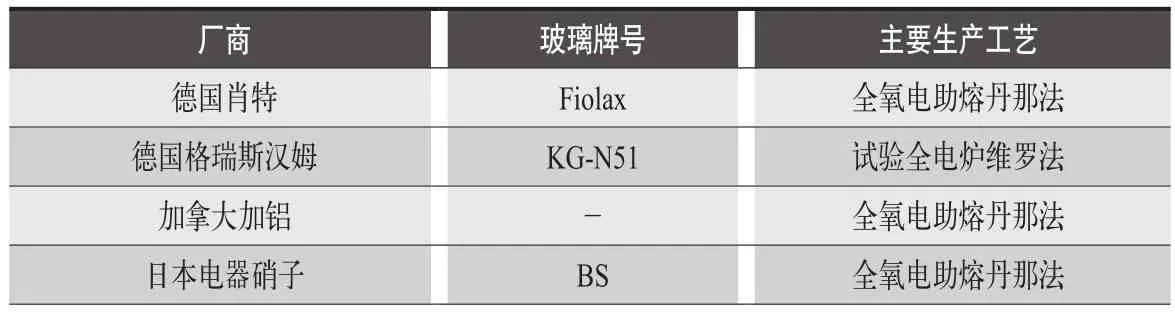
表3 國外玻璃生產廠商的制作方法
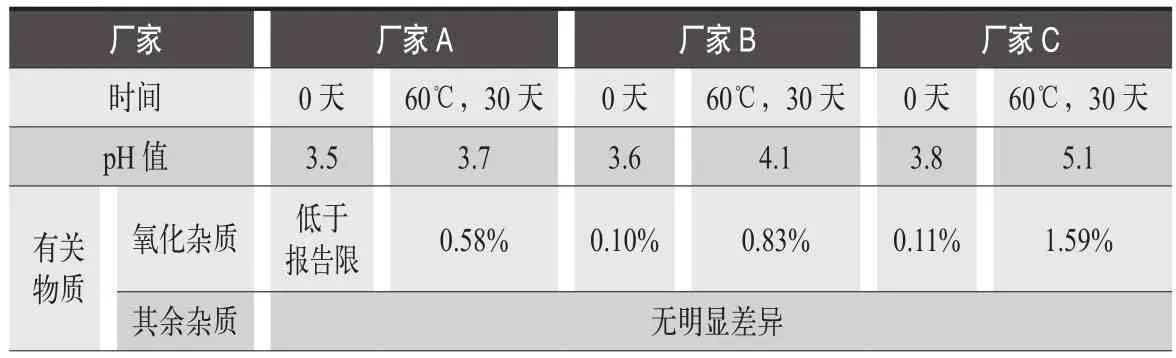
表4 不同包材廠家的篩選試驗
另外,由歐盟資助的項目“高性能玻璃態系統的粘附力和內聚力”(ADGLASS)是一種新型的涂層技術,可以改變與玻璃材料的界面,以減少對藥液的影響。通過量子建模技術,開發蛋白質在氧化物(二氧化硅和二氧化鈦)與水之間的界面的原子吸附模型,以及模擬玻璃薄層的機械和化學機械性能裂紋擴展界面。結合理論評估進行實驗研究,創建了聚乙二醇(PEG)類抗粘等離子體涂層,覆于藥用玻璃小瓶內壁。與參考樣品瓶相比,PEG類涂層明顯降低吸附,最高可達20倍以上的吸附降低。
在使用覆膜玻璃容器同時需考慮涂層與藥液的影響以及自身的降解,圖2為涂層發生的降解[5]。
2 膠塞
橡膠塞在國內制藥行業應用廣泛,作為藥品包裝常用的橡膠按材料劃分主要有:聚異戊二烯橡膠、丁基橡膠及鹵化(溴化/氯化)丁基橡膠等;按工藝劃分主要有:覆膜工藝、涂膜工藝和鍍膜工藝等。橡膠成分復雜,通常包括生膠、硫化體系(硫化劑、硫化促進劑、硫化活性劑),補強劑、填充劑、軟化劑等,因此在使用過程中,經常與藥品發生作用,導致樣品關鍵質量屬性發生變化,影響產品安全有效性。在此,我們圍繞膠塞對注射劑的CQA的影響進行討論,為大家在日常選擇膠塞時提供一些參考。
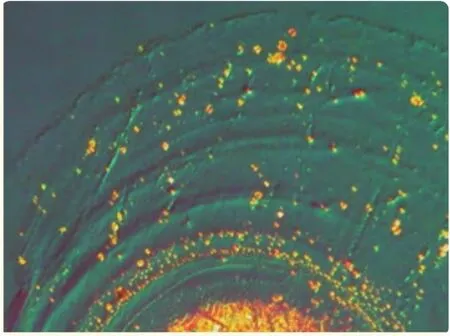
圖2 涂層發生的降解
(1)對產品水分的影響
凍干產品的水分控制是產品的關鍵,凍干水分的控制包含凍干工藝對于水分的控制以及凍干產品穩定性期間的水分增長的控制。凍干工藝對于水分的控制一般容易達到,但貯存期間水分的增長影響因素較多。通常凍干產品貯存期間水分的增長伴隨著有關物質的增長,所以水分的控制非常關鍵。不同膠塞配方和不同膠塞處理方式,均會導致產品在穩定性期間水分的變化差異以及穩定性差異。
例如,成都苑東生物制藥股份有限公司研發的另一個注射用產品對水分非常敏感,在凍干出箱后檢測水分僅1.4%左右,60±2℃條件下考察10天,水分升至2.5%左右,逼近限度3.0%,有關物質水平已超出標準規定。我們研究了不同廠家膠塞及膠塞的不同處理方式對產品的影響,使用不同廠家的膠塞及不同方式處理的膠塞制備樣品,考察了樣品的水分變化情況。具體結果見表5。
結果顯示不同廠家的膠塞之間水分有明顯差異,制備的產品穩定性也有較大的差異;就膠塞本身而言,經過蒸汽滅菌后,水分顯著升高,膠塞的水分隨著干燥時間的增長,變得越低。膠塞水分越低的產品在放置考察中,水分的增長趨勢越緩,產品的有關物質也控制在規定范圍內,沒有超出限度。通過延長膠塞清洗滅菌后的干燥時間嚴格控制膠塞的水分,得到了質量穩定的產品。
膠塞的水分與膠塞本身的配方有密切關系,膠塞配方眾多,其鹵化形式主要有氯化和溴化,已有膠塞廠家證明,不同配方的膠塞測出的殘留水分不同,4種配方膠塞的水分測定結果為丁基1(無氯化)<溴化=氯化<丁基2(無氯化)。目前國外有較多凍干使用了半覆膜/全覆膜膠塞,所用的膜材料一般具有較強的耐水蒸氣透過性,可用于水分敏感的凍干制劑中。
(2)對產品含量的影響
在研究過程中,我們需要關注低劑量注射液產品研發中膠塞對主藥的吸附。有文獻報道,鹽酸胺碘酮的5%葡萄糖溶液在玻璃瓶內,加橡膠塞放置一段時間后,接觸橡膠塞的藥液濃度減少了10%~14%,不接觸的未見下降。Burrell在試驗中觀察到純乳膠橡膠可以吸附溶液中的苯酚、三氯叔丁醇、氯化甲酚等[6]。
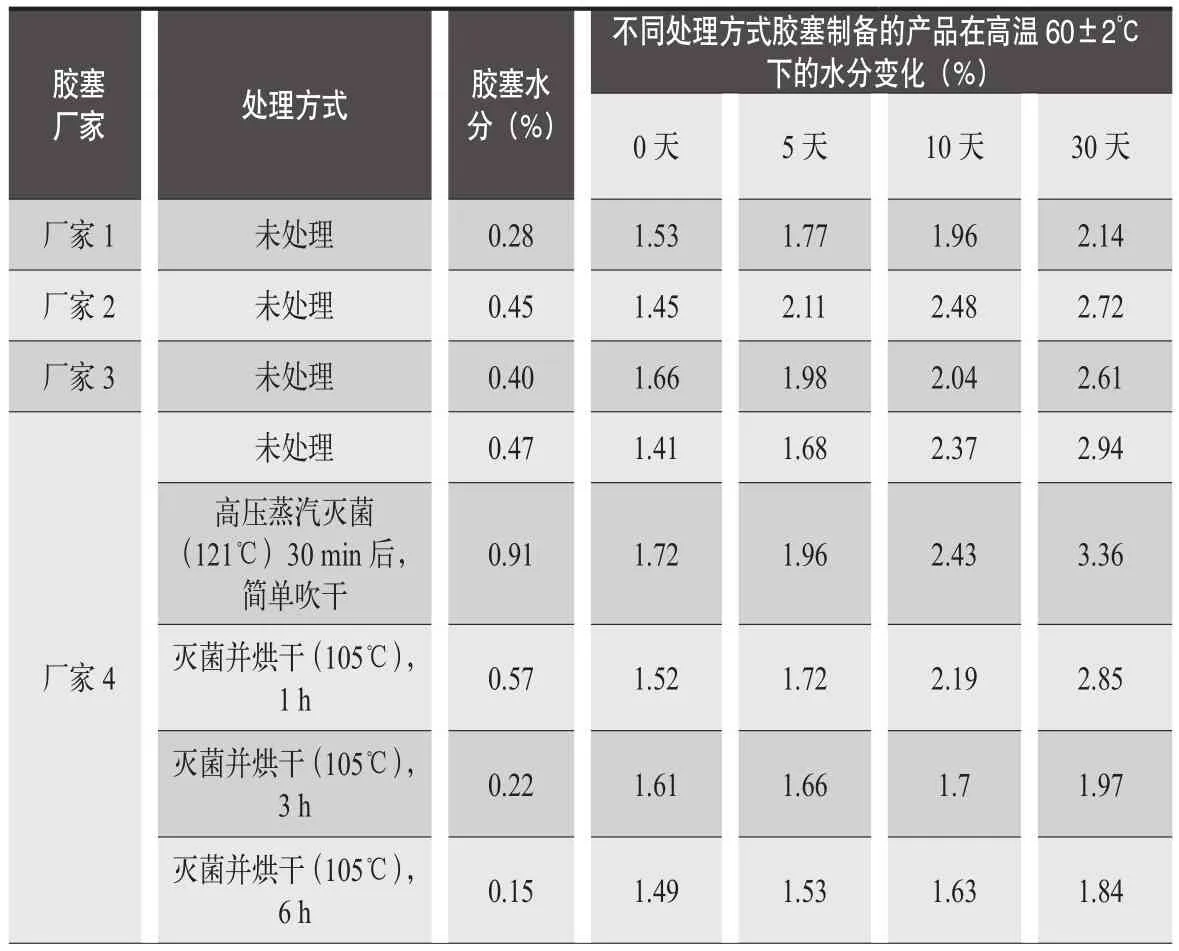
表5 膠塞制備樣品的水分變化
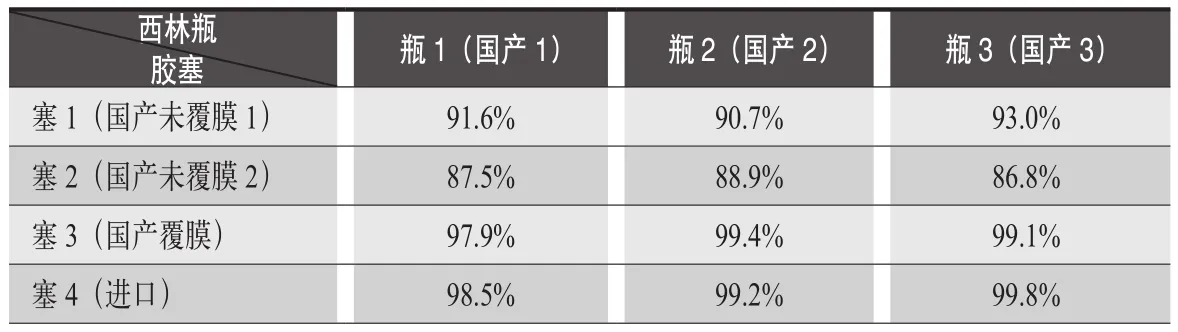
表6 不同廠家的西林瓶及膠塞的對比研究
在另外一個注射液研發中,成都苑東生物制藥股份有限公司選用國內某廠家的氯化丁基膠塞,進行小試研究時發現,產品按照處方量進行配液后灌裝前藥液含量結果合格,但經過灌裝、滅菌后檢測成品含量減少約10%,而產品的有關物質并無明顯升高。我們取來三個廠家的西林瓶及三個廠家的膠塞進行了對比研究。結果見表6。
我們發現使用國產覆膜膠塞和進口膠塞制備的成品含量沒有降低,其余樣品含量降低嚴重。不同廠家的膠塞之間,配方、加工工藝均有差異,導致膠塞對產品的吸附有較大差異。
(3)對產品不溶性微粒和可見異物的影響
導致產品不溶性微粒不合格的因素主要有,表面硅油量過大、藥品pH值、膠塞內部遷移的物質等。
膠塞中加入了大量附加劑,如促進劑B-硫基苯駢噻唑、二硫化四甲基秋藍姆、防老劑N-苯基B萘胺、填充劑氧化鋅、碳酸鈣及硫化劑等,膠塞與內容物接觸后,其中一些物質遷移進入產品,使藥液出現異物或渾濁。如頭孢唑林鈉粉針,衛生部抽檢藥品時發現許多廠家生產的頭孢唑林鈉粉針的澄清度不合格,楊華山進行了丁基膠塞對頭孢唑林鈉粉針澄清度的影響研究,發現不同廠家生產的丁基膠塞對頭孢唑林鈉粉針澄清度的影響程度不同;而且藥粉與丁基膠塞接觸的程度及時間不同,其澄清度不同;直立放置,藥粉與丁基膠塞接觸的程度小,所受到的影響小;接觸的時間越短所受到影響越小[7]。
膠塞硅化主要是為了藥物的分裝,膠塞硅化與不硅化,其與分裝機軌道的摩擦阻力相差50~100倍。硅化過度易造成壓塞反彈、跳塞或走機落塞,增加藥品污染的風險。硅化也是一種污染,在產品高壓滅菌時,硅油會從膠塞中釋放出微粒,影響藥品的澄清度。有研究證明pH值大于10的藥品與藥用氯化丁基橡膠塞接觸后,可使樣品中的不溶性微粒顯著增加,為避免此類藥品與藥用氯化丁基橡膠塞接觸后對不溶性微粒的影響,可以考慮使用覆膜藥用氯化丁基橡膠塞[8]。
3 小結
注射劑屬于高風險產品,影響藥品質量的因素很多,由上文討論可以看到,包材質量的影響絕對不容忽視。如何才能做到注射劑使用的包裝材料和容器的質量和性能不得低于參比制劑,以保證藥品質量與參比制劑一致呢?
首先,需要對參比制劑包材進行充分的反向解析,了解其可能配方與基本性能特點。選擇材質與基本性能不低于參比制劑包材的包裝材料作為研究備選材料。其次,對擬研究的產品性質特點需要充分掌握,抓住可能影響產品CQA的包材因素進行科學的試驗篩選,通過實驗結果確定這些影響因素,從而選定包材型號和生產廠家。這里的核心點是要保證藥品質量與參比制劑一致。最后更重要的一點是要保證產品質量能夠穩定重現,這不僅取決于包材的選擇,也是建立包材質量控制策略的體現。不難看出,未來制藥企業對包材的供應商選擇、供應商管理、內部質量協議等都將有一些新的升級,保證包材質量的穩定,從而確保藥品質量的穩定性。
在注射劑一致性評價研究過程中,包材的選擇與研究越來越重要。在注射劑整個生命周期中對包材的質量管理也將成為產品質量控制的重點。

