右歸丸通過PI3K/Akt/mTOR信號通路對膝骨關節炎模型鼠軟骨組織保護作用的研究
顏春魯 李盛華 安方玉* 孫仕華 劉永琦,2 藺興遙,2 張艷霞 楊譯 馬正民 牛彥強
1. 甘肅中醫藥大學,甘肅 蘭州 730000 2. 敦煌醫學與轉化省部共建教育部重點實驗室,甘肅 蘭州 730000 3. 甘肅省高校中(藏)藥化學與質量研究省級重點實驗室,甘肅 蘭州 730000 4. 蘭州市第二人民醫院,甘肅 蘭州 730000
骨關節炎(osteoarthritis,OA)是一種常見于中老年人群的慢性關節退行性疾病,以關節軟骨的退變為主要病理特征[1-2]。在OA的發病中,以膝骨關節炎(knee osteoarthritis,KOA)最為常見。KOA是一種以膝骨關節軟骨退化損傷、關節邊緣和軟骨下骨反應性增生為特征的慢性關節炎疾病[3]。近年來人們對 KOA的防治逐漸聚焦于關節軟骨。有研究證實,減少基質金屬蛋白酶和一些炎癥因子的分泌可以抑制KOA的炎癥反應,從而緩解關節軟骨的退變[4]。也有研究發現,mTOR具有調控KOA關節軟骨退變的作用[5]。同時發現,自噬相關蛋白Beclin1、LC3在正常軟骨中穩定表達,而在退變的軟骨(OA)中 Beclin1、LC3的表達是降低的[6]。因此,mTOR和Beclin1可能成為OA 治療的新靶點,通過抑制mTOR的表達和增強Beclin1 的表達,有可能保護關節軟骨的完整性和延緩關節軟骨的退變,進而探索出一種防治骨關節炎的新療法。我們采用改良Hulth法制備KOA模型大鼠,通過觀察右歸丸對KOA模型大鼠炎癥細胞因子、基質金屬蛋白酶和磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)、蛋白激酶B(protein Kinase B,Akt)、哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信號通路的相關因子表達的影響,探討右歸丸防治KOA的分子機理,為右歸丸的臨床應用提供實驗依據。
1 材料和方法
1.1 材料
1.1.1動物:選取SPF級4~6月齡SD大鼠60只,雌雄各半,體重(180±20)g,購自我校科研實驗動物飼養中心。動物質量合格證號:SYXK(甘)2015-0005。
1.1.2試劑與藥物:水合氯醛(天津市光復精細化工研究所,批號:20150105);反轉錄試劑2×prime script RT master mix(大連寶生物工程有限公司,批號: AI20 775 A); 熒光定量SYBR P Remix EX TaqⅡ(美國Promega公司,批號為:0000304040);GAPDH抗體(Immuno Way,批號:B4501); Rabit Anti-PI3K Polyclonal Antibody(Abcam,批號:GR3192684-3);Rabit Anti-pAkt Polyclonal Antibody(Gene Tex,批號:821801334);Rabit Anti-pmTOR Polyclonal Antibody(Immuno Way,批號:B1107);Rabit Anti-Beclin1 Polyclonal Antibody(Gene Tex,批號:821801315);右歸丸(仲景宛西制藥股份有限公司,國藥準字Z41022170,批號:151108);硫酸氨基葡萄糖片(保節力,新興同仁藥業有限公司,國藥準字H20041317,批號:160302);青霉素(河北制藥股份有限公司,國藥準字:H13020657,批號:F6042103)。
1.1.3儀器:BioMATE 3S型蛋白、核酸濃度測定儀(Thermo公司);ChemiDocTMXRS+
型凝膠成像分析系統(美國Bio-Rad公司);BX53型顯微鏡(日本OLYMPUS公司);ZY12306型微量加樣器(ScienTiFic產品);C1000型PCR熱循環儀(美國ABI公司);LightCycler 96型 Real Time PCR System(美國羅氏公司);TGL16 M型臺式高速冷凍離心機(凱達集團成員高科技公司);OSE-Y10型電動組織研磨器(上海Tiangen 公司)。
1.2 方法
1.2.1實驗藥物的給藥劑量:右歸丸的臨床用量為27 g/d,以人與大鼠的體表面積換算法所得的右歸丸劑量(27 g×0.018×5≈2.4 g/kg)作為實驗的中劑量。則右歸丸高、中、低劑量分別為4.8、2.4、1.2 g/kg。
1.2.2動物分組、造模及給藥:60 只 4~6月齡的SD 大鼠飼養 1 周后,隨機分為假手術組、模型組、硫酸氨基葡萄糖組、右歸丸高劑量組、右歸丸中劑量組和右歸丸低劑量組,每組10只。參照文獻[7-8],模型組及干預組采用改良Hulth 法復制KOA模型。腹腔注射10 %水合氯醛(0.3 mL/100 g)麻醉各組動物,無菌條件下縱向切開雙側膝關節內側,切口約長2 cm,逐層分離并暴露關節腔,剔除膝前后交叉韌帶、內側副韌帶及內側半月板,注意關節軟骨面勿損傷。用潔凈的5 mL注射器吸取生理鹽水沖洗關節腔3~5次,行抽屜試驗陽性后徹底止血,逐層縫合。假手術組 SD 大鼠從膝關節內側只打開關節腔,不破壞韌帶和半月板,并保留關節軟骨面。術后連續 3 d肌肉注射青霉素 20 萬U/d,各組大鼠均在相同條件下,自由飲水,攝食。手術造模 6 周后,HE染色法觀察假手術組和模型組關節軟骨的病理形態學改變,以關節軟骨邊緣嚴重破壞,軟骨細胞排列紊亂作為模型制備成功的標志。將造模成功的動物給予藥物干預,硫酸氨基葡萄糖組灌服硫酸氨基葡萄糖(0.17 g/kg),右歸丸高、中、低劑量組分別按 4.8、2.4、1.2 g/kg灌服相應的藥物,干預 8周。股動脈采血處死各組動物,摘取雙側膝關節,左側膝關節固定于4 %多聚甲醛,右側膝關節于-80 ℃冰箱保存備用。
1.2.3指標測定:①HE染色觀察軟骨的形態改變:將固定于4%多聚甲醛的左側膝關節進行脫鈣處理后,采用石蠟包埋法制作蠟塊,并用切片機切片,切片厚度約5 μm,HE 染色,封片、鏡檢并進行 Mankin 評分,具體評分標準參考文獻[9]進行。②軟骨組織IL-1β、MMP-3和MMP-13的基因表達測定:用 RNA抽提試劑提取軟骨組織RNA,BioMATE 3S型蛋白、核酸濃度測定儀測定 RNA 含量。用Promega 試劑盒說明書步驟合成 cDNA 第一鏈,按Promega實時熒光定量試劑盒操作說明書進行 PCR 反應,反應條件:預變性 95 ℃、2 min, 變性 95 ℃、15 s,退火 58 ℃、45 s,延伸 60 ℃、 1 min,共 45 個循環。每個樣品各重復 3 次,數據經 2-ΔΔCt處理后進行IL-1β、MMP-3和MMP-13基因相對表達量分析。③軟骨組織PI3K、pAkt、pmTOR和 Beclin1的蛋白表達測定:軟骨組織蛋白質的提取用 RIPA 裂解液,蛋白質含量的測定用BCA 法,并調整點樣的蛋白質濃度為50 μg /10 μL,10 μL/每孔,作SDS-PAGE、轉膜、封閉、滴加抗Rabit Anti-PI3K Polyclonal Antibody、Rabit Anti-pAkt Polyclonal Antibody、Rabit Anti-pmTOR Polyclonal Antibody和Rabit Anti-Beclin1 Polyclonal Antibody 等抗體孵育過夜,滴加山羊抗兔IgG二抗孵育。將ECL Plus 超敏發光液的A 和 B溶液等體積混勻后滴加于二抗孵育過的PVDF膜上,暗室放置 1 min后置于 Image Lab 3.0 進行曝光(單個曝光時間10 s,總曝光時間60 s)。
1.3 統計學處理
2 結果
2.1 膝關節軟骨組織形態學變化
采用HE染色法對各組動物的軟骨形態學改變進行了觀察,結果顯示:假手術組大鼠關節面光滑平整,滑膜結構完整,軟骨細胞呈水平排列;模型組大鼠關節軟骨邊緣嚴重破壞,軟骨細胞排列紊亂;右歸丸低、中劑量組關節軟骨邊緣不平整,軟骨細胞排列紊亂;右歸丸高劑量組和硫酸氨基葡萄糖組大鼠軟骨結構趨于正常,軟骨細胞分布偶見不均,關節軟骨表面欠光滑。Mankin評分結果顯示:模型組大鼠Mankin評分較假手術組升高(P<0.01);右歸丸高劑量組和硫酸氨基葡萄糖組大鼠Mankin評分較模型組均降低(P<0.05或P<0.01)。見表1和圖1。

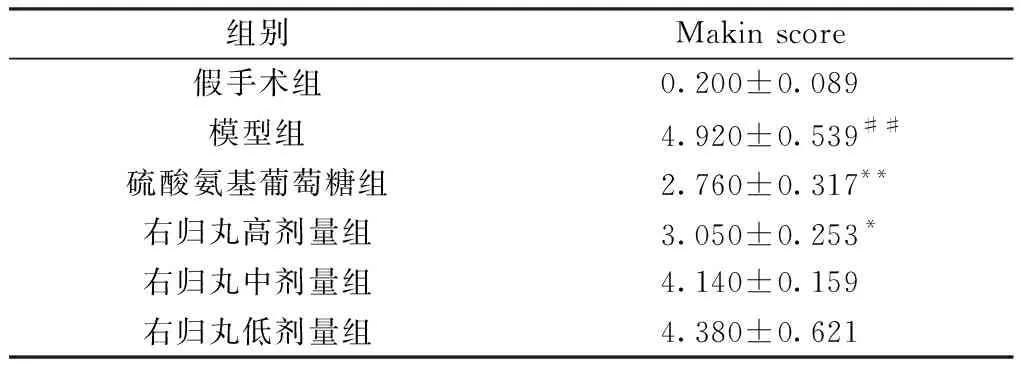
組別Makin score假手術組0.200±0.089模型組4.920±0.539##硫酸氨基葡萄糖組 2.760±0.317**右歸丸高劑量組 3.050±0.253*右歸丸中劑量組4.140±0.159右歸丸低劑量組4.380±0.621
注:與假手術組比較,##P<0.01;與模型組比較,*P<0.05,**P<0.05。
2.2 對軟骨組織IL-1β、MMP-3和MMP-13基因表達的影響
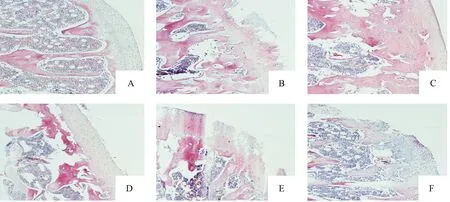
圖1 各組動物軟骨組織的病理形態改變(HE,200×)注:A假手術組;B 模型組;C 硫酸氨基葡萄糖組;D 右歸丸高劑量組;Fig.1 The pathomorphological changes of the cartilage in each group(HE,200×)E 右歸丸中劑量組;F 右歸丸低劑量組。
模型組大鼠軟骨組織IL-1β、MMP-3和MMP-13的基因表達較假手術組顯著升高(P<0.01);右歸丸各干預組和硫酸氨基葡萄糖組IL-1β、MMP-3和MMP-13的基因表達較模型組均顯著降低(P<0.01)。見表2。
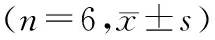

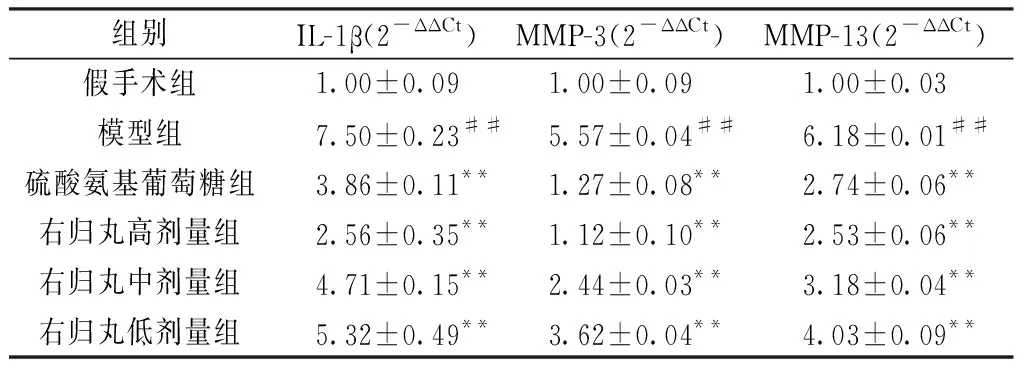
組別IL-1β(2-ΔΔCt)MMP-3(2-ΔΔCt)MMP-13(2-ΔΔCt)假手術組1.00±0.091.00±0.091.00±0.03模型組7.50±0.23##5.57±0.04##6.18±0.01##硫酸氨基葡萄糖組3.86±0.11**1.27±0.08**2.74±0.06**右歸丸高劑量組2.56±0.35**1.12±0.10**2.53±0.06**右歸丸中劑量組4.71±0.15**2.44±0.03**3.18±0.04**右歸丸低劑量組5.32±0.49**3.62±0.04**4.03±0.09**
注:與假手術組比較,##P<0.01;與模型組比較,**P<0.01。
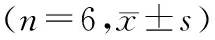
表3 右歸丸對KOA模型大鼠PI3K、pAkt、pmTOR和 Beclin1蛋白表達的影響Table 3 Effect of Yougui pill on the protein expressions of PI3K, pAkt, pmTOR, and Beclin1 in KOA
注:與假手術組比較,##P<0.01;與模型組比較,*P<0.05,**P<0.01。
2.3 對軟骨組織PI3K、pAkt、pmTOR和Beclin1蛋白表達的影響
模型組大鼠PI3K、pAkt和pmTOR等蛋白表達較假手術組均明顯升高,Beclin1的蛋白表達較假手術組明顯降低(P<0.01);右歸丸各干預組和硫酸氨基葡萄糖組PI3K蛋白表達較模型組均明顯降低,右歸丸中、高劑量組和硫酸氨基葡萄糖組pAkt和pmTOR等蛋白表達較模型組均明顯降低,右歸丸高劑量組和和硫酸氨基葡萄糖組Beclin1的蛋白表達較模型組明顯升高(P<0.05或P<0.01)。見表3和圖2。
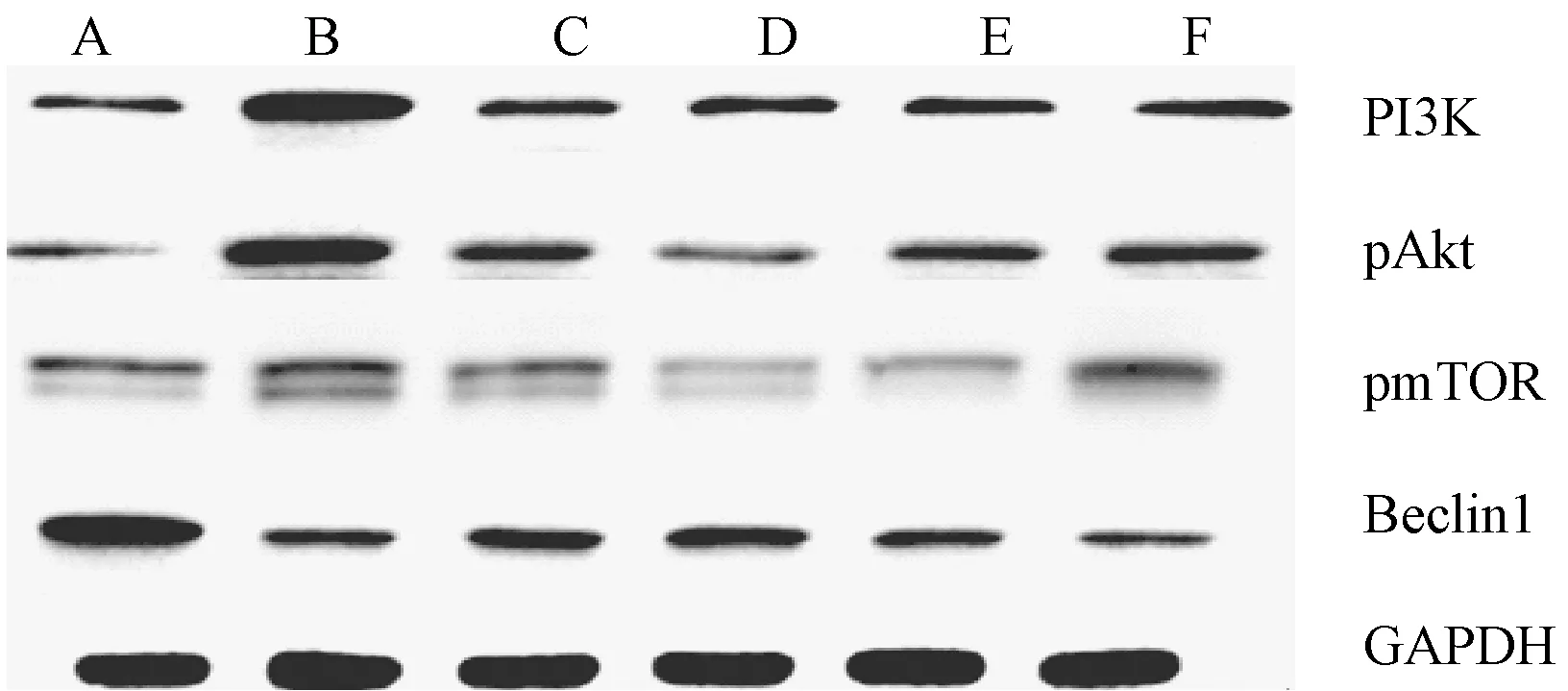
圖2 各組大鼠軟骨組織PI3K、pAkt、pmTOR和Beclin1蛋白的表達注:A 假手術組;B 模型組;C 硫酸氨基葡萄糖組;D 右歸丸高劑量組;Fig.2 Protein expressions of PI3K, pAkt, pmTOR, and Beclin1 of cartilaginous cell in each groupE 右歸丸中劑量組;F 右歸丸低劑量組。
3 討論
mTOR是一種與細胞增殖、細胞生長及細胞分化密切相關的絲氨酸/蘇氨酸蛋白激酶[10]。目前已發現,以 mTOR 為交匯點的上游信號通路主要有PI3K/ Akt/mTOR 信號通路、AMPK/mTOR 信號通路和某些氨基酸對mTOR的激活通路。有研究證實,PI3K/ Akt/mTOR 信號通路主要參與調控細胞凋亡和細胞自噬[11]。目前有研究認為,KOA的發生是機體PI3K/Akt/mTOR信號通路激活的結果[12]。PI3K/Akt/mTOR信號通路激活以后,可以影響下游多種效應分子的活化狀態,從而抑制細胞自噬[13]。Beclin1是 PI3K/Akt /mTOR信號通路中重要的負調控分子,Beclin-1是一種參與自噬體形成與成熟的調控蛋白質,在細胞增殖、凋亡、代謝等機制中發揮重要的調控作用,Beclin1是重要的KOA治療靶點[14-15]。有研究[16-17]報道,Becn1和 LC3的表達在關節炎軟骨細胞中是減少的,mTOR在小鼠膝關節炎的關節軟骨細胞中的表達是增加的。也有研究[18]報道,OA軟骨的退行性病變可能是通過抑制自噬信號通路的來調控的。在本研究中觀察到,模型組PI3K、pAkt和pmTOR等的蛋白表達均明顯升高, Beclin1的蛋白表達明顯降低,說明PI3K 能與 mTOR 協同參加信號通路轉導,以調控 KOA大鼠的細胞自噬。而給予右歸丸干預后,右歸丸能降低KOA模型鼠PI3K、pAkt和pmTOR等的蛋白表達,升高Beclin1的蛋白表達,這說明右歸丸可能作為mTOR的負性調控因子,能促進自噬,進而阻止軟骨組織的退變。
同時研究結果也發現,模型組IL-1β、MMP-3和MMP-13的表達也是增高的,說明KOA的病理演變與KOA患者機體自身分泌大量的炎癥因子和基質金屬蛋白酶有密切關系。這與以往的研究報道是一致的[4,19-20]。而給予右歸丸干預后,右歸丸能顯著降低KOA模型鼠IL-1β、MMP-3和MMP-13的表達,進一步說明,右歸丸可能通過抑制KOA患者的炎癥反應和軟骨細胞外基質的過度降解來延緩關節軟骨的退變。
由于KOA 的發生、發展涉及的發病機制非常復雜,炎癥因子的大量分泌導致基質金屬蛋白酶的活化可能是其原因之一;自噬基因及PI3K/Akt/mTOR信號通路對KOA 發生發展的調節作用可能是另一重要原因。因此本研究針對KOA模型大鼠PI3K/Akt/mTOR信號通路與自噬之間關系的探討,并通過右歸丸的干預研究,試圖揭示KOA 的發病機制及右歸丸的干預機制,為臨床治療KOA提供新的思路。但是在本實驗中,對炎癥因子和基質金屬蛋白酶的分泌與PI3K/Akt /mTOR信號通路的激活是否存在相關性未做研究,希望在今后的實驗中做進一步的深入研究。
綜上所述,通過不同濃度的右歸丸干預KOA模型大鼠后發現,右歸丸可以上調自噬相關因子的表達,抑制軟骨細胞凋亡,促進細胞生存,延緩骨關節的退變、促進骨關節的重構,這可能是其治療機制之一。

