阿伏加德羅定律的簡單應用
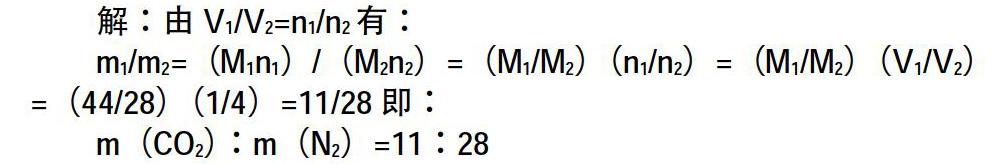


摘? 要:在原高中化學課本中,物質的量作為一章進行講述,而在新課標高中化學課本必修一中,作為一節進行描述,只簡單地把物質的量、氣體摩爾體積、物質的量深度進行描述、講解,可以說講述最簡單的是氣體摩爾體積。如果學生提出“氣體摩爾體積與處界條件的關系是什么?如何理解外界條件對于氣體的影響?”,我們是不是也應該像原課本中把所輔助講的“阿伏加德羅常數定律及其概論”介紹給學生呢?下面,筆者將淺談阿伏加德羅定律的簡單應用。
關鍵詞:物質的量;阿伏加德羅定律;簡單應用
物質的量是國際單位制中的基本物理量之一,為我們在化學中常用來衡量微觀世界的粒子與宏觀世界的物質間的關系。在原高中化學課本中,物質的量作為一章進行講述。在原高中化學課本第一冊第三章第二節中,對氣體摩爾體積不僅僅是簡單提出對氣體體積的影響因素,主要是粒子的數目,還在此說明了標準狀況下,任何氣體摩爾體積都為22.4L/mol。那么僅僅是這以簡單的說明氣體與外界條件的關系,是不是太簡單了?如果學生提出“氣體摩爾體積與處界條件的關系是什么?如何理解外界條件對于氣體的影響?”,我們是不是也應該像原課本中把所輔助講的“阿伏加德羅常數定律及其概論”介紹給學生呢?使學生能夠更好地理解“氣體摩爾體積”這一概念呢?
一、阿伏加德羅定律
“在相同的溫度、壓強下,相同體積的任何氣體都會有相同數目的分子”。這是意大利科學家阿伏加德羅提出的,當仁不讓如此命名。在該定律中有“四同”:同溫、同壓、同體積、同物質的量,那么這么講解,更讓學生能夠把氣體的體積和氣體物質的量充分聯系起來。
例1.在同溫同壓下,CO2和N2的體積比為1:4,那么CO2和N2質量比為多少?
解:由V1/V2=n1/n2有:
m1/m2=(M1n1)/(M2n2)=(M1/M2)(n1/n2)=(M1/M2)(V1/V2)=(44/28)(1/4)=11/28即:
m(CO2):m(N2)=11:28
二、阿伏加德羅定律
我們在向學生講完阿伏加德羅定律后,可以引導學生把阿伏加德羅定律推論中常用的公式推導出來。
1.同溫同壓下:n1/n2=V1/V2,即同溫同壓下,氣體的物質的量與其體積成反比。
2.同溫同體積下:n1/n2=P1/P2,即同溫同體積的氣體,其物質的量與壓強成正比。
3.同壓同物質的量下:V1/V2=T1/T2,即等物質的量的氣體,在壓強相同的條件下,體積與溫度成正比。
4.同溫同物質的量下:P1/P2=V2/V1,即等物質的量的氣體,在溫度相同的條件下,壓強與體積成反比。
5.同溫同壓下:ρ1/ρ2=M1/M2,即同溫同壓下,氣體的密度與其摩爾質量成正比。
6.同溫同壓同體積下:M1/M2=m1/m2,即同溫同壓下,體積相同的氣體,其摩爾質量與質量成正比。
7.同溫同壓同質量下:M1/M2=V2/V1,即同溫同壓下,等質量的氣體,其摩爾質量與體積成反比。
例2.在同溫同壓下,某一體積的燒瓶內裝滿N2質量為128g,裝滿O2質量為132g,那么如裝滿CO2,總質量為多少?
解:由同溫同壓下,V1/V2=n1/n2,在同一燒瓶中,為V1=V2,則n1=n2,設燒瓶內裝氣體的物質的量為xmol,燒瓶質量為yg,有:
28x+y=128
32x+y=132
解得:x=1,y=100,即:m(CO2)=44g/mol×1mol=44g
總質量為:44g+100g=144g
例3.在同溫同壓下,CO2與N2的混合氣體的平均密度是H2的1.5倍,那么CO2與N2的質量比為多少?
解:在同溫同壓下,ρ1/ρ2=M1/M2,有:M平=15×2=30.
即M平=m總/n總=[n(CO2)M(CO2)+n(N2)M(N2)]/[n(CO2)+n(N2)]=30g/mol.
則:n(CO2):n(N2)=1:7
m(CO2):m(N2)=[n(CO2)M(CO2)]:[n(N2)M(N2)]
=[n(CO2):n(N2)][M(CO2):M(N2)]
=(1/7)(44/28)=11:49.
三、阿伏加德羅定律的簡單應用
對于阿伏加德羅定律的七個推論,我們很難記憶,在指導學生學習時,要想辦法會運用推論。所以我們要引用克拉伯龍方程,即:PV=nRT,其中R為常數,不需我們記憶,這個公式中四個物理量相互轉化,是我們可以推導出阿伏加德羅定律。同時再將物質的量與幾個物理量間的關系導入其中,即引以推導出推論。
1.由PV=nRT=m/M·RT有:PM=m/v·RT=ρRT
即當同溫同壓下,密度比等于其摩爾質量比。
2.由ρ=m/vM=m/nVm=V/n有:M=ρ·Vm
當外界條件為標準狀況下,Vm=22.4L/mol,引計算出M=22.4L/mol·ρ
3.由于外界條件相同時,氣體摩爾體積Vm不變,所以ρ1/ρ2=M1/M2,在此公式中,既可以應用在純氣體中,也可以用在混合氣體中。
4.其他幾個推論,都可以視為四個物理量間的定量關系,確定三個,另一個一定不變,即將推論中的幾個公式直接應用。
例4.在三個密閉容器中分別充入Ne、H2、O2三種氣體,當它們的溫度和密度都相同時,這三種氣體的壓強(p)從大到小的順序是( )
A.P(Ne)>P(H2)>P(O2)
B.P(O2)>P(Ne)>P(H2)
C.P(H2)>P(O2)>P(Ne)
D.P(H2)>P(Ne)>P(O2)
根據上述阿伏加德羅定律推論“三反比”結論:“在相同溫度下,同密度的任何氣體的壓強與其摩爾質量成反比”,得摩爾質量越小壓強越大。由于三種氣體的摩爾質量從小到大順序為M(H2)
對于阿伏加德羅定律及其推論,我們可以引導學生好氣體摩爾體積,能使學生更好地理解我們常見氣體與外界條件的關系,并且使學生理解阿伏加德羅常數應用于氣體摩爾體積。
參考文獻:
[1]楊曉瑞.阿伏加德羅定律的簡單應用[J].數理化學習,2008(3).
[2]謝世偉.阿伏加德羅定律及其應用[J].教育科研論壇,2012,000(006):50-51.

