古塞奇尤單抗治療中重度斑塊狀銀屑病有效性和安全性的系統評價
劉鑫 鐘小燕 徐昌靜 趙丹潔 范清澤 余彬 黃毅嵐
中圖分類號 R758.63 文獻標志碼 A 文章編號 1001-0408(2020)10-1266-06
DOI 10.6039/j.issn.1001-0408.2020.10.20
摘 要 目的:系統評價古塞奇尤單抗治療中重度斑塊狀銀屑病的有效性和安全性,為臨床提供循證參考。方法:計算機檢索PubMed、Embase、Cochrane圖書館、中國知網、維普網、萬方數據等數據庫,檢索時限均為建庫起至2019年10月,納入古塞奇尤單抗對比安慰劑或陽性對照藥治療中重度斑塊狀銀屑病的隨機對照試驗(RCT),篩選文獻并提取資料后,采用Cochrane系統評價員手冊5.1.0推薦的偏倚風險評估工具進行質量評價,使用Stata 16.0軟件進行Meta分析。結果:共納入8項RCT,合計3 488例患者。結果顯示,古塞奇尤單抗組患者的銀屑病皮損面積和嚴重程度指數(PASI)評分較基線下降≥90%的患者比例均顯著高于安慰劑組[RR=26.72,95%CI(15.98,44.70),P<0.001]、阿達木單抗組[RR=1.45,95%CI(1.32,1.59),P<0.001]和司庫奇尤單抗組(P<0.000 1),該組研究者全面評估(IGA)評分為0或1分(清除/幾乎清除)的患者比例亦均顯著高于安慰劑組[RR=11.15,95%CI(8.22,15.14),P<0.001]和阿達木單抗組[RR=1.27,95%CI(1.19,1.35),P<0.001]。此外,在IGA評分為0分(清除)的患者比例、PASI評分較基線下降≥75%的患者比例、皮膚病生活質量指數評分為0或1分的患者比例等方面,古塞奇尤單抗組均顯著優于安慰劑和阿達木單抗組;在PASI評分較基線下降100%的患者比例方面,古塞奇尤單抗組也顯著優于安慰劑組(P<0.05),但與阿達木單抗組比較差異無統計學意義(P>0.05);而古塞奇尤單抗IGA評分為0分(清除)的患者比例等次要結局指標與司庫奇尤單抗組比較差異均無統計學意義(P>0.05)。在總不良反應發生率、因不良反應退出率等安全性指標方面,古塞奇尤單抗組與安慰劑或阿達木單抗組比較差異均無統計學意義(P>0.05)。結論:古塞奇尤單抗在改善中重度斑塊狀銀屑病患者癥狀方面的效果優于安慰劑、阿達木單抗和司庫奇尤,且安全性良好。
關鍵詞 古塞奇尤單抗;中重度斑塊狀銀屑病;有效性;安全性;系統評價;Meta分析
Efficacy and Safety of Guselkumab in the Treatment of Moderate-to-severe Plaque Psoriasis: A Systematic Review
LIU Xin1,ZHONG Xiaoyan2,XU Changjing1,2,ZHAO Danjie1,FAN Qingze2,YU Bin3,HUANG Yilan2(1. School of Pharmacy, Southwest Medical University, Sichuan Luzhou 646000, China; 2. Dept. of Pharmacy, the Affiliated Hospital of Southwest Medical University, Sichuan Luzhou 646000, China; 3. Dept. of Pharmacy, Mianyang Central Hospital, Sichuan Mianyang 621000, China)
ABSTRACT? ?OBJECTIVE: To systematically evaluate the efficacy and safety of guselkumab in the treatment of moderate-to- severe plaque psoriasis, and to provide evidence-based reference for the clinical treatment. METHODS: Retrieved from PubMed, Embase, Cochrane Library, CNKI, VIP, Wanfang database during inception to Oct. 2019, randomized controlled trials (RCTs) about guselkumab versus placebo/positive control in the treatment of moderate-to-severe plaque psoriasis were collected. After literature screening and data extraction, quality evaluation was performed by using the bias risk evaluation tool recommended by the Cochrane System evaluator manual 5.1.0. Meta-analysis was performed by using Stata 16.0 software. RESULTS: Eight RCTs with a total of 3 488 patients were included. The results of Meta-analysis indicated that the proportion of patients who achieved 90% reduction or more from baseline of psoriasis area and severity index (PASI) in guselkumab group was significantly higher than that placebo group [RR=26.72, 95%CI (15.98, 44.70), P<0.001], adaliumumab group [RR=1.45, 95%CI(1.32,1.59), P<0.001] and secukinumab group (P<0.000 1). The proportion of patients with Investigators Global Assessment (IGA) score of 0 or 1 in guselkumab group was significantly better than placebo group [RR=11.15, 95%CI(8.22,15.14), P<0.001] and adaliumumab group [RR=1.27, 95%CI(1.19,1.35), P<0.001]. The proportion of patients with IGA score of 0,the proportion of patients who achieved 75% reduction or more from baseline of PASI,dermatology life quality index score of 0 or 1 in guselkumab group were significantly superior than? placebo group and adaliumumab group,the proportion of patients who achieved 100% reduction from baseline of PASI in guselkumab group was significantly superior than placebo group (P<0.05), there was no significant difference compared with adaliumumab group (P>0.05). There was no statistical significance in the proportion of patients with IGA score of 0 and other secondary outcome indicators between guselkumab and secukinumab group (P>0.05). In the safety indicators as total incidence rate of ADR, rate of withdrawl due to ADR, etc. , there was no statistical significance between guselkumab and placebo/adalimumab groups (P>0.05). CONCLUSIONS: Guselkumab is superior to placebo, adaliumumab and secukinumab in improving the symptoms of moderate-to-severe plaque psoriasis with good safety.
KEYWORDS? ?Guselkumab; Moderate-to-severe plaque psoriasis; Efficacy; Safety; Systematic review; Meta-analysis
銀屑病是一種由T細胞介導的慢性、自身免疫性皮膚病,其在世界范圍內的患病率大概為2%~4%,在我國的患病人數高達600萬以上[1-3]。斑塊狀銀屑病是銀屑病中最常見的類型,約占90%,其臨床特征是皮損部位可見明顯的暗紅色斑塊或浸潤性紅斑[1]。銀屑病的病因復雜,學者普遍認為其是遺傳和環境因素的協同影響以及先天免疫和獲得性免疫的相互作用最終導致角質形成細胞異常增殖的結果[1,4]。目前已有大量研究表明,白細胞介素23(IL-23)/IL-17軸是銀屑病發病機制中的關鍵免疫途徑[5-7]。臨床針對銀屑病的治療有局部治療(外用藥物治療)、物理治療(窄譜UVB)和系統治療(甲氨蝶呤、環孢素及維A酸類)等多種療法[1,8]。但由于部分患者對甲氨蝶呤等傳統藥物反應不佳以及不良反應發生率較高,生物制劑越來越多地被應用于銀屑病的治療。近年來,靶向拮抗IL-23/ IL-17軸、IL-17A信號通路的生物制劑已經成為銀屑病治療的熱門研究方向。古塞奇尤單抗是由美國Johnson? & Johnson公司開發的一種人源單克隆抗體,具有選擇性靶向IL-23 p19亞基的新型作用機制。該藥于2017年7月獲得美國FDA批準上市,可通過皮下給藥用于中重度斑塊狀銀屑病的治療。2019年12月,古塞奇尤單抗注射液獲我國國家藥品監督管理局(NMPA)批準上市,但目前尚未見有關古塞奇尤單抗治療中重度斑塊狀銀屑病的國內研究。為此,本研究采用系統評價的方法對國外發表的古塞奇尤單抗治療中重度斑塊狀銀屑病的有效性和安全性的相關研究進行評價,以期為其臨床應用提供循證參考。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型 古塞奇尤單抗治療中重度斑塊狀銀屑病的隨機對照試驗(RCT),語種限定為中文和英文。
1.1.2 研究對象 確診為中度至重度斑塊狀銀屑病,患病至少6個月,累及體表面積(BSA)≥10%,皮損面積和嚴重程度指數(PASI)評分≥12分,研究者全面評估(IGA)評分≥3分,年齡≥18歲;種族和性別不限。
1.1.3 干預措施 試驗組患者給予古塞奇尤單抗治療,劑量不限;對照組患者給予安慰劑或陽性對照藥(阿達木單抗和司庫奇尤單抗)治療。
1.1.4 結局指標 ①PASI評分較基線下降≥90%的患者比例(PASI90);②IGA評分為0或1分(清除/幾乎清除)的患者比例(IGA0/1)。③IGA評分為0分(清除)的患者比例(IGA0);④PASI評分較基線下降≥75%的患者比例(PASI75);⑤PASI評分較基線下降100%的患者比例(PASI100);⑥皮膚病生活質量指數評分為0或1分的患者比例(DLQI0/1);⑦總不良反應發生率(AE);⑧因不良反應退出率;⑨嚴重不良反應發生率;⑩感染發生率;11嚴重感染發生率;12上呼吸道感染發生率;13鼻咽炎發生率;14頭痛發生率等。其中,①②為主要結局指標,③~⑥為次要結局指標,⑦~12為安全性評價指標。
1.1.5 排除標準 ①非斑塊狀銀屑病(點滴狀、紅皮病型或膿皰型銀屑病)或藥源性牛皮癬及任何其他可能干擾評估的活動性炎癥性疾病的研究;②非RCT、交叉試驗、動物實驗、自身對照試驗、開放性研究以及綜合類文獻。
1.2 檢索策略
計算機檢索PubMed、Embase、Cochrane圖書館、中國知網、維普網、萬方數據等數據庫。檢索時限均為建庫起至2019年10月。英文檢索詞包括“Guselkumab”“CNTO1959”“IL-23 inhibitor”“Anti-IL-23”“Psoriasis”“Plaque psoriasis”;中文檢索詞包括“古塞奇尤單抗”“CNTO1959”“IL-23抑制劑”“銀屑病”“牛皮癬”“斑塊狀銀屑病”。檢索采取主題詞和自由詞相結合的方式。
1.3 文獻篩選和資料提取
由2名研究者根據納入與排除標準獨立閱讀題目和摘要進行初篩,對可能符合的文獻進一步閱讀全文以確定是否納入,如遇分歧則通過討論或由第3名研究者裁決。提取資料包括:作者、發表年份、兩組患者的基線情況(例數、年齡、體質量、病程)、干預措施、隨訪時間、結局指標等。
1.4 文獻質量評價
采用Cochrane系統評價員手冊5.1.0推薦的偏倚風險評估工具,對納入的文獻從以下幾個方面進行質量評價:隨機序列生成、分配隱藏、對受試者和干預提供者施盲、退出/失訪、結果數據不完整、選擇性報告、其他偏倚;同時,采用改良的Jadad量表對文獻質量進行評分,其中隨機序列生成、分配隱藏和對受試者和干預提供者施盲分別占2分,退出/失訪占1分,總分低于4分提示文獻質量較低。
1.5 統計學方法
若評價結局指標的原始文獻≥2篇,采用Stata 16.0軟件進行統計學分析。二分類變量采用相對危險度(RR)作為效應量,區間估計均采用95%置信區間(95%CI)表示。采用χ 2檢驗對納入研究進行異質性檢驗,檢驗水準為α=0.1,并結合I 2進行判斷,若各研究間無統計學異質性(P>0.1,I 2≤50%),采用固定效應模型進行分析;反之,則認為各研究間存在統計學異質性,采用隨機效應模型進行分析。采用Egger檢驗進行發表偏倚風險分析。若評價結局指標的原始文獻<2篇,則采用描述性的方法進行分析。
2 結果
2.1 文獻檢索結果
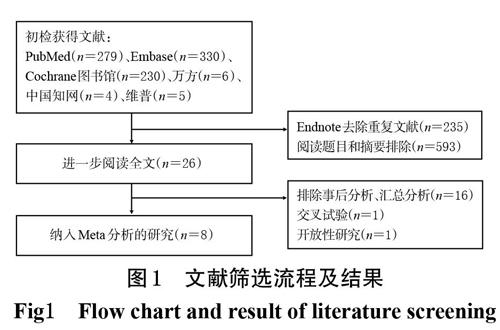
初檢共獲得文獻854篇,首先利用Endnote X9軟件去除重復文獻,然后進一步閱讀文獻進行篩選,最終納入符合標準的研究共8項[9-16],共計3 488例患者,均為英文文獻。文獻篩選流程及結果見圖1;納入研究的基本特征見表1。
2.2 納入研究的質量評價
本研究納入的8項研究[9-16]均為隨機、雙盲的RCT,6項研究[10-14,16]描述了隨機序列生成的具體方案,4項研究[10-12,16]描述了分配隱藏的具體方案,7項研究[9-14,16]報道了退出/失訪;Jadad評分均不低于4分,總體研究質量較高,詳見表2。
2.3 有效性的Meta分析結果
2.3.1 PASI90 7項研究[9-15]報道了治療16周時的古塞奇尤單抗對比安慰劑的PASI90,共計1 815例患者。各研究間無統計學異質性(P=0.366,I 2=8.2%),采用固定效應模型進行Meta分析,詳見圖2。Meta分析結果顯示,試驗組患者的PASI90顯著高于安慰劑組[RR=26.72,95%CI(15.98,44.70),P<0.001]。
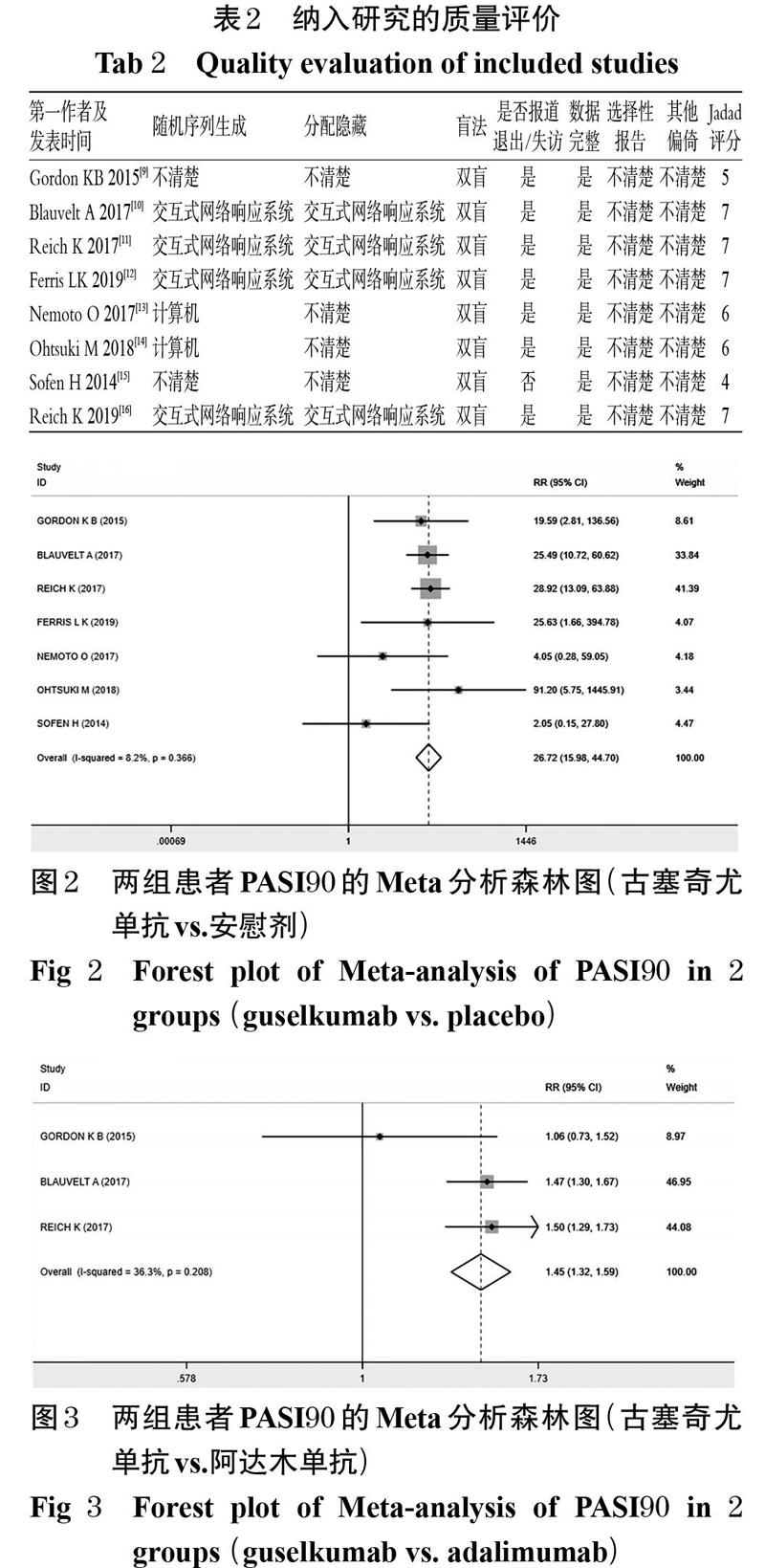
3項研究[9-11]報道了治療16周時的古塞奇尤單抗對比阿達木單抗的PASI90,共計1 658例患者,各研究間無統計學異質性(P=0.208,I 2=36.3%),采用固定效應模型進行Meta分析,詳見圖3。Meta分析結果顯示,試驗組患者的PASI90顯著高于阿達木單抗組[RR=1.45,95%CI(1.32,1.59),P<0.001]。
Fig 3 Forest plot of Meta-analysis of PASI90 in 2 groups (guselkumab vs. adalimumab)
1項研究[16]報道了古塞奇尤單抗對比司庫奇尤單抗的PASI90,共計1 048例患者。治療第48周時,試驗組患者的PASI90(84%)顯著高于司庫奇尤單抗組(70%)(P<0.000 1)。
2.3.2 IGA0/1 4項研究[10-12,14]報道了治療16周時的古塞奇尤單抗對比安慰劑的IGA0/1,共計1 517例患者。各研究間無統計學異質性(P=0.836,I 2=0),采用固定效應模型進行Meta分析,詳見圖4。Meta分析結果顯示,試驗組患者的IGA0/1顯著高于安慰劑組[RR=11.15,95%CI(8.22,15.14),P<0.001]。
Fig 4 Forest plot of Meta-analysis of IGA0/1 in 2 groups (guselkumab vs. placebo)
2項研究[10-11]報道了治療16周時的古塞奇尤單抗對比阿達木單抗的IGA0/1,共計1 407例患者。各研究間無統計學異質性(P=0.543,I 2=0),采用固定效應模型進行Meta分析,詳見圖5。Meta分析結果顯示,試驗組患者的IGA0/1顯著高于阿達木單抗組[RR=1.27,95%CI(1.19,1.35),P<0.001]。
Fig 5 Forest plot of Meta-analysis of IGA0/1 in 2 groups (guselkumab vs. adalimumab)
1項研究[16]報道了古塞奇尤單抗對比司庫奇尤單抗的IGA0/1,共計1 048例患者。治療第48周時,試驗組與司庫奇尤單抗組患者的IGA0/1比較,差異無統計學意義(P>0.05)。
2.3.3 次要結局指標 兩組患者次要結局指標的Meta分析結果見表3。由表3可見,古塞奇尤單抗在IGA0、PASI75、PASI100、DLQI0/1等有效性指標方面的作用均顯著優于安慰劑(P<0.05),在IGA0、PASI75、DLQI0/1等有效性指標方面的作用均顯著優于阿達木單抗(P<0.05);但在PASI100方面,二者比較差異無統計學意義(P>0.05)。此外,古塞奇尤單抗組患者IGA0、PASI75、PASI100等有效性指標與司庫奇尤單抗組比較,差異均無統計學意義(P>0.05)[16]。
2.4 安全性的Meta分析結果
6項研究[9-14]報道了古塞奇尤單抗對比安慰劑的AE,共計1 791例患者。各研究間無統計學異質性(P=0.706,I 2=0),采用固定效應模型進行Meta分析,詳見圖6。Meta分析結果顯示,試驗組患者的AE與安慰劑組比較,差異無統計學意義[RR=1.01,95%CI(0.91,1.12),P=0.886]。
3項研究[9-11]報道了古塞奇尤單抗對比阿達木單抗的AE,共計1 658例患者。各研究間無統計學異質性(P=0.757,I 2=0),采用固定效應模型進行Meta分析,詳見圖7。Meta分析結果顯示,試驗組患者的AE與阿達木單抗組比較,差異無統計學意義[RR=0.99,95%CI(0.89,1.09),P=0.795]。
1項研究[16]報道了古塞奇尤單抗對比司庫奇尤單抗的AE,共計1 048例患者。結果顯示,試驗組患者的AE與司庫奇尤單抗組比較,差異無統計學意義(P=0.137)。
古塞奇尤單抗組患者因不良反應退出率等其余安全性指標與安慰劑或阿達木單抗比較,差異均無統計學意義(P>0.05),詳見表4。
2.5 發表偏倚分析結果
以古塞奇尤單抗對比安慰劑的PASI90結局指標為對象,通過Egger檢驗進行發表偏倚風險分析。結果顯示,納入的研究間不存在發表偏倚風險(P=0.304)。
3 討論
IL-23/IL-17軸是近些年發現的炎癥反應通路,被認為是誘發銀屑病的重要因素,其中IL-23在銀屑病發生機制中扮演了重要角色[6]。IL-23是由抗原提呈細胞(如樹突細胞和單核/巨噬細胞)激活后產生,可激活輔助T細胞17(Th17),并促使Th17分泌IL-17A、IL-17F、IL-21、IL-22及腫瘤壞死因子α(TNF-α)等炎癥細胞因子;IL-17等又可通過下調角質形成細胞的絲聚蛋白和黏附分子的表達來破壞皮膚屏障的完整性,并進一步誘導角質形成細胞的過度增殖;活化的角質形成細胞又通過產生大量細胞因子、趨化因子和抗菌肽等誘導中性粒細胞和其他炎癥細胞的趨化,激活免疫應答反應,從而引發銀屑病[7,17-19]。
古塞奇尤單抗是全球首個上市的選擇性靶向IL-23 p19亞基的單抗藥物,通過皮下注射給藥,其治療斑塊狀銀屑病的用藥方案一般為:在第0、4周分別給藥1次,之后每8周給藥1次,每次100 mg。本研究對古塞奇尤單抗的有效性和安全性進行了Meta分析,結果顯示,古塞奇尤單抗在PASI90、IGA0/1、IGA0、PASI75、PASI100和DLQI0/1等方面的作用均顯著優于安慰劑,在PASI90、IGA0/1、IGA0、PASI75和DLQI0/1等方面的作用均顯著優于阿達木單抗;但在PASI100方面,古塞奇尤單抗與阿達木單抗比較差異無統計學意義。此外,Reich K等[16]的研究比較了古塞奇尤單抗與司庫奇尤單抗的有效性,結果表明,在治療第48周,古塞奇尤單抗組患者的PASI90顯著高于司庫奇尤單抗組,顯示出優越的長期療效。
安全性方面,本研究結果顯示古塞奇尤單抗不良反應輕微,患者AE及其他安全性指標與安慰劑或阿達木單抗比較,差異均無統計學意義。來自VOYAGE 1和VOYAGE 2研究的匯總分析結果也顯示,通過100周的隨訪,研究者并未發現古塞奇尤單抗新的安全問題,安全評估的結果與短期安全性評價結果一致[10-11,20]。
本研究共納入8項RCT,均為隨機、雙盲、多中心研究,Jadad評分均不低于4分,總體研究質量較高,所得結論較為可靠。但本研究也存在一定的局限性:第一,納入的研究數量有限,患者例數較少,且與部分陽性藥物頭對頭比較的研究較少,尚需設計更多的陽性對照試驗以全面評估其有效性和安全性;第二,隨訪周期較短,惡性腫瘤等潛伏期較長的不良反應以及罕見不良反應的暴露需要更多設計合理、大樣本、多中心、隨訪時間更長的RCT進行觀察。
綜上所述,古塞奇尤單抗在改善中重度斑塊狀銀屑病患者癥狀方面的效果優于安慰劑、阿達木單抗和司庫奇尤單抗,且安全性與安慰劑、阿達木單抗和司庫奇尤單抗相當。
參考文獻
[ 1 ] 中華醫學會皮膚性病學分會銀屑病專業委員會.中國銀屑病診療指南:2018簡版[J].中華皮膚科雜志,2019,52(4):223-230.
[ 2 ] PARISI R,SYMMONS DP,GRIFFITHS CE,et al. Global epidemiology of psoriasis:a systematic review of incidence and prevalence[J]. J Invest Dermatol,2013,133(2):377-385.
[ 3 ] 丁曉嵐,王婷琳,沈佚葳,等.中國六省市銀屑病流行病學調查[J].中國皮膚性病學雜志,2010,24(7):598-601.
[ 4 ] FOTIADOU C,LAZARIDOU E,SOTIRIOU E,et al. Targeting IL-23 in psoriasis:current perspectives[J]. Psoriasis: Auckl,2018. DOI:10.2147/PTT.S98893.
[ 5 ] HAWKES JE,YAN B Y,CHAN TC,et al. Discovery of the IL-23/IL-17 signaling pathway and the treatment of psoriasis[J]. J Immunol,2018,201(6):1605-1613.
[ 6 ] PUIG L. The role of IL 23 in the treatment of psoriasis[J]. Expert Rev Clin Immunol,2017,13(6):525-534.
[ 7 ] GIROLOMONI G,STROHAL R,PUIG L,et al. The role of IL-23 and the IL-23/Th17 immune axis in the pathogenesis and treatment of psoriasis[J]. J Eur Acad Dermatol Venereol,2017,31(10):1616-1626.
[ 8 ] 中華醫學會皮膚性病分會銀屑病學組.中國銀屑病治療專家共識:2014版[J].中華皮膚科雜志,2014,47(3):213-215.
[ 9 ] GORDON KB,DUFFIN KC,BISSONNETTE R,et al. A phase 2 trial of guselkumab versus adalimumab for plaque psoriasis[J]. N Engl J Med,2015,373(2):136-144.
[10] BLAUVELT A,PAPP KA,GRIFFITHS CE,et al. Efficacy and safety of guselkumab,an anti-interleukin-23 monoclonal antibody,compared with adalimumab for the continuous treatment of patients with moderate to severe psoriasis:results from the phase Ⅲ,double-blinded,placebo- and active comparator-controlled VOYAGE 1 trial[J]. J Am Acad Dermatol,2017,76(3):405-417.
[11] REICH K,ARMSTRONG AW,FOLEY P,et al. Efficacy and safety of guselkumab,an anti-interleukin-23 monoclonal antibody,compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment:results from the phase Ⅲ,double-blind,placebo- and active comparator-controlled VOYAGE 2 trial[J]. J Am Acad Dermatol,2017,76(3):418-431.
[12] FERRIS LK,OTT E,JIANG J,et al. Efficacy and safety of guselkumab,administered with a novel patient-controlled injector(one-press),for moderate-to-severe psoriasis:results from the phase 3 ORION study[J]. J Dermatolog Treat,2019. DOI:10.1080/09546634.2019.1587145.
[13] NEMOTO O,HIROSE K,SHIBATA S,et al. Safety and efficacy of guselkumab in Japanese patients with moderate-to-severe plaque psoriasis:a randomized,placebo-controlled,ascending-dose study[J]. Br J Dermatol,2017,178(3):689-696.
[14] OHTSUKI M,KUBO H,MORISHIMA H,et al. Guselkumab,an anti-interleukin-23 monoclonal antibody,for the treatment of moderate to severe plaque-type psoriasis in Japanese patients:efficacy and safety results from a phase 3,randomized,double-blind,placebo-controlled study[J]. J Dermatol,2018,45(9):1053-1062.
[15] SOFEN H,SMITH S,MATHESON RT,et al. Guselkumab(an IL-23-specific mAb)demonstrates clinical and molecular response in patients with moderate-to-severe psoriasis[J]. J Allergy Clin Immunol,2014,133(4):1032-1040.
[16] REICH K,ARMSTRONG AW,LANGLEY RG,et al. Guselkumab versus secukinumab for the treatment of moderate-to-severe psoriasis(ECLIPSE):results from a phase 3,randomised controlled trial[J]. Lancet,2019,394(10201):831-839.
[17] BUNTE K,BEIKLER T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases[J]. Int J Mol Sci,2019. DOI:org/10.3390/ijms20143394.
[18] 鄧維,張曉艷. IL-17和IL-23拮抗劑治療銀屑病研究進展[J].中國麻風皮膚病雜志,2018,34(7):437-440.
[19] 賀曉珍,黃曉雯,王婷,等. 靶向白細胞介素23治療自身免疫性疾病的研究進展[J].國際免疫學雜志,2018,41(6):670-676.
[20] REICH K,PAPP KA,ARMSTRONG AW,et al. Safety of guselkumab in patients with moderate-to-severe psoriasis treated through 100 weeks:a pooled analysis from the randomized VOYAGE 1 and VOYAGE 2 studies[J]. Br J Dermatol,2019,180(5):1039-1049.
(收稿日期:2019-11-25 修回日期:2020-03-31)
(編輯:孫 冰)

