多西他賽聯合順鉑在合并人類免疫缺陷病毒感染的晚期非小細胞肺癌患者中的療效分析
高偉艷,朱 眉,唐志敏,代鳳娟
(鄭州市第六人民醫院中西醫結合腫瘤科,河南 鄭州 450061)
獲得性免疫缺陷綜合征(acquired immunodeficiency syndrome,AIDS)是由人類免疫缺陷病毒(human immunodeficiency virus,HIV)感染所引起的一組以嚴重細胞免疫功能缺陷為特征,并由此導致各種條件性感染或腫瘤的疾病。近年來,非HIV(human immunodeficiency virus,HIV)相關性腫瘤,尤其是肺癌的發病率呈現顯著上升趨勢[1],而且已成為HIV/AIDS患者的主要死亡原因之一。晚期驅動基因陰性的非小細胞肺癌的主要治療手段仍是化療,未合并HIV感染的晚期非小細胞肺癌的化療報道較多,但合并HIV感染的晚期非小細胞肺癌相關的化療研究報道較少。多西他賽聯合順鉑是未合并HIV感染的晚期非小細胞肺癌化療的常用方案,本研究分析了該化療方案在合并HIV感染的晚期非小細胞肺癌患者中的臨床療效和安全性,現報道如下。
1 資料與方法
1.1 臨床資料回顧性分析2016年8月至2019年10月鄭州市第六人民醫院收治的經病理學證實的43例晚期非小細胞肺癌患者,體力狀況評分均為0~2分,預計生存期≥3個月,血常規、肝腎功能、心電圖均正常,無重要臟器功能障礙。其中合并HIV感染的晚期非小細胞肺癌患者為觀察組(21例),未合并HIV感染的晚期非小細胞肺癌患者為對照組(22例)。觀察組患者治療前均已行高效抗逆轉錄病毒治療(highly active anti-retroviral therapy, HAART),沒有明確機會性感染。
1.2 方法2組患者的治療方案均為多西他賽聯合順鉑方案,具體用法:多西他賽75 mg/m2,靜脈滴注1 h,第1天。順鉑75 mg/m2,靜脈滴注,第1~3天。同時給予患者抗過敏、止吐、補液等對癥治療。21 d重復1次,共2周期。觀察組患者化療的同時繼續行HAART治療。
1.3 療效評價指標所有患者均在完成2周期后進行近期療效評價。近期療效按照實體瘤療效評價標準RECIST 1.1分為:完全緩解(CR):所有病灶消失,沒有新發病灶;部分緩解(PR):病灶最長徑總和減少≥30%,沒有新發病灶;穩定(SD):病灶縮小未達到部分緩解或增大未達到進展;進展(PD):病灶最長徑總和增大≥20%或出現新發病灶。以CR+PR計算總有效率,以CR+PR+SD計算疾病控制率。化療不良反應按照WHO化療藥物急性及亞急性不良反應的分度標準評價。
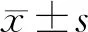
2 結果
2.1 2組患者一般資料比較觀察組和對照組患者的年齡、性別、TNM分期、病理類型比較差異均無統計學意義(P均>0.05)。見表1。

表1 2組患者一般資料比較
注:1)為t值
2.2 2組近期療效比較2組患者總有效率、疾病控制率比較差異均無統計學意義(P均>0.05)。見表2。

表2 2組患者近期療效比較 n(%)
2.3 2組不良反應比較觀察組和對照組白細胞減少、血小板減少、腹瀉、口腔黏膜炎發生率均明顯高于對照組差異有統計學意義(P均>0.05)。見表3。

表3 2組患者不良反應比較 n(%)
3 討論
AIDS患者罹患惡性腫瘤的風險較普通人群明顯增加,目前惡性腫瘤仍是其主要死亡原因之一。AIDS患者發生的惡性腫瘤分為AIDS相關惡性腫瘤( AIDS-defining cancer,ADC)和非AIDS相關惡性腫瘤( non AIDS-defining cancer, NADC)。前者主要包括卡波西肉瘤、非霍奇金淋巴瘤、宮頸癌。后者主要包括肺癌、肝癌、結直腸癌、肛門癌等。HAART治療廣泛應用后,ADC發病率有所下降,但NADC的發病率卻有所上升, 尤其是肺癌的發病率近幾年呈現顯著上升趨勢。
HIV/AIDS患者肺癌的發病率為普通人群的3倍以上,主要原因可能為:吸煙、自身的免疫缺陷、頻繁的肺部感染,慢性炎癥等[2-3]。確診時多數患者為中晚期,Ⅲ~Ⅳ期患者占53%;男性更常見;病理分型以非小細胞肺癌居多,最常見的組織學類型是腺癌(30%~52%),其次是鱗狀細胞癌(19%~36%),預后較一般患者差[4]。
目前, 對于HIV/AIDS合并非小細胞肺癌沒有明確的治療指南,治療方案是參考未合并HIV感染肺癌。晚期驅動基因陰性的非小細胞肺癌患者的主要治療手段仍是化療,多西他賽聯合順鉑是常用的化療方案之一,該方案在未合并HIV感染的晚期非小細胞肺癌患者中的臨床數據已十分完善,但關于該方案在HIV/AIDS合并晚期非小細胞肺癌患者中的應用,目前報道仍較少。本研究以未合并HIV感染的晚期非小細胞肺癌患者為對照組,合并HIV感染的晚期非小細胞肺癌患者為觀察組,比較觀察2組患者的近期療效和不良反應。結果顯示:多西他賽聯合順鉑方案在合并HIV感染的晚期非小細胞肺癌患者中獲得了與未合并HIV感染的晚期非小細胞肺癌患者相當的近期療效。
本研究還發現,化療的主要不良反應為骨髓抑制、消化道反應、肝腎功能異常、口腔黏膜炎、脫發等,觀察組白細胞減少、血小板減少、腹瀉、口腔黏膜炎發生率均高于對照組。觀察組白細胞減少、血小板減少發生率較高,考慮其原因可能為:1)HIV可感染骨髓祖細胞,抑制其造血功能或降低其對造血生長因子的增殖活性反應;HIV亦可感染骨髓基質細胞,導致集落刺激因子減少、活性下降[5-7];2)本研究中觀察組患者采用化療和HAART聯合治療方案,骨髓抑制為HAART的主要不良反應之一,尤其是在一線HAART方案中,HAART藥物與抗腫瘤藥物之間可能產生藥物毒性疊加效應[8]。觀察組腹瀉的發生率也明顯高于對照組。腹瀉在HIV/AIDS患者中較普通人群中更常見,其主要原因為HIV感染可導致胃腸道黏膜結構損傷、免疫功能嚴重受損以及腸道內微生物失調[9-10]。HIV特異性攻擊CD4+T淋巴細胞,腸道內CD4+T淋巴細胞的大量耗竭,使黏膜滲透性增加,黏膜局部防御功能降低,炎癥因子增多,腸道黏膜出現持續的低水平炎癥反應,且HIV感染時間越長,腸道炎癥損傷越重,越容易出現腹瀉。HIV感染患者中腸道內微生物的組成結構也將發生不同程度的改變,導致腸道內菌群失調。有研究[11]顯示:HIV感染患者乳酸菌、真細菌、糞球菌和布勞特氏菌數量降低,而埃希氏桿菌、彎曲桿菌、假單胞菌和不動桿菌數量升高。因此,我們分析觀察組中腹瀉發生率較高的原因可能為HIV/AIDS患者本身即存在腸道黏膜損傷、免疫功能受損、菌群失調,化療藥物可能會進一步加重上述腸道改變,導致腸道黏膜更易受損、免疫功能進一步下降、腸道機會性感染風險增加。口腔黏膜炎為該化療方案中相對較少見的不良反應,主要表現為口腔黏膜糜爛、潰瘍等,常合并感染,嚴重影響患者生活質量。本研究中觀察組患者口腔黏膜炎的發生率明顯高于對照組。分析其原因可能是:HIV感染后,機體免疫功能低下,口腔上皮組織的通透性增大, 易受細菌、真菌、病毒等的感染。有相關文獻[12-13]報道,70%~90% HIV/AIDS患者均可在疾病發生的不同階段發生口腔病變,最常見的為口腔潰瘍。
綜上所述,針對合并HIV感染的晚期非小細胞肺癌患者,多西他賽聯合順鉑是一個可選的化療方案,近期療效與未合并HIV感染的晚期非小細胞肺癌患者相當,但白細胞減少、血小板減少、口腔黏膜炎、腹瀉等不良反應相對較重,化療時需根據患者具體情況選擇治療方案,必要時可采取一定的預防措施。另外,HAART藥物與抗腫瘤藥物之間可能產生藥物毒性疊加效應或藥效降低效應,因此化療時應充分考慮兩者間的相互作用,建議腫瘤專家和HIV專家聯合制定出更合適的抗腫瘤及HAART方案,以最大限度增加療效和降低不良反應。

