hPMSCs對哮喘大鼠肺組織保護作用及機制研究
呂 劍,鐘哲峰
支氣管哮喘(簡稱哮喘)是一種常見臨床疾病,主要表現為氣促伴或不伴咳嗽、反復發作的喘息[1]。以往有研究[2]表明,輔助性T1/2細胞(Thelper1/2,Th1/Th2)細胞在哮喘發病中起著重要作用,而Th2 細胞的分化發展是其發病的始動環節。大量研究[3]表明,急慢性哮喘發病過程中Notch 信號通路與 Th1/Th2 共同參與調控,但其機制仍有待明確。人胎盤來源干細胞(human placenta-derived mesenchymal stem cells,hPMSCs)是具有多向分化潛能的間充質干細胞(mesenchymal stem cells, MSCs),hPMSCs的致瘤性實驗呈陰性,具有正常的染色體核型,這說明遺傳性狀穩定,使其在治療免疫疾病方面有廣闊前景。現建立哮喘大鼠模型,在移植hPMSCs后通過HE染色、RT-qPCR和Western blot等方法觀察其對哮喘大鼠肺組織的影響,以及調節Notch信號通路表達,為哮喘治療提供可能的新方法。
1 材料與方法
1.1 實驗動物SPF級SD雌性大鼠30只(6~8周),購自湖南斯萊克景達實驗動物有限公司,體質量(185±12.5)g,實驗動物許可證[SCXK(湘)2018-0016],單位使用許可證編號:SYXK(湘)2015-0033。大鼠統一飼養在南華大學動物房,室溫18~26 ℃,40%~70%相對濕度,適應性喂養7 d。本研究通過我院倫理委員會審查,實驗過程動物符合3R原則。
1.2 儀器與試劑胰蛋白酶(美國Sigma公司);低糖DMEM 培養基、胎牛血清(美國 HyClone 公司);cDNA 反轉錄試劑盒(日本Takara公司);卵白蛋白(Ovalbumin,grate Ⅱ、Ⅴ)(美國Sigma公司);SYBR Green 熒光試劑盒(美國 Biomiga公司); Jagged1兔抗大鼠單克隆抗體(美國SANTA CRUZ公司);Notch1、2、3、4 兔抗大鼠單克隆抗體(美國Cell signaling公司);圖像分析系統(美國Media Cybernetics公司);酶標檢測儀(美國GeneCore公司);石蠟切片機(德國Leica公司)。
1.3 方法
1.3.1hPMSCs的分離、培養與鑒定 取足月剖宮產胎兒胎盤側組織,經PBS多次沖洗去除血跡,剪成1×1×1 mm3,0.1% Ⅳ型膠原酶中,37 ℃消化30 min,200目篩網過濾收集細胞,細胞懸液離心后置于培養箱內培養(37 ℃、5% CO2),7 d后首次全量換液棄去未貼壁細胞,以后每3 d換液1次,待細胞匯合度達70%~80%時傳代培養。取第 3 代 hPMSCs 消化分離,收集細胞懸液(5×106個/ml ),加入不同 EP管中,采用流式細胞儀檢測hPMSCs表面標志物CD90、CD45、CD44、CD29、CD34。
1.3.2哮喘模型的建立及分組 大鼠隨機均分為3組,即對照組、哮喘模型組(OVA組)及hPMSCs 移植組(hPMSCs組)。造模第1天腹腔注射1 ml OVA混懸液致敏(200 mg 氫氧化鋁,V級OVA 1 mg溶于1 ml生理鹽水),1周后加強致敏1次,將大鼠置于霧化吸入箱,每天霧化30 min/次(1%的Ⅱ級OVA 霧化液),共7次,制作出SD大鼠哮喘模型[4]。其余組均按相同造模方法,對照組采用生理鹽水進行致敏和激發。而hPMSCs組在首次激發后,將第 3 代的hPMSCs尾靜脈注入1 ml細胞混懸液(密度為1×107個/ml)。對照組和OVA組采用尾靜脈注射1 ml PBS溶液。
1.3.3肺組織HE染色 各組大鼠取左側一葉肺組織,石蠟包埋,做厚度4 μm的連續切片,進行蘇木精-伊紅(HE)染色后,中性樹膠封片,在顯微鏡下觀察病理改變。
1.3.4ELISA法檢測大鼠血清中免疫球蛋白E(immunoglobulin E, IgE)、白細胞介素-4(interleukin 4, IL-4)和干擾素-γ(interferon-γ, IFN-γ)含量 末次激發24 h后,20%烏拉坦腹腔麻醉大鼠,經腹主動脈取血,置于抗凝離心管內,3 000 r/min離心10 min,分取血清,-20 ℃保存備用。按照ELISA試劑盒說明書檢測大鼠血清中IgE、IL-4和IFN-γ含量。
1.3.5RT-qPCR法檢測大鼠肺組織中Notch信號通路相關mRNA表達 取凍存大鼠肺組織50 mg,TRIzol試劑提取總RNA,根據 Revertaid First Strand CDNA Synthesis Kit說明書進行反轉錄反應,合成cDNA,保存在-80 ℃。采用上海生工生物技術公司合成的Notch1、Notch2、Notch3及Jagged1的引物序列,參照SYBR Green熒光PCR試劑盒說明書,配置反應體系,依次進行逆轉錄及擴增反應。實驗重復3次,最后由軟件計算并讀出各組Ct值,并對照組基因表達設為1,采用2-△△Ct法計算目的mRNA的含量。
1.3.6Western blot檢測肺組織中Notch1、Notch2、Notch3及Jagged1蛋白變化 每組取凍存大鼠肺組織100 mg,用預冷的蛋白裂解液提取總蛋白,1 200 r/min離心5 min,采用BCA法測定蛋白濃度。每孔以50 μg蛋白樣品上樣,經SDS-PAGE電泳分離、轉膜,然后脫脂奶粉室溫下封閉2 h,加入Notch1(1 ∶ 200)、Notch2(1 ∶ 200)、Notch3(1 ∶ 200)、Jagged1(1 ∶ 500)一抗4 ℃孵育過夜,洗膜后加入辣根過氧化物酶(HRP)標記的山羊抗兔二抗(1 ∶ 1 000)室溫孵育1 h,ECL染色后,曝光、顯影。

2 結果
2.1 hPMSCs培養與鑒定培養7 d后可見梭型細胞貼壁生長增多,培養21 d左右細胞大量增殖,呈漩渦狀生長,見圖1。培養3代后的細胞,經流式細胞儀分析表面標記的陽性率為CD44+[(94.11±1.44)%]、CD90+[(97.85±2.75)%]、CD29+[(92.17±2.16)%],陰性率為CD34-[(92.23±1.68)%]和CD45-[(95.19±2.47)%]。見圖2。

圖1 顯微鏡下觀察hPMSCs形態 ×100
2.2 肺組織病理改變采用倒置顯微鏡觀察拍照,對照組未見炎癥細胞浸潤,肺泡壁完整、支氣管無任何改變,而OVA組存在嚴重炎性改變,支氣管黏膜增厚,管腔狹窄,說明哮喘模型制備成功; hPMSCs組管腔輕微縮窄,炎性細胞浸潤減輕,病理改變較OVA組好轉。見圖3。

圖2 流式細胞儀鑒定hPMSCs

圖3 各組大鼠肺組織學結構 HE×200
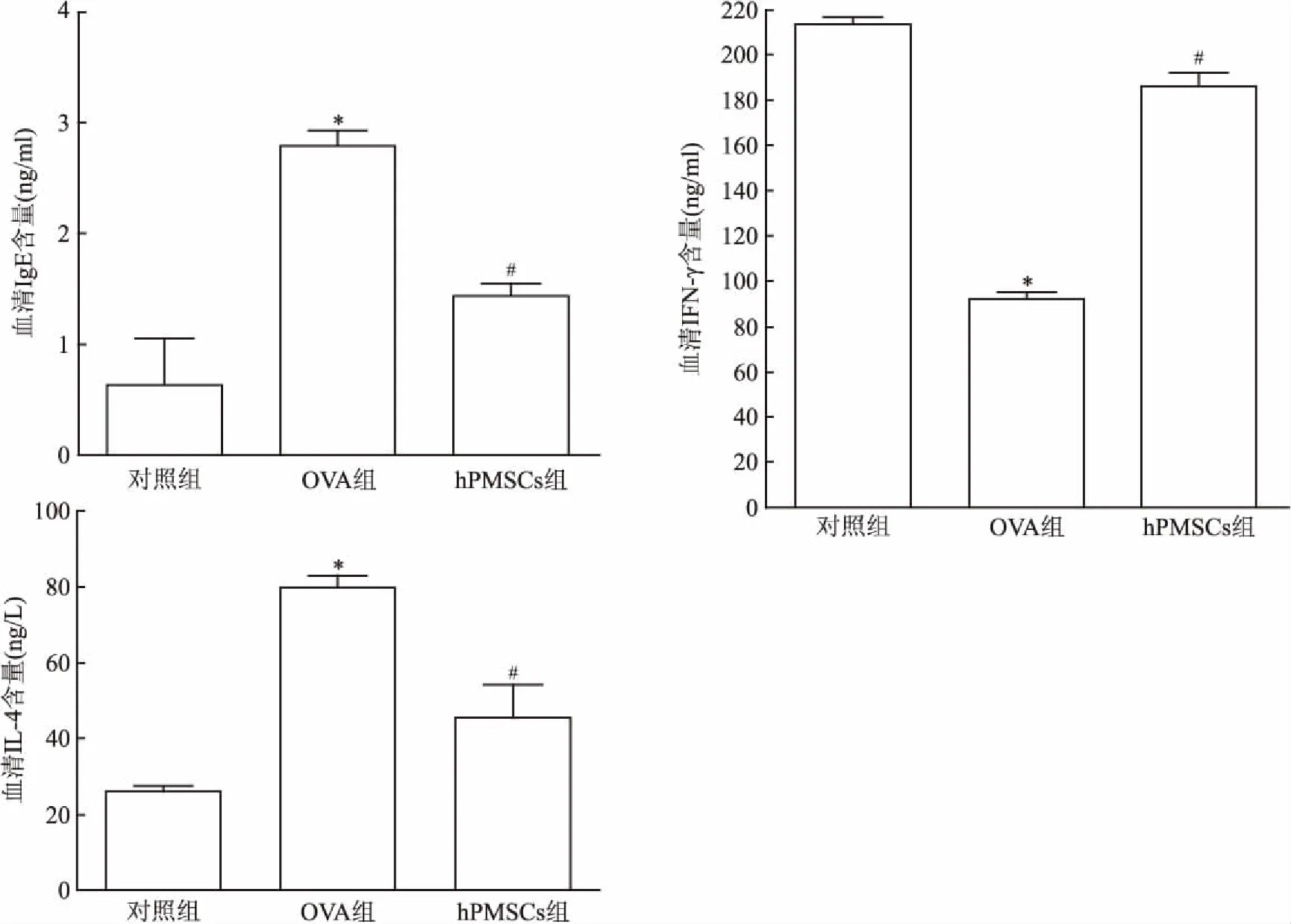
圖4 大鼠血清中炎性因子表達
與對照組比較:*P<0.05;與OVA組比較:#P<0.05
2.3 ELISA檢測大鼠血清炎癥細胞因子OVA組血清中IgE、IL-4含量高于對照組(F=77.41,P<0.05;F=37.25,P<0.05),而與OVA組比較, hPMSCs組血清中IgE、IL-4含量下降(F=28.39,P<0.05;F=14.81,P<0.05);OVA組血清中IFN-γ含量低于對照組(F=58.10,P<0.05),而與OVA組比較, hPMSCs組血清中IFN-γ含量上升(F=155.23,P<0.05)。見圖4。
2.4 大鼠肺組織中Notch1、Notch2、Jagged1 mRNA表達變化OVA組肺組織中Notch1、Notch2、Jagged1 mRNA表達水平高于對照組(F=56.20,P<0.05),而與OVA組比較,hPMSCs組Notch1、Notch2、Jagged1 mRNA表達水平下降(F=64.12,P<0.05);OVA組Notch3 mRNA表達水平低于對照組(P<0.05),而與OVA組比較,hPMSCs組Notch3 mRNA表達水平上升(P<0.05)。見圖5。
2.5 Western blot檢測大鼠肺組織中Notch相關蛋白表達水平OVA組肺組織中Notch1、Notch2、Jagged1 蛋白表達水平高于對照組(F=77.46,P<0.05),而與OVA組比較,hPMSCs組Notch1、Notch2、Jagged1蛋白表達水平下降(F=105.18,P<0.05);OVA組Notch3蛋白表達水平低于對照組,而與OVA組比較,hPMSCs組Notch3蛋白表達水平上升。見圖6。

圖5 大鼠肺組織中Notch相關mRNA表達水平
A:Notch1相對表達水平;B:Notch2相對表達水平;C:Notch3相對表達水平;D:Jagged1相對表達水平;與對照組比較:*P<0.05;與OVA組比較:#P<0.05
3 討論
哮喘是一種呼吸系統的異質性疾病,表現為氣道炎癥導致持續性氣道高反應性下出現的廣泛而可逆性氣道狹窄。哮喘氣道炎癥由多種細胞因子、黏附分子和炎癥介質參與,如淋巴細胞、巨噬細胞和中性粒細胞等[5-6]。有研究[7-8]表明,Th1/Th2失衡可引起支氣管哮喘,Th1輔助細胞為 CD4+細胞,分泌 IL-2、IFN-γ等對哮喘有一定的抑制作用,還能促進IgG的生成。Th2輔助細胞的主要執行細胞因子為IL-4、IL-5等,能對抗細胞外多細胞寄生蟲的免疫反應,另外IL-4、IgE會活化肥大細胞而釋放組胺、血清素等,造成氣道收縮[9]。
hPMSCs是來源于胎盤組織的新MSCs,較其他來源MSCs抗炎能力更強,具備有多向分化潛能及免疫調節功能[10-11]。hPMSC具有多分化潛能,是一種理想的組織工程種子細胞。不同來源的MSCs生物學特性不盡相同,如骨髓來源MSC造血能力極強,臍血來源MSC有強的向神經細胞分化的潛能,胎盤來源MSC在免疫調控方面更優。由于hPMSCs具有低免疫原性[12]及免疫調節作用,它可向損傷或炎癥部位遷移發揮修復、炎癥抑制作用。研究[13]顯示,hPMSCs較其他MSCs有更強的遷移能力,靶向治療作用更明顯,有著更廣闊的應用前景。
HE染色顯示,OVA組存在嚴重炎性改變,支氣管黏膜增厚,管腔狹窄,這說明哮喘模型制備成功。hPMSCs組炎性細胞浸潤減輕,黏液分泌下降,氣道平滑肌增殖減弱,這說明hPMSCs能緩解哮喘發展,減輕哮喘誘發的支氣管炎癥、細胞浸潤的產生;IFN-γ及IL-4分別是Th1和Th2類細胞的代表性細胞因子,ELISA檢測結果顯示,與OVA組比較,hPMSCs組血清中IgE、IL-4含量下降(P<0.05),而IFN-γ含量上升(P<0.05)。這說明hPMSCs能夠抑制哮喘大鼠炎性細胞因子的分泌和IgE的生成,與HE檢測結果基本一致。
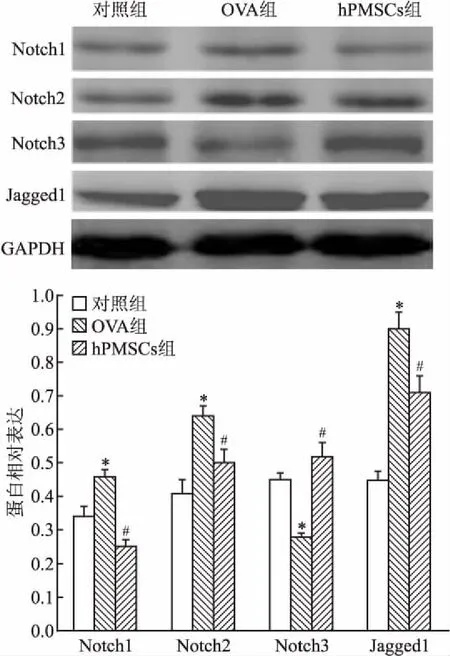
圖6 大鼠肺組織中Notch相關蛋白表達水平
與對照組比較:*P<0.05;與OVA組比較:#P<0.05
Notch信號通路是一個在進化上十分保守的跨膜受體蛋白家族,在許多疾病過程中起到重要的作用[14]。一個完整的Notch信號通路包括 Notch受體、 Notch配體及其下游分子[15],對細胞的增殖、分化和凋亡具有重要調節作用。在哺乳類動物中存在有4種Notch受體(Notch1~ 4)及5種配體(Serrate家族配體:Jagged-1、2和Delta家族配體:Delta-1、3、4)。Notch配體能與細胞表面的Notch受體相互調節,激活Notch信號通路,調節外周T淋巴細胞、樹突細胞和邊緣區B細胞等,并參加細胞免疫功能的調節。哮喘發病的主要特征為活化的T細胞分泌過多的Th2類細胞因子(IL-4、IL-5、IL-13等),而Th1 細胞減少,導致Th1/Th2 失衡,產生包括氣道重塑、氣道高反應性、黏蛋白分泌過多和氣道炎癥等癥狀。研究[16]證明Notch信號通路參與Th1、Th2細胞的增殖、分化過程,阻斷 Notch信號將影響Th1、Th2細胞應答。Jagged蛋白可誘導Th2細胞分化,而IFN-γ 能抑制 Th2 細胞的分化和功能。本實驗RT-qPCR和Western blot結果表明,與OVA組比較,hPMSCs組Notch1、Notch2、Jagged1 mRNA及蛋白表達水平下降,而Notch3 mRNA及蛋白表達水平上升。這提示Notch信號通路在哮喘發病機制中起著重要作用,同時hPMSCs可能通過抑制Notch受體(Notch1、Notch2)和配體(Jagged1)表達,上調Notch3表達產生影響,改善哮喘氣道炎癥,而哮喘發生時Notch3表現為抑制作用,這與Maekawa et al[17]報道基本一致。
綜上所述,本實驗成功復制出哮喘大鼠模型,采用hPMSCs治療后改善哮喘大鼠肺部病理癥狀,hPMSCs可能通過Notch通路的調節作用,降低IL-4、IgE水平和增加IFN-γ,減輕氣道高反應性和炎癥。目前的研究為將來進一步探討hPMSCs與哮喘之間的關系奠定了基礎,hPMSCs可能成為治療哮喘的新思路。

