腎活檢時高尿酸血癥與IgA腎病臨床及牛津病理相關性研究
魯珍珍,鄧躍毅,劉旺意
原發性IgA腎病是一組免疫病理綜合征,表現為以IgA為主的免疫復合物顆粒狀沉積在腎小球系膜區或(和)毛細血管袢。作為世界范圍內最常見的腎小球疾病,其分布根據社會人口學特征、區域環境及腎活檢策略的不同而不盡相同[1],其臨床表現多樣,疾病轉歸及預后難以預測。尿酸是人體嘌呤代謝的最終產物,主要由肝臟產生,經腎臟(65%~75%)和胃腸道(25%~35%)排泄。研究[2]發現高尿酸血癥(hyperuricemia, HUA)是慢性腎臟病進展的獨立危險因素。IgA腎病伴HUA患者腎小球硬化、腎小管間質和血管損傷評分更高。然而HUA與IgA腎病牛津病理的關系尚未完全闡明。該研究旨在探索腎活檢時HUA與IgA腎病臨床及牛津病理的關系,為IgA腎病確診之初判斷病情,防治疾病提供理論依據。
1 材料與方法
1.1 病例資料回顧性分析2012年1月~2019年1月在上海中醫藥大學附屬龍華醫院腎病科接受治療并隨訪的原發性IgA腎病患者共289例。其中男性147例,女性142例,年齡14~76(37.0±11.8)歲。所有納入患者均具有完整的腎穿報告及臨床資料,腎穿報告均符合2009年《國際腎臟》正式公布的IgA腎病牛津分型標準。排除標準:① 過敏性紫癜、系統性紅斑狼瘡、乙肝病毒相關性腎炎等繼發性IgA腎病;② 合并嚴重的心、腦、肝、腎等器官病變及功能障礙的患者;③ 合并嚴重感染和危及生命的并發癥的患者。
1.2 一般資料① 基本資料:姓名、性別、年齡、首發癥狀、病程、高血壓史。② 實驗室資料:腎活檢時的血肌酐、尿素氮、白蛋白、血尿酸、血紅蛋白(hemoglobin, Hb)、總膽固醇(total cholesterol, TC)、三酰甘油(total glycerin, TG)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、24小時尿蛋白(24 h urine protein, 24hpro)、腎小球濾過濾(estimated glomerular filtration rate,eGFR);HUA為空腹血尿酸水平男性>420 μmol/L,女性>357 μmol/L。③病理資料:按照2009年的牛津病理分型標準對IgA腎病進行分型。系膜增生(M):<4個系膜細胞/系膜區為M0,≥4個系膜細胞/系膜區為M1;腎小球毛細血管內增生性病變(E):E0(無)、E1(有);腎小球節段硬化或黏連(S):S0(無)、S1(有);腎小管萎縮或間質纖維化(T):0%~25% 為T0,>25%~50% 為 T1,>50%為 T2。

2 結果
2.1 不同尿酸水平基線臨床特征共納入289例IgA腎病患者,男性147例,伴HUA 71例,女性142例,伴HUA 49例,男女患有HUA的比例為1.45 ∶1。尿酸正常組的高血壓發病率為25.4%,高尿酸組為52.5%,高血壓發病率、肌酐、尿素氮比較差異有統計學意義(P<0.000 1),24 hpro比較差異有統計學意義(P=0.013),TC、TG、HDL、LDL比較差異有統計學意義(P<0.05),但Hb和白蛋白差異無統計學意義。見表1。
2.2 尿酸與牛津病理分型的相關性Spearman等級相關分析顯示,HUA與牛津分型中系膜增生(r=0.254,P<0.000 1)、腎小球節段硬化或黏連(r=0.145,P=0.013)以及腎小管萎縮或間質纖維化(r=0.315,P<0.000 1)正相關,而與腎小球毛細血管內增生性病變(r=-0.029,P=0.626)的相關性差異無統計學意義。
2.3 牛津分型M、S和T與臨床指標的比較將與尿酸相關的病理因素M、S、T進行分組,M0、M1組尿酸、肌酐以及24 hpro比較,差異有統計學意義(P<0.05)。T2組的尿酸水平高于T0和T1組,白蛋白水平低于T0和T1組,差異有統計學意義(P<0.05);3組間肌酐比較,差異有統計學意義(P<0.05);S0、S1兩組間比較,差異均無統計學意義(P>0.05)。見表2。
2.4 尿酸對牛津病理M和S的影響多因素Logistic回歸對性別、年齡、血壓、肌酐、尿素氮、白蛋白、TC、TG、HDL、LDL、eGFR、24 hpro、Hb進行調整后發現,HUA是系膜增生(OR=3.336,95%CI:1.848~6.020)和小球節段硬化(OR=2.238,95%CI:1.084~4.621)的獨立危險因素。結合不同臨床指標建立3個不同的模型,采用ROC曲線聯合診斷顯示當加入尿酸這個因素后,ROC曲線下面積均大于沒有增加尿酸的因素,見表3、圖1、2、3。且對于診斷M的曲線下面積大于診斷S的曲線下面積,認為尿酸可以提高對系膜增生和小球節段硬化的診斷,對提高系膜增生的敏感性大于小球節段硬化。與其他兩個模型相比,Model 3中聯合的指標最多,曲線下面積最大。

表1 不同尿酸分組基線臨床特征

表2 牛津分型M、S和T與臨床指標的比較
與T0組比較:aP<0.05;與T1組比較:bP<0.05

表3 不同模型中有無尿酸對于預測M和S的曲線下面積
Model 1:性別,年齡,血壓,肌酐;Model 2:性別,年齡,血壓,肌酐,eGFR,24 hpro;Model 3:性別,年齡,血壓,肌酐,eGFR,24 hpro,TC,TG,HDL,LDL,Hb, 白蛋白
3 討論
近年來HUA的發病率隨著人們生活水平的提高而不斷上升,中國成人HUA發病率由8.4%上升到13.3%[3]。現多認為該病與代謝綜合征相關,會增加痛風、糖尿病以及心血管、腦血管疾病的發生風險[4]。一項研究[5]對 1 965 例IgA腎病平均隨訪7年,對各混雜因素調整后發現HUA與IgA腎病進展呈正相關。有研究[6]顯示尿酸可預測女性IgA腎病進展,與腎臟存活呈J型關系[7]。另有研究[8]顯示HUA是G3a期進展的獨立危險因素。
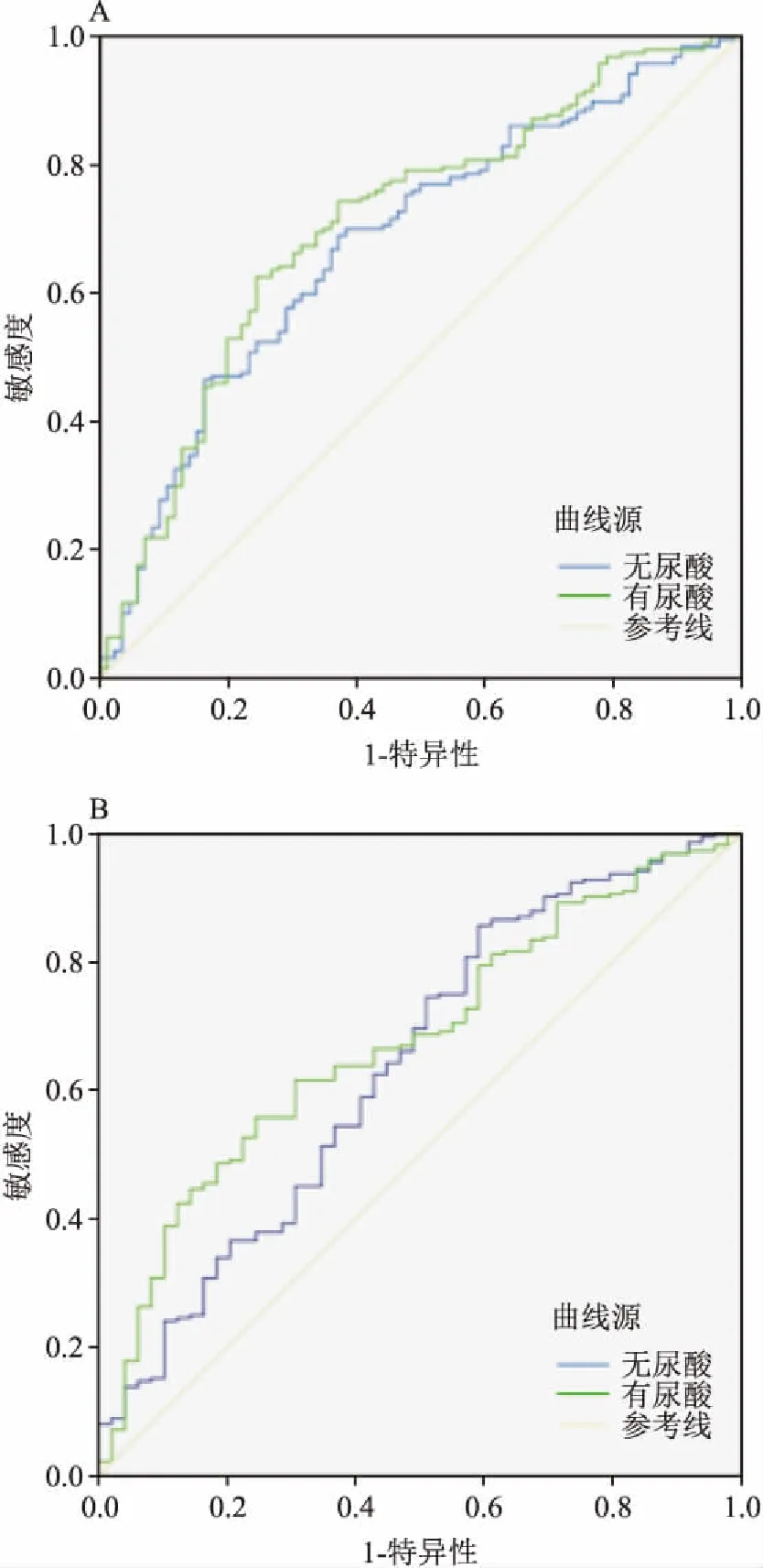
圖3 Model 3有無尿酸對于診斷系膜增生和小球節段硬化的曲線下面積
本研究顯示腎活檢時HUA的發生率為41.5%。高尿酸組的高血壓發病率更高,腎功能損傷更為嚴重,脂質代謝更為異常,不論是HUA伴其他代謝綜合征,還是高血壓或脂質代謝紊亂加重HUA程度,可能都會加重IgA腎病的進展,對血壓、血脂、血尿酸的及時干預治療或可在一定程度上延緩IgA腎病進展。HUA不僅與IgA腎病臨床指標相關,也與組織病理損傷密切相關。既往對HUA與IgA腎病的牛津病理關系研究多集中在腎小管萎縮和間質纖維化以及小球硬化方面[9-10],而HUA與IgA腎病系膜細胞增生相關研究較少。本研究提示腎活檢時HUA與IgA腎病牛津分型中的M、S和T相關。多因素Logistic回歸調整其他因素后發現腎穿時尿酸水平是M和S的獨立危險因素。通過建立3種模型進行聯合診斷顯示,增加尿酸因素后3種模型的ROC曲線下面積均大于未增加尿酸的模型,提示腎穿時尿酸水平提高了對M和S診斷的敏感性,尤其在Model 3中曲線下面積最大,表明尿酸聯合的指標越多,對診斷IgA腎病M和S的效能越大。分析其原因可能與HUA在無尿酸鹽結晶形成的溶解狀態下誘導腎小球系膜細胞增生有關。系膜細胞屬于腎固有細胞,其與毛細血管袢之間不存在基底膜,因此,任何來自血流異常信號等多種病理因素可直接對腎小球系膜產生影響[11]。相關體外實驗研究[12]也表明,尿酸可促進體外培養的系膜細胞在一定范圍內的增生和表型轉化且呈劑量依賴性增強。隨著慢性腎臟病的發展,腎小球濾過率下降,長期HUA導致尿酸鹽在腎臟沉積,使腎臟病變從早期腎小球系膜增生,炎癥細胞浸潤向晚期小球節段硬化發展,進一步加重腎臟損傷。本研究分析腎活檢時尿酸水平與IgA腎病病理關系,多屬于早期階段,故可能對系膜增生更為敏感,所以尿酸對診斷M的曲線下面積大于診斷S的曲線下面積。綜上,臨床上對于高度懷疑IgA腎病的患者,或不愿意做腎活檢的患者,可以結合尿酸、血壓、肌酐、eGFR、24 hpro等指標,對預測腎臟系膜增生和小球硬化具有一定的幫助,當然,臨床指標越齊全,對預測M和S診斷的敏感性越高。同時,HUA可以作為治療M和S的潛在靶點,對HUA及相關代謝綜合征的及早干預或可在一定程度上延緩IgA腎病的進展。
本研究結果表明HUA與IgA腎病臨床指標及組織病理相關,同時HUA作為IgA腎病系膜增生和小球硬化的獨立危險因素,可以提高對系膜增生和小球硬化的診斷,故在發現尿酸水平升高之初對其進行積極控制,對于減輕系膜增生、小球硬化的損傷,延緩腎臟病情發展具有重要意義。

