肝動脈化療栓塞術后原發性肝癌患者的腸道菌群變化
李科志, 韋家康, 韓志偉, 仇雯霞, 陳欣欣, 黃 山, 何劍波, 鄔國斌, 陳 闖
1 廣西醫科大學附屬腫瘤醫院 a.實驗研究部; b.研究生院; c.肝膽外科; d.腫瘤科; e.中醫科, 南寧 530021;2 貴港市人民醫院 廣西 貴港 537100; 3 廣西醫科大學第一附屬醫院 研究生院, 南寧 530021
Changes in intestinal flora in patients with primary liver cancer after transcatheter arterial chemoembolization
LIKezhi,WEIJiakang,HANZhiwei,etal.
(DepartmentofResearch,TheAffiliatedTumorHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Abstract:ObjectiveTo investigate the changes in the diversity and structure of intestinal flora in patients with primary liver cancer after transcatheter arterial chemoembolization (TACE).MethodsA total of 65 patients with primary liver cancer (among whom 20 received TACE) who were treated in The Affiliated Tumor Hospital of Guangxi Medical University from September 2018 to January 2019 were enrolled, and 27 individuals who underwent physical examination were enrolled as healthy group. High-throughput 16S rDNA sequencing was used to analyze the structure of fecal bacterial communities, and Anosim, LEfSe software, and R language stats package were used to analyze the differences in the relative abundance, diversity, community, and evolutionary branching of intestinal flora between groups. Thet-test was used for comparison of normally distributed continuous data with homogeneity of variance between groups, and the Kruskal-WallisUtest was used for comparison of non-normally distributed continuous data between groups; the chi-square test was used for comparison of categorical data between groups. The Spearman rank correlation test was used for correlation analysis.ResultsAt the phylum level, the dominant bacteria were Bacteroidetes and Firmicutes in each group, which accounted for >90% in the healthy group and >80% in the primary liver cancer group and the TACE treatment group. Bacteroidetes accounted for 48.44%, 44.96%, and 48.60%, respectively, in the healthy group, the primary liver cancer group, and the TACE treatment group, and Firmicutes accounted for 47.09%, 38.15%, and 33.93%, respectively, in the three groups, suggesting that the primary liver cancer group had significantly lower relative abundance of Bacteroidetes and Firmicutes than the healthy group; in addition, the primary liver cancer group and the TACE treatment group had significantly higher relative abundance of Proteobacteria and Fusobacteria than the healthy group; although there were changes in the other phyla of bacteria, these bacteria accounted for <0.5%. Compared with the primary liver cancer group, the healthy group had significantly higher abundance and ACE value of observed species (abundance: 264±47 vs 230±64,t=2.499,P=0.014; ACE value: 284.11±50.82 vs 252.96±67.58,t=2.158,P=0.034). The rank between the primary liver cancer group and the healthy group was higher than that in each of the two groups (R>0), so the difference in the structure of intestinal flora between the two groups was significantly greater than that within each of the two groups (P<0.05). The rank between the pre-TACE group and the post-TACE group was lower than that in the pre-TACE group (R<0), so the difference in the structure of intestinal flora within the pre-TACE group and the post-TACE group was greater than that between the two groups (P>0.05). In the patients with primary liver cancer, intestinal opportunistic pathogens were correlated with Child-Turcotte-Pugh (CTP) score, total bilirubin (TBil), alanine aminotransferase (ALT), and aspartate aminotransferase (AST) (r=0.245, 0.421, 0.327, and 0.446,P=0.049,P<0.001,P=0.008, andP<0.001), and potential probiotics were correlated with CTP score, TBil, albumin, ALT, and AST (r=-0.314, -0.490, 0.285, -0.374, and -0.528,P=0.011,P<0.001,P=0.022,P=0.002, andP<0.001). The abundance of the opportunistic pathogens among the differentially expressed bacteria increased with the increase in Child-Pugh class for liver function, and the patients with class C liver function had higher abundance than those with class A or B liver function (Z=4.301 and 4.063,P=0.038 and 0.044). The relative abundance of potential probiotics tended to decrease with the increase in Child-Pugh class for liver function, and the patients with class C liver function had lower abundance than those with class A liver function (Z=3.882,P=0.049).ConclusionThere are differences in the diversity and structure of intestinal flora between patients with primary liver cancer and healthy individuals, and the patients with primary liver cancer have similar intestinal flora before and after TACE, suggesting that TACE has little influence on intestinal flora. Intestinal dysbacteriosis is associated with the clinical classification of primary liver cancer, and the degree of intestinal dysbacteriosis increases with the increase in Child-Pugh class for liver function, with a reduction in potential probiotics and an increase in opportunistic pathogens.
Keywords:liver neoplasms; chemoembolization, therapeutic; gastrointestinal microbiome; biodiversity
腸道內微生物群是肝臟與腸道在機體功能調節中構成腸道-肝臟軸循環中的重要組成部分,參與多種生理過程[1]。多項研究[2-3]表明,膽汁酸等代謝變化可通過腸道肝臟循環軸影響著腸道內菌群微生態結構;也有研究[4]證實,用抗生素“敲除”腸道中調控膽汁酸代謝的梭菌屬細菌后,大量初級膽汁酸回到肝臟并刺激肝組織產生趨化因子16,進而招募更多自然殺傷T淋巴細胞殺滅肝臟腫瘤。原發性肝癌患者經肝臟腫瘤的供血血管予化療藥灌注及經肝動脈化療栓塞術(TACE)治療后補充益生菌能有效降低血中的內毒素脂多糖,并減少TACE治療后消化道副反應的發生率及反應程度,肝功能受損也能夠得以改善[5]。然而,肝癌進展過程中不同臨床分期患者腸道微生態變化規律及TACE干預治療對腸道微生態的影響相關報道較少,本研究通過對比分析肝癌患者與健康人群、TACE治療前后腸道菌群多樣性及菌群結構變化,初步探討腸道微生態變化與肝癌的關系,為肝癌患者益生菌制劑的研發提供參考。
1 資料與方法
1.1 研究對象 選取2018年9月-2019年1月在廣西醫科大學附屬腫瘤醫院就診的原發性肝癌患者65例,同期體檢健康志愿者27例。原發性肝癌診斷標準依據《原發性肝癌診療規范(2017年版)》[6]。納入標準:(1)年齡>18歲,飲食習慣無偏好,長期居住于本地區;(2)無其他腸炎、胰腺炎等消化道疾病;(3)無糖尿病、腎上腺皮質功能亢進等內分泌疾病及其他系統疾病。排除標準:(1)近1個月有細菌、真菌感染及使用抗生素者;(2)近1個月有行胃腸道、肝臟、膽囊等相關外科手術;(3)2周內有食用益生菌制劑、益生元、中草藥及其他可能影響腸道菌群組成的食物及藥物。本研究經廣西醫科大學附屬腫瘤醫院倫理委員會批準(批號:LW2019060),患者及家屬知情并簽署同意書。
1.2 糞便采集 檢查前1天患者禁酒及藥物,檢查前 8 h禁食。晨起7時取糞便樣本,樣本取備按照流程HMP手冊(Version 12.0,Accession:phd003190.2)迅速置于糞便無菌采集管中并密閉,-80 ℃冰箱保存。
1.3 腸道微生物DNA提取、16S rDNA V4可變區PCR擴增及測序 采用CTAB方法對樣本的基因組DNA進行提取,利用酶標儀檢測DNA濃度,取適量的樣品于離心管中,無菌水稀釋樣品至1 ng/μl。16S rDNA V4區引物為,515F:GTGCCAGCMGCCGCGGTAA;806R:GGACTACNNGGGTATCTAAT。使用TruSeq?DNA PCR-Free Sample Preparation Kit 建庫試劑盒進行文庫的構建,構建好的文庫經過Life Invitrogen Qubit 3.0定量和文庫檢測,檢測合格后使用HiSeq2500進行上機測序。
1.4 數據信息分析 測序得到原始數據,對原始數據進行拼接、過濾,得到有效數據。然后基于有效數據進行OTUs(operational taxonomic units)聚類和物種分類分析,從而得到每個樣品的OTUs 和分類譜系的基本分析結果。然后對OTUs 進行Alpha多樣性計算,得到樣品內物種豐富度和均勻度信息、不同樣品或分組間的共有和特有OTUs信息等。另一方面,對OTUs進行多序列比對,得到不同分組樣品的群落結構差異,通過PCoA、NMDS等降維圖和樣品聚類樹進行展示。
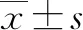
2 結果
2.1 一般資料 65例原發性肝癌患者中BCLC分期A期3例、B期10例、C期52例;Child-Pugh分級A級36例、B級23例、C級6例;肝炎病毒感染情況:HBV 57例、HCV 3例、未感染5例;肝硬化61例。健康組與肝癌組在年齡[(49.30±7.65)歲 vs (53.51±10.12)歲,t=-1.926,P=0.057]、性別(女/男,6/21 vs 10/55,χ2=0.621,P=0.431)及BMI[(22.29±2.41) kg/m2vs (21.49±2.98) kg/m2,t=1.235,P=0.220]上比較,差異均無統計學意義,具有可比性。
2.2 TACE治療前后患者的一般資料 65例原發性肝癌患者中20例行TACE。20例患者標本采集時間為術后第4天。兩組患者一般資料見表1。
2.3 測序深度及樣本評估 以97%以上的序列相似度聚類OTU并構建稀釋曲線,可見稀釋曲線隨著測序數的增加,曲線呈平緩趨勢達到平臺期,說明三組樣品測序深度足夠,覆蓋樣品中大多數微生物(圖1),且樣本量充分(圖2)。
2.4 組間物種相對豐度 根據物種注釋結果,得出不同分組在各分類水平上豐度排名靠前的物種。組間在門、科、屬水平的相對豐度見圖3。在門水平,各組的最大優勢菌均為擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes),兩者占比之和在健康組>90%,在肝癌組及TACE治療組中占比均>80%。擬桿菌門在健康組、原發性肝癌組、TACE治療組占比分別為48.44%、44.96%、48.60%,厚壁菌門在各組占比分別為47.09%、38.15%、33.93%,擬桿菌門、厚壁菌門相對豐度在肝癌組均低于健康組;此外,變形菌門(Proteobacteria)及梭桿菌門(Fusobacteria)相對豐度在肝癌組及TACE治療組中占比均高于健康組;其余菌門雖有所變化,但占比均<0.5%。

表1 TACE治療前后患者一般資料

圖1稀釋曲線

圖2 物種累積箱型圖


注:a門; b.科; c.屬。
圖33組在門、科、屬水平的相對豐度
2.5 多樣性分析
2.5.1 Alpha Diversity分析 Observed species為直觀的最小操作分類單元下的數據統計,Chao1及ACE指數是使用不同算法通過OTU估算物種總體,三者均表示樣品內物種豐富度。Shannon及Simpson為樣品中物種豐富度及均勻度的綜合指標。
健康組物種豐富度Observed species及ACE均大于肝癌組,差異均有統計學意義(P值均<0.05)(表2,圖4)。

圖4 組間Alpha多樣性比較

組別健康組(n=27)原發性肝癌組(n=65)t值P值物種豐富度264.00±47.00230.00±64.002.4990.014Chao1值282.56±50.88253.20±75.011.8600.066ACE值284.11±50.82252.96±67.582.1580.034Shannon指數4.56±0.704.37±0.771.1460.255Simpson指數0.87±0.090.89±0.080.2480.805

組別TACE術前TACE術后t值P值物種豐富度200.00±62.13196.00±68.000.1520.881Chao1值212.98±62.89211.73±68.590.0610.952ACE值214.30±62.87212.68±68.000.0790.938Shannon指數4.43±0.874.47±0.730.1740.864Simpson指數0.87±0.080.89±0.050.5920.561
2.5.2 無度量多維標定法NMDS分析 樣品組內結構及組間結構的差異以點與點間的距離呈現。如圖5示,健康組樣品能較好的聚集在一起,組內結構相近。而原發性肝癌組各樣品分布分散,原發性肝癌組組內結構差異較大。兩組樣品組間結構存在差異。而TACE治療前與治療后各組樣品點與點距離較遠,組內結構差異均較大;兩組點的分布范圍大致一致,TACE治療前與治療后腸內菌群組間結構相似。

圖5 健康組、原發性肝癌組及TACE術后NMDS
2.5.3 組間群落結構差異顯著性檢驗 圖6示,Between組(原發性肝癌組+健康組)的秩較原發性肝癌組及健康組高,R>0,健康組及肝癌組腸道菌群組間結構差異大于組內差異(P<0.05)。同時,Between組的秩低于肝癌TACE術前組,R<0,結合NMDS分析可知肝癌TACE治療前與治療后組內結構差異大于組間結構差異(P>0.05)。
2.6 組間物種差異顯著性LEfSe分析 予LDA線性回歸分析獲得LDA值(圖7),其分值大小表示差異顯著物種對差異的影響程度。健康組中差異顯著物種分別為:厚壁菌門(Firmicutes)、梭菌綱(Clostridia)、梭菌目(Clostridiales)、瘤胃菌科(Ruminococcaceae)、Subdoligranulum菌屬、Plebeius擬桿菌(Bacteroides_plebeius)。原發性肝癌組中差異顯著物種分別為:變形菌門(Proteobacteria)、γ-變形菌綱(Gammaproteobacteria)、腸桿菌目(Enterobacteriales)、腸桿菌科(Enterobacteriaceae)、埃希氏桿菌屬(Escherichia_Shigella)、大腸埃希菌(Escherichia_coli);梭桿菌門(Fusobacteria)、梭桿菌綱(Fusobacteriia)、梭桿菌目(Fusobacteriales)、梭桿菌科(Fusobacteriaceae)、梭桿菌屬(Fusobacterium);同屬于厚壁菌門中的芽孢桿菌綱(Bacilli)、乳桿菌目(Lactobacillales)、鏈球菌科(Streptococcaceae)、鏈球菌屬(Streptococcus)、韋榮球菌屬(Veillonella)以及擬桿菌門的脆弱擬桿菌(Bacteroides_fragilis)。
圖8為差異物種的進化分支圖譜,可顯示出差異物種在各個水平的豐度大小及進化分支關系。

注:Between為兩組之間的秩。

圖7 LDA值分布柱狀圖
2.7 原發性肝癌患者腸道差異菌豐度變化與臨床特征分析
2.7.1 菌群變化與臨床特征的相關性分析 肝癌患者腸道內機會致病菌(擬桿菌屬+韋榮球菌屬+埃希氏菌屬+梭桿菌屬+梭菌屬)與肝功能Child-Turcotte-Pugh(CTP)評分顯著弱正相關,與ALT極顯著弱正相關,與TBil、AST極顯著中等程度正相關;潛在益生菌(普氏菌科+毛螺菌科+瘤胃菌科)與CTP評分呈顯著弱負相關,與Alb呈顯著弱正相關,與ALT呈顯著弱負相關,與TBil、AST呈極顯著中等程度負相關(P值均<0.05)(表3)。

圖8 物種進化分支圖

指標機會致病菌1)r值P值潛在益生菌2)r值P值CTP 評分0.2450.049-0.3140.011TBil0.421<0.001-0.490<0.001Alb-0.2350.0600.2850.022PT0.2130.088-0.2250.072APTT0.1720.170-0.1820.146NH30.1250.322-0.1310.299ALT0.3270.008-0.3740.002AST0.446<0.001-0.528<0.001Neutrophil0.1230.330-0.1670.182CRP0.1430.255-0.1970.116Tumor size -0.0300.8110.0250.843
注:1)機會致病菌包括:擬桿菌屬、韋榮球菌屬、埃希氏菌屬、梭桿菌屬、梭菌屬;2)潛在益生菌包括:普氏菌科、毛螺菌科、瘤胃菌科。
2.7.2 肝癌不同分期腸道菌群變化 差異菌中的機會致病菌及潛在益生作用菌的菌群相對豐度隨著肝癌不同分期未發現相應變化趨勢(圖9)。

圖9 肝癌不同分期機會致病菌及潛在益生菌相對豐度
2.7.3 肝癌不同肝功能分級腸道菌群變化 差異菌中的機會致病菌相對豐度隨著肝功能Child-Pugh分級遞增而增加,Child-Pugh C級高于A級(Z=4.301,P=0.038)與B級(Z=4.063,P=0.044);而潛在益生作用菌的相對豐度隨著肝功能Child-Pugh分級的增加呈現減少趨勢,Child-Pugh C級低于A級(Z=3.882,P=0.049)(圖10、11)。

圖10 肝癌不同肝功能分級機會致病菌及潛在益生菌相對豐度

注:a, 機會致病菌;b,潛在益生菌。
3 討論
肝臟通過門靜脈接觸到細菌成分和代謝物,已有多項研究[7-8]表明腸道微生物組分對肝癌有深遠影響。臨床研究[9-10]發現益生菌可通過調整腸內菌群結構比例,降低腸道黏膜通透性,修復腸黏膜上皮細胞及促進其黏液分泌等機制減少化療后消化道癥狀的發生率及反應程度。而肝癌患者TACE治療后腸道菌群經益生菌調理,可有效降低肝癌患者血中的內毒素脂多糖并減少TACE治療后消化道副反應的發生率及副反應程度,肝功能受損也得以改善。同時調節腸道益生菌群可明顯提高TACE治療的有效性及患者的依從性。但是目前益生菌種類多樣,效應機制并未完全了解,且缺乏針對肝癌特異的益生菌治療靶點研究。
為了探討以上問題,本研究對比原發性肝癌患者與健康者腸道菌群組成在不同物種分類水平上的差異后發現腸道菌群豐富度及多樣性均低于健康人群,表現為益生菌減少,而大腸桿菌屬、梭桿菌屬等機會性致病菌增加。進一步分析差異菌群的相關生理功能發現其主要與短鏈脂肪酸生成相關,而大量研究[11-13]表明短鏈脂肪酸可通過抑制炎性NF-κB因子表達從而減少TNFα、IL-6的生成及增強抗炎細胞免疫活性而發揮抗炎作用,通過降低腸內pH值限制致病菌生長,促進腸受損黏膜組織修復增強腸黏膜保護[14-15]并改善效應T淋巴細胞功能而增強腫瘤免疫應答。因此初步提出產短鏈脂肪酸益生菌具有成為治療肝癌輔助手段的潛力。
另一方面,臨床上TACE治療后患者常伴隨肝功能損害及惡心、嘔吐、腹痛等胃腸道反應而拒絕進一步系統治療,本研究希望找到造成這些反應的腸道微生態方面原因。但對TACE治療前后肝癌患者腸道微生態的比較發現兩組間腸道菌群物種豐富度及均勻度相似,TACE治療后菌群結構未發生明顯改變。雖未能支持研究的預期,但一定程度上表明TACE術對機體造成的創傷較小,且對腸道菌群結構影響微弱。TACE前后菌群變化不顯著可能與取材時間有關系,需要進一步延長觀測時間及增加取材次數。
肝癌的進展是一個漸進的過程,為了了解在此過程中腸道微生態是否動態變化,變化的規律如何,本研究通過菌群變化與臨床特征的相關性分析發現腸道菌群失調與肝癌相關并隨著肝功能Child-Pugh等級的遞增,提示對于肝損傷程度高的患者有必要行腸內菌群調整的干預治療。考慮到本研究符合納入標準的樣本量有限,且肝癌組和TACE組樣本大部分有肝硬化背景。因此本研究結果存在與肝硬化及肝硬化的嚴重程度相關的可能性,未來仍需進一步納入肝硬化組患者、擴大研究對象或開展基于多中心的前瞻性實驗。
綜上,本研究通過對比分析肝癌患者與健康人、TACE治療前后腸道菌群多樣性及菌群結構變化,初步探討腸道微生態變化與肝癌的關系,為肝癌患者益生菌制劑的研發提供些許參考。

