NOD1、SIRT1、IL-1β及MMP3與胎膜早破關系的研究
宋春紅,楊蓉娟,甄娟△,吳莎,韓彥潔
胎膜早破(premature rupture of the membranes,PROM)嚴重影響母嬰健康,其發病與感染、營養、社會經濟因素密切相關,涉及炎癥、凋亡、基因多態性等多種調控途徑。雖經大量研究,PROM 的病因學及其發病機制仍不清楚,臨床上對其預測和防治仍不理想。研究表明,宮內感染及絨毛膜羊膜炎是造成PROM 的最重要原因之一[1-2]。核苷酸結合寡聚化結構域受體(NOD)1 作為模式識別受體之一,可以識別細菌細胞壁肽聚糖及其裂解產物內消旋-二氨基庚二酸(iE-DAP),介導細菌引起的炎癥反應[3]。沉默配型信息調節蛋白(SIRT)1屬于SIRT家族,具有乙酰化酶活性,可發揮維持基因組穩定性、抗 氧化及抗炎作用[4]。目前對NOD1、SIRT1 在PROM中的作用研究較少。本研究通過檢測胎膜早破患者胎膜組織NOD1、SIRT1表達及羊水基質金屬蛋白酶(MMP)-3 與白細胞介素(IL)-1β 水平,分析各分子表達的相關性,以期從因子水平深入探討PROM的發病機制,尋找新的預防及治療途徑。
1 資料與方法
1.1 一般資料 選擇2015年1月—2016年12月在本院產檢并住院、以剖宮產結束分娩的單胎初產婦90例,分組情況如下:(1)足月胎膜早破(term premature rupture of the fetal membranes,tPROM)組30 例,年齡(29.3±2.7)歲,孕(38.9±1.1)周。(2)未足月胎膜早破(preterm premature rupture of the fetal membranes,pPROM)組30 例,年齡(26.2±4.0)歲,孕(35.0±1.0)周。(3)正常對照組(正常足月妊娠婦女)30 例,年齡(28.7±3.5)歲,孕(38.7±1.1)周。3組產婦無羊水過多、妊娠期高血壓等并發癥,無胎兒染色體異常。PROM的診斷標準參見樂杰等主編的第7版《婦產科學》。PROM組破膜至新生兒出生時間間隔<12 h,剖宮產前均未臨產、未使用抗生素預防感染。tPROM組羊水細菌培養陽性率26.7%,pPROM組細菌培養陽性率33.3%,2組比較差異無統計學意義(χ2=0.317,P>0.05)。本試驗經醫學倫理委員會批準,采集標本均經過知情同意。
1.2 標本采集 孕婦行剖宮產手術時取羊水5 mL,離心后取上清液,-70 ℃冰箱保存。胎盤娩出后,于胎膜破口附近處取全層胎膜組織,一部分以滅菌生理鹽水漂凈后,放于凍存管中-70 ℃保存、備用;另一部分胎膜組織制作胎膜卷放于10%中性福爾馬林溶液固定24 h。
1.3 主要試劑 兔抗人NOD1 多克隆一抗購自美國Santa Cruz公司,兔抗人SIRT1多克隆一抗購自美國Sigma公司,山羊抗兔二抗、免疫組化通用型SP 檢測試劑盒購自上海基因科技有限公司,兔抗人β-actin 單克隆一抗及IL-1β、MMP3 ELISA檢測試劑盒購自武漢博士德生物工程公司。
1.4 免疫組化染色檢測胎膜組織中NOD1 及SIRT1 的表達部位 采用SP法。胎膜組織固定后,常規脫水、透明、浸蠟,石蠟包埋、切片,嚴格按實驗流程進行免疫組化操作。觀察NOD1 及SIRT1 在胎膜組織中的表達部位。判讀標準:陽性細胞表現為細胞膜/漿/核出現清晰的黃色、棕黃色或棕褐色,陰性細胞表現為染色與背景一致或無明顯著色。
1.5 Western blot 檢測胎膜組織NOD1 及SIRT1 蛋白表達水平 胎膜組織剪碎后,用RIPA 細胞裂解液法提取胎膜勻漿蛋白,測濃度后取60 μg 蛋白樣本進行SDS-PAGE 電泳,用Bio-Rad 轉移裝置將蛋白轉移至硝酸纖維素薄膜,結束后將薄膜放入5%脫脂奶粉封閉,NOD1 及SIRT1 一抗4 ℃過夜。第2 天洗膜后加入羊抗兔二抗,37 ℃孵育1 h,棄去二抗,洗滌,增強化學熒光發光法暗室曝光顯影。對圖像進行掃描,以各目的蛋白與β-actin的吸光度值比值作為各目的蛋白的相對表達量。
1.6 羊水IL-1β及MMP3水平檢測 羊水中IL-1β及MMP3水平測定采用ELISA法,嚴格按照試劑盒說明書操作。
1.7 統計學方法 采用SPSS 15.0 軟件進行分析,計量數據以±s表示,多組間數據比較采用單因素方差分析,組間多重比較采用LSD-t法。采用直線相關分析分析兩變量相關性。計數資料比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 NOD1 及SIRT1 在胎膜組織中的表達部位 在胎膜組織,NOD1主要表達于羊膜上皮細胞、蛻膜細胞和絨毛膜滋養細胞細胞漿,PROM 組胎膜組織中NOD1 表達強度高于正常對照組,pPROM 組NOD1表達強度高于tPROM組。SIRT1主要表達于蛻膜細胞和絨毛膜滋養細胞細胞核及細胞漿,少量表達于羊膜上皮細胞核及細胞漿,PROM 組胎膜組織中SIRT1表達較正常對照組降低,見圖1。
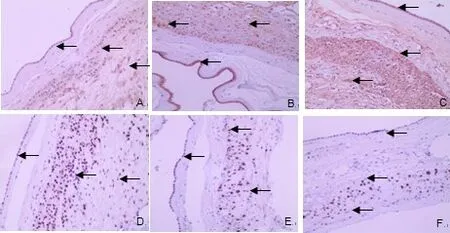
Fig.1 Expressions of NOD1 and SIRT1 in fetal membranes(DAB,×100)圖1 NOD1及SIRT1在胎膜組織中的表達(DAB,×100)
2.2 各組胎膜組織中NOD1及SIRT1的表達水平比較 tPROM 組、pPROM 組胎膜組織中NOD1 相對表達水平較正常對照組升高(P<0.05),pPROM 組NOD1 表達高于tPROM 組(P<0.05)。tPROM 組、pPROM 組胎膜組織中SIRT1 相對表達水平較正常對照組降低(P<0.05),tPROM組與pPROM組SIRT1表達水平差異無統計學意義(P>0.05),見圖2、表1。

Fig.2 Expressions of NOD1 and SIRT1 in fetal membranes measured by Western blot assay圖2 NOD1及SIRT1在胎膜組織中的蛋白表達水平
Tab.1 Expression levels of NOD1 and SIRT1 in fetal membranes measured by Western blot assay表1 各組胎膜組織中NOD1及SIRT1蛋白灰度值與β-actin比值(n=30,±s)
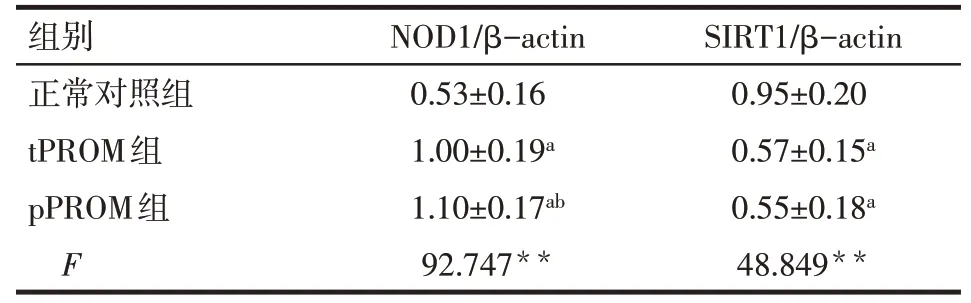
Tab.1 Expression levels of NOD1 and SIRT1 in fetal membranes measured by Western blot assay表1 各組胎膜組織中NOD1及SIRT1蛋白灰度值與β-actin比值(n=30,±s)
**P<0.01;a與正常對照組比較,b與tPROM組比較,P<0.05
組別正常對照組tPROM組pPROM組F NOD1/β-actin 0.53±0.16 1.00±0.19a 1.10±0.17ab 92.747**SIRT1/β-actin 0.95±0.20 0.57±0.15a 0.55±0.18a 48.849**
2.3 各組羊水IL-1β、MMP3 水平比較 tPROM 組、pPROM 組羊水IL-1β、MMP3 水平較正常對照組顯著升高(均P<0.05),pPROM 組較tPROM 組表達水平升高(均P<0.05),見表2。
Tab.2 The expression levels of IL-1β and MMP3 in amniotic fluid in three groups表2 各組羊水IL-1β及MMP3水平(n=30,±s)

Tab.2 The expression levels of IL-1β and MMP3 in amniotic fluid in three groups表2 各組羊水IL-1β及MMP3水平(n=30,±s)
**P<0.01;a與正常對照組比較,b與tPROM組比較,P<0.05
組別正常對照組tPROM組pPROM組F IL-1β(ng/L)3.37±1.17 12.76±3.31a 17.69±4.98ab 128.178**MMP3(μg/L)1.81±0.72 2.17±0.64a 2.75±0.69ab 18.426**
2.4 NOD1、SIRT1 與IL-1β 及MMP3 水平的相關性分析 胎膜組織中NOD1 表達與羊水IL-1β、MMP3水平呈正相關(r分別為0.509、0.598,P<0.01);胎膜組織中SIRT1表達與羊水IL-1β、MMP3水平呈負相關(r分別為-0.408、-0.337,P<0.01)。
3 討論
感染與炎癥在PROM發生中占主要原因且與其互為因果[5]。炎癥可以導致炎性因子釋放增加,前列腺素、MMP合成及激活,導致胎膜破裂、宮頸擴張從而發動分娩。NOD1激活可以促進炎性細胞因子釋放,激活炎癥反應,SIRT1 可以抑制炎癥反應,目前對NOD1及SIRT1在PROM中的研究較少,本研究重點關注PROM 患者NOD1、SIRT1、IL-1β 與MMP3的表達及其相互關系。
MMP 對細胞外基質的降解在PROM 發生中發揮了關鍵作用。MMP3 是MMP 家族中重要一員,在宮頸、妊娠相關組織如胎盤、胎膜中表達,在分娩、PROM、細胞因子誘導等情況下,MMP3生成及激活,降解、破壞細胞外基質及基膜,并激活其他類型的MMP,促使胎膜張力減弱,促進PROM 的發生[6-7]。本研究結果顯示,PROM 組羊水中MMP3 表達水平較正常對照組增高,促進了胎膜細胞外基質水解。
宮內感染發生后,可以導致炎癥反應,炎性細胞因子如IL-1β及趨化因子釋放。趨化因子促進子宮和胎膜白細胞募集,進一步導致炎性細胞因子(如IL-1β及IL-6)釋放。IL-1β可以激活環氧合酶2、促進子宮前列腺素產生,促進MMP 表達增加,導致細胞外基質降解及PROM 的發生[8]。在巴西人群中,IL1β-31T(rs1143627)多態性位點與未足月PROM/早產家族史及分娩時間相關[9]。本研究顯示,PROM組患者羊水中IL-1β 水平較正常對照組升高,與PROM發生相關。
NOD1 屬于胞漿內核苷酸結合寡聚化結構域樣受體家族成員,可以識別細胞漿內病原相關分子模式和損傷相關分子模式,從而誘導免疫應答。NOD1可以識別革蘭陰性細菌及一些革蘭陽性細菌的細胞壁肽聚糖及其裂解產物iE-DAP,激活受體相互作用絲氨酸蘇氨酸蛋白激酶2,通過系列信號轉導途徑,最終激活核因子(NF)-κB,使其轉位至細胞核內,促使靶基因轉錄,如編碼IL-6、IL-1β 和腫瘤壞死因子(TNF)-α 基因[10];亦可激活絲裂原活化蛋白激酶類分子途徑,促進促炎分子如IL-1β、IL-6 及TNF-α的表達,從而激活免疫應答[11-12]。NOD1存在于胎盤滋養細胞中,在足月胎盤滋養細胞,NOD1被iE-DAP 激活后,可以導致IL-6 及單核細胞趨化蛋白1 等分泌;給予C57BL/6J 孕小鼠模型大劑量iEDAP 可在20 h 內導致小鼠早產;低劑量iE-DAP 雖不會導致早產但可以導致胎鼠體內產生眾多細胞因子和趨化因子[13]。在體外培養羊膜細胞中,NOD1激活可以促進炎性細胞因子如IL-1β 和IL-6 的釋放[14]。本研究證實,NOD1 表達于胎膜組織,且在PROM組胎膜組織中NOD1表達較正常對照組升高,與羊水IL-1β及MMP3表達呈正相關,表明NOD1作為上游信號因子,可能通過直接或間接作用促進炎性細胞因子及MMP3表達,參與胎膜破裂的發生。
人SIRT1基因位于染色體10q 21.3區域,具有一個高度保守的氧化型煙酰胺腺嘌呤二核苷酸(NAD+)依賴的核心區域。SIRT1 兼具組蛋白及非組蛋白乙酰化酶活性,其主要功能有維持基因組穩定、抗氧化、維持端粒的結構與功能、調控糖和脂肪代謝、調控炎癥反應等。在PROM患者中,感染和炎癥導致細胞因子、前列腺素內過氧化物合酶2 和前列腺素以及細胞外基質構建相關酶如MMP3 激活,導致子宮收縮及胎膜破裂。NF-κB與上述炎性因子的激活密切相關。SIRT1 可與NF-κB 的P65 亞基K310位點結合去乙酰化,從而降低NF-κB的轉錄活性,抑制靶基因的表達,發揮抗炎作用[15]。另外,在臍靜脈內皮細胞,SIRT1 可以抑制固有免疫受體如NOD 樣受體蛋白3 炎性小體激活、進而抑制Caspase-1 裂解 及IL-1β 分泌,從而抑制炎癥反應[16],而NOD 樣受體蛋白3 表達升高在PROM 中發揮了重要作用[17]。SIRT1在人類妊娠組織中表達且發揮作用。SIRT1在妊娠期糖尿病患者胎盤組織中表達降低,與蛋白激酶B-哺乳動物雷帕霉素靶蛋白協同,參與了妊娠期糖尿病患者巨大兒及體脂率異常的發生[18]。本研究結果表明,PROM 患者胎膜組織中,SIRT1 相比正常對照組表達降低,且與羊水IL-1β及MMP3表達呈負相關,可能機制為PROM胎膜組織中SIRT1 表達減少,對NF-κB 的轉錄調控作用抑制減弱,導致炎性因子表達升高。
綜上,本研究顯示,PROM 患者胎膜組織中NOD1表達升高、SIRT1表達水平降低,羊水中IL-1β及MMP3 水平升高,NOD1 與羊水IL-1β 及MMP3 表達呈正相關,SIRT1與羊水IL-1β表達呈負相關。由此推斷,在PROM發生發展過程中,NOD1、促炎細胞因子、MMP3 信號轉導通路分子表達水平升高及激活,而SIRT1 表達水平降低,對炎癥抑制作用減弱。減少NOD1、IL-1β 及MMP3 表達或抑制上述分子活性、增強SIRT1 表達或活性可能為PROM 的預防和治療提供新途徑。

