金佛手酵素發酵過程中有機酸及其體外抗氧化性能分析
方 晟,陳俊沲,周 瑾,沙如意,毛建衛,3,*
(1.紹興文理學院元培學院,浙江紹興 312000; 2.浙江科技學院生物與化學工程學院,浙江省農產品化學與生物加工技術重點實驗室,浙江杭州 310023; 3.浙江工業職業技術學院,浙江紹興 312000)
食用植物酵素(Edible plant Jiaosu)是以新鮮蔬菜、水果、藥食兩用本草類為原料,經多種有益菌通過較長時間發酵而生產的功能性發酵產品,研究表明,酵素可有效清除體內過剩的活性氧自由基,在預防和治療因自由基誘發的疾病和抗衰老方面具有廣闊的應用前景[1-2]。食用植物酵素既保持了植物自身營養成分、也含有乳酸菌等有益微生物及其代謝產生的功能性小分子物質等,其中有機酸是一項重要指標,對酵素產品的特有風味及抗氧化等功能性作用有重要貢獻[3-4]。目前酵素品類繁多,但品質差別大,且相關科學研究支撐不足,亟需深入開展食用植物酵素發酵過程功能組分和功效研究,進而用標準化手段規范傳統工藝,保證酵素的品質。
佛手(CitrusmedicaL. var. sarcodactylis Swingle)為蕓香科柑橘屬植物香櫞的1個變種,是國家衛計委公布的首批“藥食同源”植物之一,現主要分布于浙江、四川、福建和廣州等地,其中以浙江金華生產的金佛手最為著名,被稱為“果中之仙品,世上之奇卉”,不僅含有黃酮、香豆素、氨基酸等活性成分,還含有琥珀酸等有機酸,藥理實驗表明,其具有抗腫瘤、降血糖、抗氧化、消炎等作用[5-6]。目前金佛手在功能性食品領域的深入開發較少,主要用于制作佛手茶、佛手酒、佛手果脯等,附加值相對較低[7]。從食用安全性和保健功效考慮,金佛手是開發食用植物酵素的優良植物資源,但目前未見關于金佛手酵素的研究報道。
本研究以金佛手為主要原料制備食用植物酵素,探討對其自然發酵過程中體外抗氧化性能、有機酸組成及含量的變化規律,以期為金佛手酵素產品的開發及精準制備提供科學依據。
1 材料與方法
1.1 材料與儀器
金佛手鮮果 金華汝來佛手有限公司;發酵糖液 浙江省農產品化學與生物加工技術重點實驗室提供;α,α-二苯基-β-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)、煙酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NADH)、吩嗪硫酸甲酯(Phenazine Methosulfate,PMS)、硝基四氮咪唑藍(Nitrotetrazolium blue chloride,NBT)、2,2-聯氮基-雙-(3-乙基苯并噻唑啉-6-磺酸)二氨鹽(2,2′-Azino-bis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、有機酸標準品(草酸、L-酒石酸、L-蘋果酸、莽草酸、抗壞血酸、乳酸、乙酸、檸檬酸、琥珀酸、馬來酸、沒食子酸,均為分析純,純度≥99%) 美國Sigma公司;三羥甲基氨基甲烷(Tris)、磷酸氫二鉀、磷酸、甲醇、鐵氰化鉀、三氯乙酸、三氯化鐵、水楊酸鈉、硫酸亞鐵、鹽酸 均為分析純,上海展云化工有限公司。
LC-20A高效液相色譜儀 島津公司;TU-1810紫外可見分光光度計 上海儀電分析儀器有限公司;PHS-3C酸度計 上海佑科儀器儀表有限公司;Allegra X-12R型冷凍離心機 美國貝克曼庫爾特有限公司;SW-CJ-1B超凈工作臺 蘇州安泰空氣技術有限公司。
1.2 實驗方法
1.2.1 金佛手酵素的制備 參考程勇杰等[8]的方法,用去離子水清洗金佛手鮮果表面,去除雜質,自然晾干表面水分,將其切塊后與發酵糖液按質量比3∶5混勻共6 kg,加入到已滅菌的10 L玻璃瓶中密封,25 ℃下避光發酵。發酵過程中,分別在第5、10、15、20、25、30、40、50、60、70、80、90 d取樣,樣品于10000 r/min離心10 min后,保留上清液待測。
1.2.2 超氧自由基清除率的測定 采用PMS/NADH體系還原NBT法[9],取1.2.1所述上清液50 μL加入到950 μL磷酸緩沖液(0.1 mol/L,pH7.4),然后加入1 mL 120 μmol/L的PMS(用0.1 mol/L的PBS配制,pH=7.4),1 mL 936 μmol/L的NADH(用0.1 mol/L的PBS配制,pH=7.4)和1 mL 300 μmol/L的NBT(用0.1 mol/L的PBS,pH=7.4配制)。在環境溫度下反應5 min。以去離子水為參比溶液。在560 nm處測定吸光度。
超氧自由基清除率(%)
式中:A0為空白對照液吸光度;A1為樣品測定管吸光度;A2為樣品本底管吸光度。
1.2.3 羥基自由基清除率的測定 采用Fenton法[10],取1.2.1所述上清液335 μL加入到1.4 mL 6 mmol/L的H2O2,加入0.6 mL 20 mmol/L的水楊酸鈉和2 mL 1.5 mmol/L的硫酸亞鐵,37 ℃下恒溫水浴1 h。以去離子水為參比溶液。在562 nm下測定吸光度。
羥基自由基清除率(%)
式中:A0為空白對照液吸光度;A1為樣品測定管吸光度;A2為樣品本底管吸光度。
1.2.4 DPPH自由基清除率的測定 采用DPPH甲醇溶液顯色法[11],取1.2.1所述上清液40 μL加入到4 mL 0.1 mmol/L的DPPH-甲醇溶液中,再加入450 μL 50 mmol/L的Tris-HCL buffer(pH=7.4),25 ℃下恒溫水浴30 min。以去離子水為參比溶液。在517 nm處測定吸光度。
DPPH自由基清除率(%)
式中:A0為空白對照液吸光度;A1為樣品測定管吸光度;A2為樣品本底管吸光度。
1.2.5 ABTS自由基清除率的測定 采用ABTS過硫酸鉀顯色法[12],用7 mmol/L的ABTS(用5 mmol/L的PBS配制,pH=7.4),加入過硫酸鉀,最終濃度為2.45 mmol/L,在室溫下黑暗放置12~16 h。使用前把ABTS自由基用PBS稀釋成在734 nm下吸光度為0.7±0.02。取1.2.1所述上清液10 μL加入到5 mL上述稀釋液中,在30 ℃下反應5 min。以去離子水為參比溶液。在734 nm處測定吸光度。
ABTS自由基清除率(%)
式中:A0為空白對照液吸光度;A1為樣品測定管吸光度;A2為樣品本底管吸光度。
1.2.6 還原力的測定 采用鐵氰化鉀法[13],取1.2.1所述上清液30 μL加入到2.5 mL磷酸緩沖液(0.2 mol/L,pH=6.6),然后加入2.5 mL質量濃度1%鐵氰化鉀,50 ℃反應30 min,再加入質量濃度10%三氯乙酸2.5 mL,在3000 r/min下離心10 min,立即取2.5 mL上清液,加入2.5 mL去離子水和0.5 mL質量濃度0.1%三氯化鐵。以去離子水為參比溶液。在700 nm處測定吸光度。
1.2.7 有機酸含量的測定 有機酸含量的測定采用高效液相色譜法,參考Radrigo等[14]的方法進行。HPLC分離條件:色譜柱為Agilent TC-C18柱(250 mm×4.6 mm i.d.,5 μm),流動相為0.01 mol/L的KH2PO4溶液(用磷酸調pH=2.7),流速1 mL/min,柱溫20 ℃,檢測波長210 nm。1.2.1所述上清液用0.01 mol/L的KH2PO4溶液(pH=2.7)稀釋5倍,0.22 μm微孔濾膜過濾后直接進樣。
1.3 數據處理
全部試驗均平行進行3次,試驗結果表示為均值±標準差(Mean±SD)形式。采用SPSS 21.0軟件進行單因素方差分析、聚類分析及相關性分析,采用Origin 86軟件繪制圖表。
2 結果與分析
2.1 金佛手酵素發酵過程中體外抗氧化活性的變化
2.1.1 發酵過程中超氧自由基清除率的變化 超氧自由基在活性氧物質如過氧化氫、單線態氧的形成中起重要作用,主要損害細胞膜,包括血管內皮細胞膜及亞微結構,并引起一系列有害的生化反應[15]。圖1中,金佛手酵素的超氧自由基清除率在5~15 d迅速上升,隨后基本保持穩定,直到60 d時上升到最高后下降,80~90 d顯著上升(P<0.05),60 d時清除率達到94.39%,相較發酵5 d時提高19.33%。蔣增良等[16]研究發現葡萄酵素自然發酵過程中對超氧自由基的清除能力呈先增加后略微降低再增加的趨勢,第56 d時達到最大,清除率為65.22%,相較發酵前增加了12.8%,與本實驗研究結果相似。
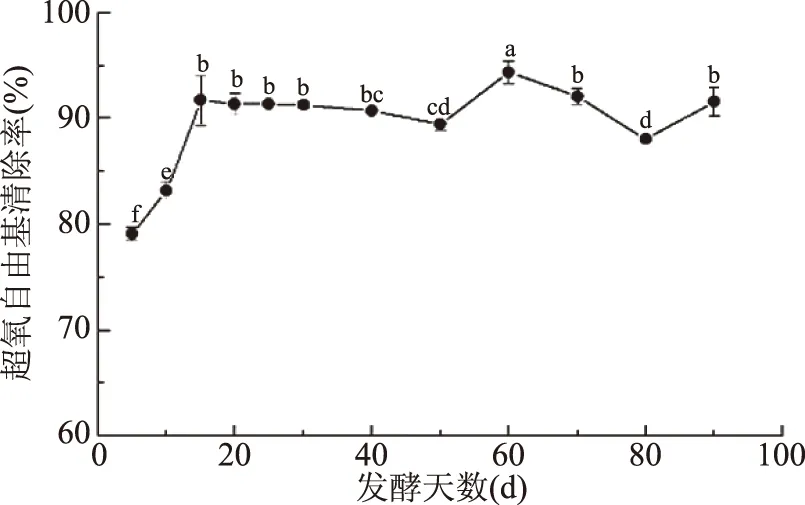
圖1 發酵過程中超氧自由基清除率的變化Fig.1 Change in superoxide radicalscavenging rate during fermentation注:不同字母表示差異顯著(P<0.05);圖2~圖5同。
2.1.2 發酵過程中羥基自由基清除率的變化 羥基自由基是生物體內極具反應性的自由基,它幾乎能與活細胞中任何生物大分子發生反應,且反應速度極快,在自由基病理學上被認為具有高度的損傷性[10,17]。圖2表明,金佛手酵素的羥基自由基清除率在5~20 d之間快速提升(P<0.05),之后呈緩慢上升的趨勢,在發酵90 d時達到最高,為54.16%,相較發酵5 d時提高了270.64%。說明延長發酵時間有利于金佛手酵素對羥基自由基清除率的提高。包永春[18]發現乳酸、蘋果酸和酒石酸均具有清除羥基自由基的能力;也有研究表明酵母壁上多糖具有一定的羥基自由基清除能力[17];因此金佛手酵素羥基自由基清除能力的提高可能是有機酸、多糖等物質綜合作用的結果。
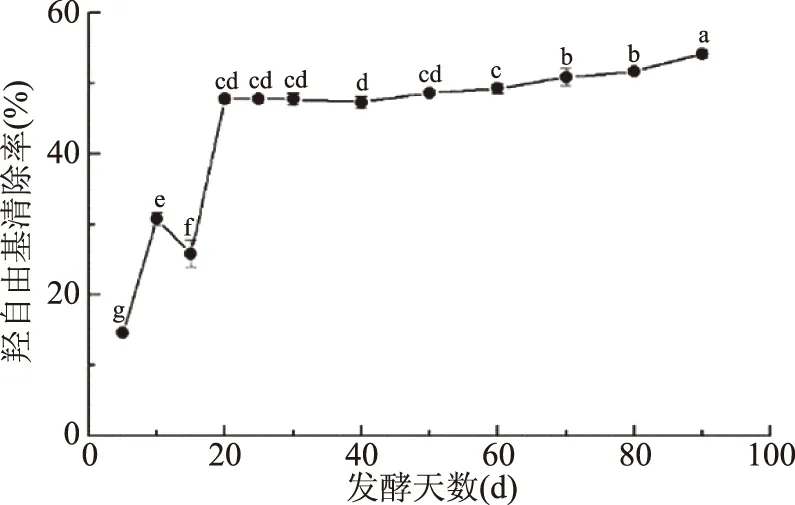
圖2 發酵過程中羥基自由基清除率的變化Fig.2 Changes in hydroxyl radicalscavenging rate during fermentation
2.1.3 發酵過程中DPPH自由基清除率的變化 DPPH是一種穩定的有機氮自由基,在乙醇溶液中顯深紫色,能吸收抗氧化物的電子而引起樣品顏色的改變,其褪色程度與接受電子數成正比[19]。DPPH自由基清除能力是評價抗氧化性能的常用方法,實驗驗證其具有良好的敏感性[20]。如圖3所示,金佛手酵素的DPPH自由基清除率在發酵過程中呈先上升后下降,再緩慢上升的變化(P<0.05),發酵20 d時清除率最高,達到60.90%,相較發酵5 d時提高了42.08%。張巧等[21]研究表明大果山楂酵素在自然發酵過程中DPPH自由基清除率呈先上升后下降的變化趨勢,在20 d時達到峰值,為84.11%,與本研究結果類似。
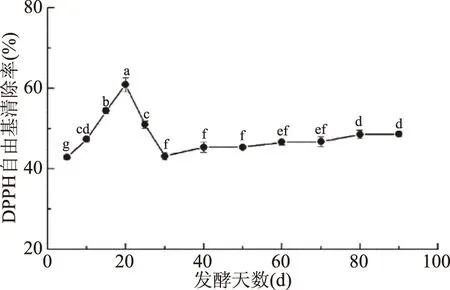
圖3 發酵過程中DPPH自由基清除率的變化Fig.3 Changes in DPPH radicalscavenging rate during fermentation
2.1.4 發酵過程中ABTS自由基清除率的變化 由圖4可知,金佛手酵素發酵過程中ABTS自由基清除率總體呈緩慢上升趨勢,發酵70 d時清除率最高,達到40.09%,相較發酵5 d時提高了30.10%。蔣增良等[16]研究發現葡萄酵素的ABTS自由基清除率在自然發酵過程中一直呈上升趨勢,在56 d后達到最高的68.48%,與未發酵之前相比提高了17.2%。ABTS自由基是一種過氧化氫酶的底物,蔣增良等[4]研究表明:有機酸、維生素和酚類物質具有清除ABTS自由基的能力,其作用取決于分子質量、芳香環數量和羥基取代基等。
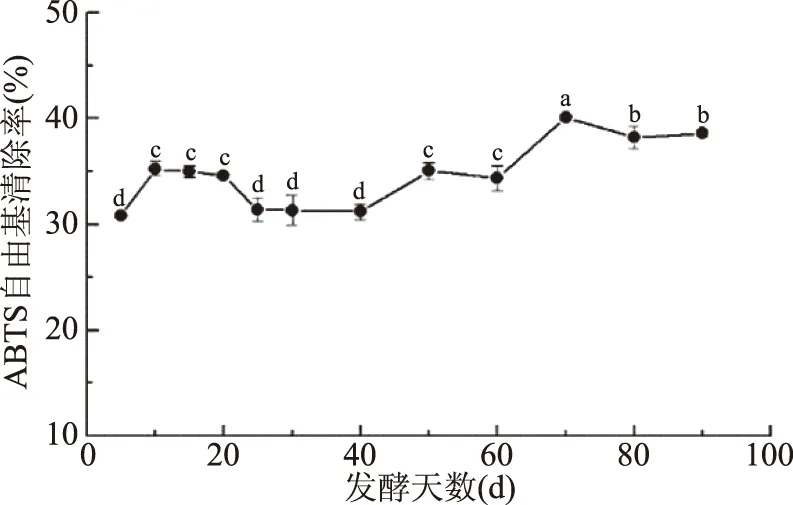
圖4 發酵過程中ABTS自由基清除率的變化Fig.4 Change in ABTS radicalscavenging rate during fermentation
2.1.5 發酵過程中還原力的變化 還原力的大小不僅與自由基的清除有關,還與過氧化物降解等因素有關[8]。從圖5可見,金佛手酵素發酵過程中還原力的變化趨勢與DPPH自由基清除率相似,呈先上升后降低,再緩慢上升的變化。發酵15 d時去除率最高,達到0.619,相較發酵5 d時提高了21.52%。郭艷萍等[22]對葡萄酵素進行研究,發酵過程中還原力在18 d時達到峰值后下降,之后又呈上升趨勢,與本研究結果相似。
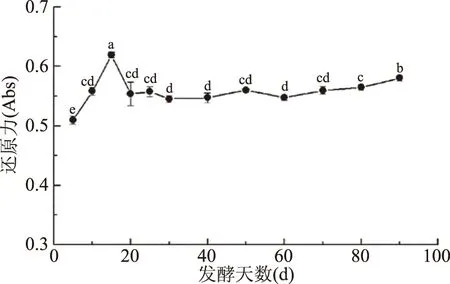
圖5 發酵過程中還原力的變化Fig.5 Change in reducing power during fermentation
2.2 金佛手酵素發酵過程中有機酸的變化
圖6為有機酸標準品HPLC色譜圖,圖7為發酵90 d時金佛手酵素樣品有機酸HPLC色譜圖,由圖6、圖7可知,金佛手酵素中有機酸組成豐富,包括草酸、L-酒石酸、L-蘋果酸、莽草酸、抗壞血酸、乳酸、乙酸、檸檬酸和琥珀酸,馬來酸和沒食子酸未檢出。
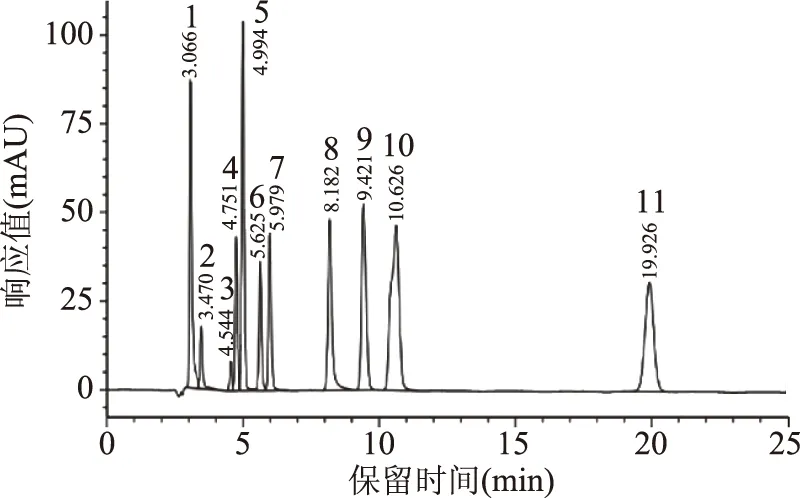
圖6 有機酸標準品的HPLC色譜圖Fig.6 HPLC Chromatograms of organic acids standard注:1為草酸;2為L-酒石酸;3為L-蘋果酸;4為莽草酸;5為抗壞血酸;6為乳酸;7為乙酸;8為檸檬酸;9為琥珀酸;10為馬來酸;11為沒食子酸;圖7同。
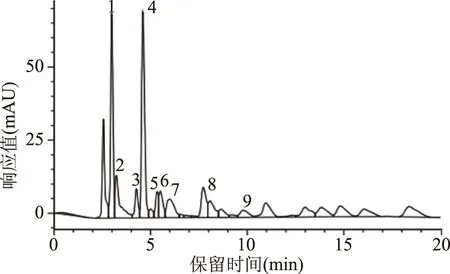
圖7 發酵90 d金佛手酵素樣品有機酸的HPLC色譜圖Fig.7 Organic acids HPLC chromatogram ofcitrus bergamot Jiaosu after 90 d fermentation
由表1可見,金佛手酵素的總有機酸含量呈先上升后下降再上升的趨勢,發酵90 時達到最高,為(9.600±0.12) mg/mL,相較發酵5 d時增長105.48%。其中,乙酸、乳酸、L-酒石酸、草酸含量在發酵過程中的變化趨勢與總有機酸含量相似,發酵90 d分別達到(3.212±0.02)、(3.294±0.10)、(1.668±0.02)和(0.879±0.01) mg/mL,顯著高于發酵5 d時的含量(P<0.05),其增幅分別為3080.20%、431.29%、20750.00%和109.29%。而L-蘋果酸、檸檬酸、莽草酸和抗壞血酸含量在發酵過程中總體呈下降趨勢,琥珀酸含量呈先升高后降低變化。
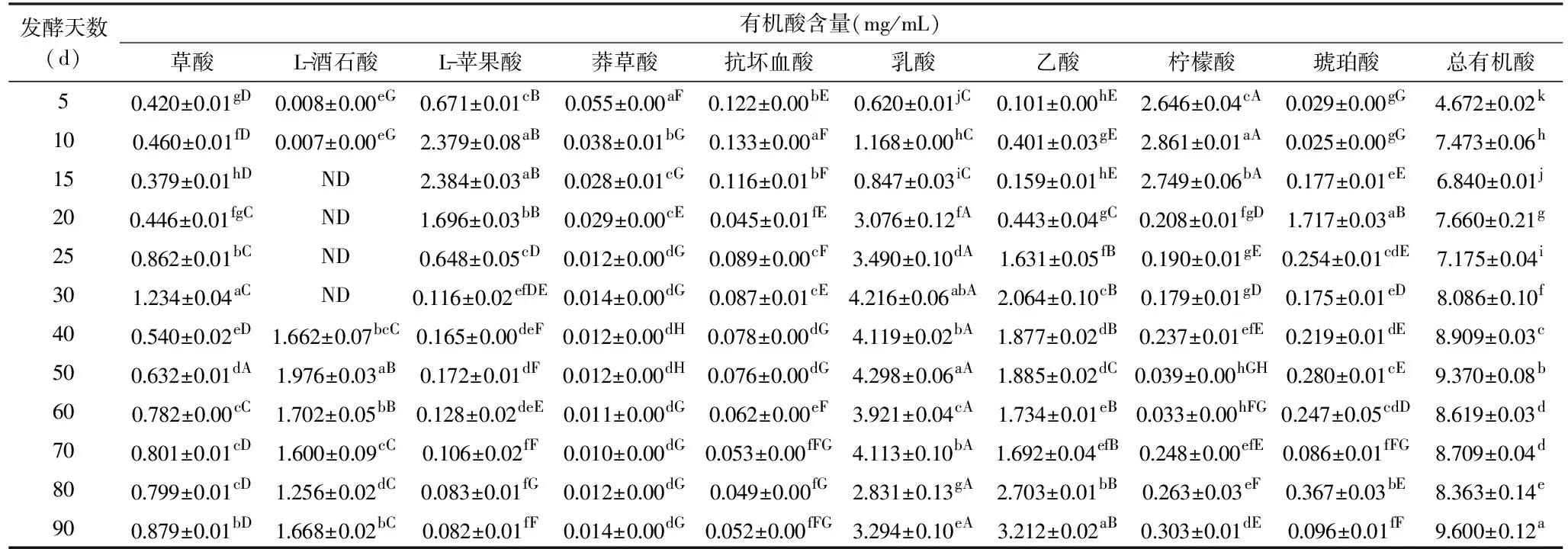
表1 金佛手酵素發酵過程中有機酸含量變化Table 1 Changes in contents of organic acid in Citrus medica Jiaosu during fermentation
發酵5~15 d期間,金佛手酵素的主要有機酸為檸檬酸和L-蘋果酸,發酵15 d時占總有機酸含量的75.05%;發酵40~90 d期間主要有機酸為乳酸、乙酸和L-酒石酸,發酵90 d時占總有機酸含量的85.15%。發酵各時段不同有機酸含量平均值排序為:乳酸>乙酸>檸檬酸>L-酒石酸>L-蘋果酸>草酸>琥珀酸>抗壞血酸>莽草酸。
發酵過程中乳酸、乙酸等的累積以及檸檬酸、L-蘋果酸的消耗可能主要與產酸微生物的代謝有關。目前,從食用植物酵素自然發酵過程中分離得到的優勢菌種主要為酵母菌、醋酸菌和乳酸菌等[23]。酵母菌通過糖降解途徑和三羧酸循環,在生長期可產生大量有機酸[24];醋酸菌在糖源充足的情況下可直接利用葡萄糖生成乙酸,或將酵母菌代謝產生的乙醇轉化為乙酸[2,25];乳酸菌通過糖代謝生成乳酸,在厭氧條件下還可將乳酸氧化轉化為乙酸[26]。L-蘋果酸、檸檬酸和莽草酸是三羧酸代謝循環的中間物質,在乳酸菌等作用下被大量消耗,而抗壞血酸因不穩定可能被氧化,因此在發酵過程中均不容易累積[27-29]。Zeinab等[30]用植物乳桿菌和嗜酸乳桿菌發酵石榴,發酵過程中,檸檬酸的含量逐漸降低,而乳酸、乙酸和丙酸隨著發酵時間的延長,其含量逐漸增加,與本實驗研究結果一致。沙如意等[31]研究同樣發現火龍果酵素發酵過程中乳酸和乙酸含量增加明顯,其中乳酸從發酵初期的5.21 mg/mL增加到40 d時的7.89 mg/mL,提高了51.44%,之后乳酸的含量變化緩慢。馬曉娟[32]用植物乳桿菌發酵胡蘿卜原漿,發現隨著發酵時間的延長,乳酸的含量逐漸增加,蘋果酸的含量逐漸減低。
2.3 發酵過程中有機酸變化時間特性的聚類分析
采用類間平均鏈鎖法(Between groups linkage)對金佛手酵素不同發酵時間的有機酸含量進行聚類分析,結果如圖8所示,在歐式平方距離15處,12個不同發酵時間的金佛手酵素樣品可以聚為二類。第1類發酵階段為5~15 d,其特點是酵素中檸檬酸和L-蘋果酸含量較高,可能是發酵初期由微生物代謝產生的有機酸較少,有機酸主要源自植物材料中水溶性有機酸的溶出[8];第2類發酵階段為20~90 d,其特點是乳酸、乙酸和L-酒石酸含量較高,可能是因為隨著植物材料的降解,環境中的營養物質更為豐富,產酸微生物如乳酸菌、醋酸菌等大量繁殖而生成乳酸等次生代謝產物[23,33]。
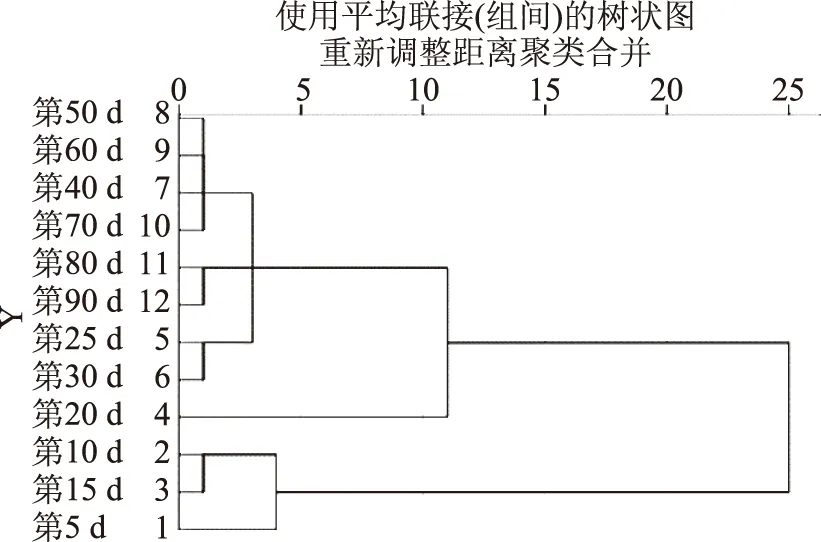
圖8 金佛手酵素發酵時間聚類樹狀圖Fig.8 Dendrogram obtained from clustering analysis offermentation time of Citrus medica Jiaosu
2.4 發酵過程中有機酸種類特性的聚類分析
對金佛手酵素發酵過程不同種類有機酸進行聚類分析,結果見圖9,在歐式平方距離15處,9種有機酸可以分為三類。第1類由乙酸、乳酸、L-酒石酸和草酸組成,聚入此類的有機酸發酵過程中呈先上升后下降再上升的變化趨勢;第2類由L-蘋果酸、檸檬酸、莽草酸和抗壞血酸組成,其特點是隨發酵進行總體呈下降趨勢;第3類為琥珀酸,其含量呈先升高后降低的變化。
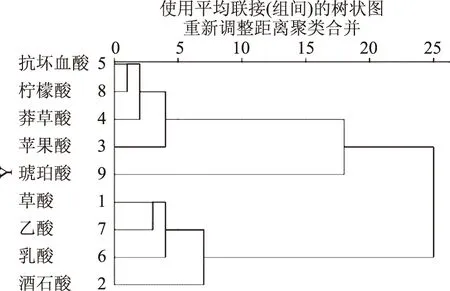
圖9 金佛手酵素有機酸種類聚類樹狀圖Fig.9 Dendrogram obtained from clustering analysis oforganic acid species of Citrus medica Jiaosu
2.5 有機酸含量與體外抗氧化活性的相關性
根據表2,金佛手酵素發酵過程中羥基自由基清除率與乳酸和乙酸含量呈極顯著正相關(P<0.01),相關系數分別達到0.885和0.810,而與草酸和L-酒石酸含量為顯著正相關(P<0.05);超氧自由基清除率與乳酸含量具有顯著正相關(P<0.05),相關系數達到0.689,說明發酵過程中乳酸對金佛手酵素抗氧化性能有一定作用;DPPH自由基清除率與琥珀酸呈極顯著正相關(P<0.01),相關系數為0.786;ABTS自由基清除率與還原力與各種有機酸含量無顯著相關關系,金佛手酵素中可能存在黃酮類等活性物,也會對抗氧化劑起到協同或者增效的作用。乳酸、乙酸含量與L-蘋果酸、檸檬酸和莽草酸含量均呈極顯著的負相關(P<0.01),隨著發酵進行,L-蘋果酸、檸檬酸和莽草酸可能參與代謝被產酸微生物利用生成乳酸和乙酸。
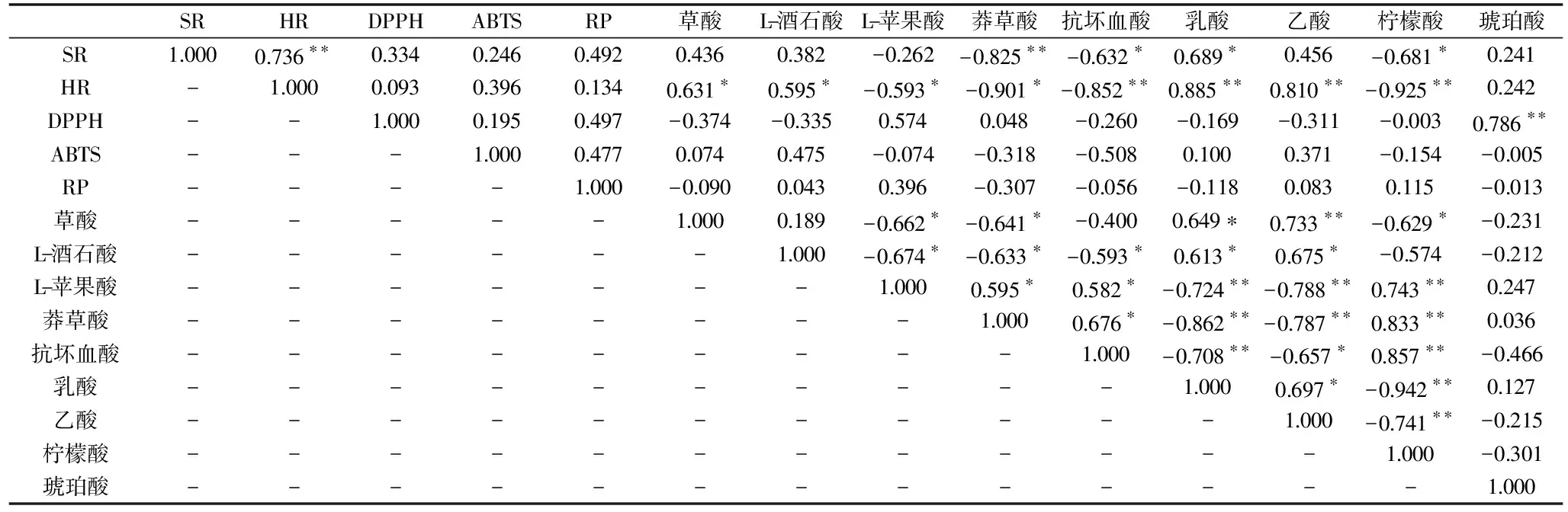
表2 有機酸與抗氧化活性之間的相關系數Table 2 Correlation coefficients between organic acids and antioxidant activity
3 討論與結論
本研究結果表明,隨著發酵時間的延長,金佛手酵素體外抗氧化性能總體呈上升趨勢,因此有必要進一步延長發酵時間,考察其抗氧化性能的變化。國內外學者對葡萄、火龍果、竹葉等果蔬或中草藥制備的酵素進行研究,結果表明發酵過程能夠提高酵素對自由基的清除能力,與本研究結果一致[16,23,31]。酵素發酵過程抗氧化性能的上升變化可能與高糖濃度下原料中抗氧化物質溶出以及微生物代謝有關,郭艷萍等[22]、薛淑龍等[23]、陳小偉等[25]分別對葡萄酵素、咖啡果皮酵素和竹葉酵素天然發酵過程自由基清除能力進行分析,均發現其變化與總酚含量有明顯的正相關性,王益莉等[17]認為蘋果酵素發酵過程羥基自由基清除能力的變化受到酵母數量的影響;蔣增良等[4]研究表明葡萄酵素對自由基的良好清除能力可能是基于有機酸、多酚、維生素和SOD酶的協同作用;沙如意等[31]發現火龍果酵素發酵過程中莽草酸和乙酸與ABTS自由基清除能力呈正相關;程勇杰等[8]發現柘樹酵素抗氧化性能與氨基酸含量具有正相關性。相關性分析結果顯示,金佛手酵素發酵過程中乳酸含量變化與體外抗氧化性能具有顯著的正相關性。金佛手原料中的黃酮、多糖以及揮發油等都具有一定的抗氧化作用,因此有必要對金佛手酵素發酵過程有機酸與黃酮和多糖等聯合抗氧化作用進行研究。
本研究對金佛手酵素發酵過程有機酸組成及含量變化進行分析,結果表明,發酵90 d時金佛手酵素的總有機酸含量顯著提高,發酵階段有機酸組成豐富,發酵5~15 d之間以L-蘋果酸和檸檬酸為主,發酵40~90 d期間以乳酸、乙酸和L-酒石酸為主,此外還含有莽草酸、抗壞血酸、琥珀酸和草酸。各種有機酸含量變化趨勢不同,聚類分析將其歸為3類,而將發酵過程歸為2類,較好地反映出發酵過程中各類有機酸的差異性。研究表明,有機酸對食用植物酵素的抗氧化性能有重要作用,且有機酸有利于人體腸道上皮細胞的生長與發育、促進腸道健康[4]。張夢梅等[26]對市售酵素進行研究發現,發酵期酵素中廣泛存在酵母菌、乳酸菌和醋酸菌,主要有機酸為草酸、蘋果酸、乳酸和乙酸。食用植物酵素的傳統制備工藝主要采用自然發酵,自然發酵屬混菌發酵過程,酵素中乳酸等有機酸的生成可能主要來自于微生物的糖代謝,也有部分來自于多元醇的代謝。因此,有必要對金佛手酵素開展基于高通量測序技術的發酵過程微生物整體群落結構及演替規律研究,明確對有機酸變化起主導作用的核心微生物菌群,為金佛手酵素發酵階段的理性監測及調控方法提供理論基礎。

