產亞硝酸還原酶基因工程菌pET-28a(+)-nir-BL21的培養基優化
彭 鑫,黃燕燕,趙 珊,孫麗娜,陳思敏,肖弘毅,劉冬梅
(華南理工大學食品科學與工程學院,廣東廣州 510640)
亞硝酸鹽(Nitrite,NIT)主要存在于蔬菜[1]、加工肉制品[2-3]和生活飲用水中。高亞硝酸鹽攝入量易導致高鐵血紅蛋白癥,增加癌癥風險[4]。目前,降低亞硝酸鹽的方法有物理法、化學法、生物法,其中生物法因其高效、綠色而成為研究熱點。
大多數反硝化細菌中亞硝酸鹽還原酶(Nitrite reductase,NiR)表達量較低,而且經天然產物純化得到NiR的工序繁雜,不可避免地出現蛋白質損失和回收率低的問題。目前大多數研究者都無法直接從破碎天然菌體后的粗酶液中提取大量的天然NiR。Ichiki 等[5]從含有6710 mg總蛋白質的Haloarculamarismortui粗酶液中僅純化得到1.43 mg的NiR。Inatomi等[6]從含有1060 mg總蛋白質的Haloferaxdenitrificans粗酶液中僅純化得到0.08 mg NiR。
本課題組發現蠟樣芽胞桿菌LJ01[7]、植物乳桿菌DMDL 9010[8]及鼠李糖乳桿菌LCR 6013[9]能夠分泌NiR,降解培養基中高濃度的NaNO2,但是其NiR表達量低。利用大腸桿菌作為外源基因的表達系統,所需投入的成本較低,但目前難以克服的問題是目的蛋白的表達往往是以難溶性的包涵體形式存在于裂解液的沉淀中[10],因此對基因工程菌的發酵工藝進行優化是十分必要的,以便在提高菌體生物量的同時還可以獲得濃度較高的目的基因體外表達產物[11]。韓倩等[12]對Bacillussp. C產NiR的發酵工藝進行優化后,發現優化后目標蛋白NiR的酶活力較優化前提高了67.89%。梅旭旭等[13]優化基因工程菌表達海棲熱袍菌磷酸戊糖變位酶的發酵條件,以裂解液上清中的重組蛋白在SDS-PAGE上對應條帶的積分光密度來分析其可溶性表達水平,優化后磷酸戊糖變位酶表達量得到大幅度的提高。魏娜等[14]對基因改造運動發酵單胞菌的發酵工藝條件進行優化,確定最佳條件為溫度28 ℃、葡萄糖濃度為24%(w/V)、pH7.4,此時重組工程菌的乙醇產量比原始菌株乙醇產量提高16.4%。
為了降低投入的成本和提高目的蛋白的產量,不少學者選擇基因工程菌株作為研究對象,本文在前期研究中從豆瓣醬中篩選出一株具有強降解NIT能力的蠟樣芽孢桿菌BacilluscereusLJ01,獲得了B.cereusLJ01中編碼NiR(nir)的全長基因序列。將B.cereusLJ01中nir基因克隆至相應的表達載體上,構建了重組菌pET-28a(+)-nir-BL21,為提高基因工程菌pET-28a(+)-nir-BL21的產亞硝酸鹽還原酶(NiR)水平,從培養基成分出發,優化了異源表達NiR的培養基條件,為食品來源的蠟樣芽孢桿菌及其NiR用于食品中NIT的控制提供理論基礎支撐。
1 材料與方法
1.1 材料與儀器
蠟樣芽孢桿菌BacilluscereusLJ01 本課題組從豆瓣醬中篩選得到,已于2014年6月19日保藏于中國微生物菌種保藏管理委員會普通微生物中心,保藏號CGMCC NO.9360;原核載體質粒pET-28a(+)、克隆宿主E.coliDH5α、表達宿主E.coliBL21(DE3) 由本實驗室保存于-80 ℃冰箱中;LB培養基(生化試劑)、技術瓊脂粉、亞硝酸鈉、葡萄糖、甘油、酵母浸粉、大豆蛋白肽、細菌學蛋白胨、無水氯化鈣、磷酸二氫鉀、結晶硫酸鎂、氫氧化鈉、氯化鎂等 廣州卯林試劑有限公司。
Cyto FLEX流式細胞儀 貝克曼庫爾特公司;SW-CJ-2F潔凈工作臺 蘇州安泰空氣技術有限公司;Scientz-IID型超聲波細胞粉碎機 寧波新芝生物科技股份有限公司;5415R、5810R型離心機 德國Eppendorf;LRH-70型生化培養箱 上海一恒科技;QYC-200型恒溫搖床 上海福瑪實驗設備有限公司;YXQ-LS100SII型立式壓力蒸汽滅菌鍋 上海博訊實業有限公司。
1.2 實驗方法
1.2.1 重組菌株pET-28a(+)-nir-BL21的構建 以B.cereusLJ01全基因組DNA為模板進行NiR的PCR擴增(上游引物:5′-CGGCATATGCCAGCT AGCATGAGTTATGAAAAAGTATG-3′,下游引物:5′-CGGCTCGAGTGGCTCGAGCTAAGACGCTATTACTTC-3′,下劃線為保護性堿基,分別從其中引入NdeI和XhoI的酶切位點)。將PCR擴增產物用瓊脂糖凝膠電泳進行檢測后,進行純化和回收。將純化回收的PCR擴增產物和質粒pET-28a(+)進行NdeI和XhoI雙酶切,16 ℃連接3 h以上[15-16]。將連接產物轉化至E.coliDH5α,單菌落PCR驗證成功后送至廣州艾基生物技術有限公司進行測序。將測序成功的質粒pET-28a(+)-nir轉入到E.coliBL21(DE3)感受態細胞中,分別涂布在含有25 μg/mL Kan的固體LB培養基平板上進行篩選。
1.2.2 菌量的測定 向LB液體培養基中加入濃度為25 μg/mL卡那霉素溶液,按接種量10%(V/V)接種重組菌株pET-28a(+)-nir-BL21,在37 ℃、180 r/min下培養12 h后,用未接種的無菌液體LB培養基稀釋至OD600小于0.1后,用流式細胞儀測定稀釋液中活菌數濃度(CFU/μL),并計算原液中的活菌數濃度(CFU/mL)。空白組使用無菌的LB培養基進行校準,控制流式細胞儀對空白組的顆粒數進行記錄范圍在“0~10個/s”。
1.2.3 單因素實驗 以液體LB培養基為基礎培養基,添加不同濃度不同種類的碳源、氮源、無機鹽進行單因素實驗。
1.2.3.1 碳源的選擇 分別向基礎LB培養基中添加濃度為0、2、4、6、8、10、12、14、16 g·L-1的葡萄糖或添加濃度分別為0、2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0、22.5 g·L-1的甘油,加入25 μg/mL卡那霉素溶液,接種3%(V/V)2次活化后的重組菌株pET-28a(+)-nir-BL21,于37 ℃、180 r/min下振蕩培養12 h后,測定重組菌株pET-28a(+)-nir-BL21活菌數。
1.2.3.2 氮源的選擇 分別向基礎LB培養基中添加濃度為0、2.5、5.0、7.5、10.0、12.5、15.0 g·L-1的酵母浸粉,或添加濃度分別為0、5、10、15、20、25、30 g·L-1的細菌學蛋白胨,或添加濃度分別為0、2.5、5.0、7.5、10.0、12.5、15.0、17.5 g·L-1的大豆蛋白肽,加入25 μg/mL卡那霉素溶液,接種3%(V/V)2次活化后的重組菌株pET-28a(+)-nir-BL21,于37 ℃、180 r/min下振蕩培養12 h后,測定重組菌株pET-28a(+)-nir-BL21活菌數。
1.2.3.3 無機鹽的確定 分別向基礎LB培養基中添加濃度為0、1、2、3、4、5、6 g·L-1的磷酸二氫鉀,或添加濃度為0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 g·L-1的結晶硫酸鎂,或添加濃度為0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 g·L-1的氯化鈣,加入25 μg/mL卡那霉素溶液,接種3%(V/V)2次活化后的重組菌株pET-28a(+)-nir-BL21,于37 ℃、180 r/min下振蕩培養12 h后,測定重組菌株pET-28a(+)-nir-BL21活菌數。
1.2.4 Plackett-Burman試驗 在單因素實驗基礎上,運用Minitab 17軟件通過設計Plackett-Burman試驗設計法,對上述影響因素進行篩選。每個因素分別取低(-1)和高(+1)兩個水平(表1),共12個試驗組合。每個處理重復3次,取平均值即為試驗結果。

表1 Plackett-Burman試驗設計因素和水平Table 1 Factors and levels of Plackett-Burman design
1.2.5 Box-Behnken試驗 在Plackett-Burman試驗基礎上,得出葡萄糖、甘油、細菌學蛋白胨這三個因素對重組菌的生長影響最顯著。利用響應面分析法對重組菌株pET-28a(+)-nir-BL21培養基配方進行優化,利用Design-Expert 8.0.6軟件,用Box-Behnken模型(試驗設計見表2)建立三因素三水平數學模型[13],以活菌數為指標優化培養基成分。
表2 Box-Behnken試驗設計Table 2 Design of Box-Behnken experiment
1.3 數據處理
所有實驗均重復3次。Plackett-Burman試驗采用Minitab 17軟件進行設計,響應面試驗設計采用Design-Expert 8.0.6軟件設計。利用SPSS 19.0統計軟件進行統計學分析,數據間的分析采用單因素方差分析和Duncan多重比較法,顯著性水平均設定為P<0.05。
2 結果與分析
2.1 NiR的編碼基因擴增與測序結果
將B.cereusLJ01中nir序列上傳至NCBI中,獲得登錄號為MG839504,用瓊脂糖凝膠電泳檢測PCR擴增產物,從圖1可以看出PCR擴增產物條帶單一,大小約1600 bp,由此可判斷B.cereusLJ01中nir擴增成功。
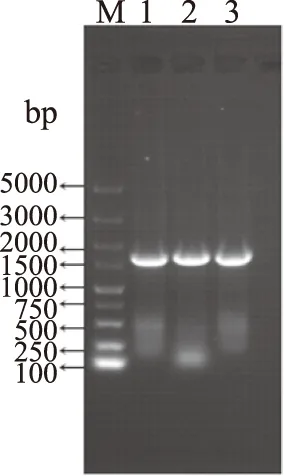
圖1 NiR編碼基因的PCR擴增產物的瓊脂糖凝膠電泳結果Fig.1 Gel electrophoresis of PCR-amplifiednir from B. cereus LJ01注:M:Marker;1、2、3:表示PCR擴增產物的3個平行。
2.2 培養基成分的單因素優化
2.2.1 碳源對重組菌生長的影響 如圖2所示,當在LB培養基中添加不同量的葡萄糖和甘油時,呈現出菌量先增后減的趨勢。圖2A可以看出,隨著葡萄糖的添加量由2 g·L-1提高到4 g·L-1,重組菌pET28a-nir-BL21活菌數達到最大值(2.85±0.0017)×108CFU·mL-1,繼續添加葡萄糖含量至6 g·L-1,重組菌pET-28a(+)-nir-BL21活菌數下降至(2.05±0.0028)×108CFU·mL-1,隨后變化趨于平穩。葡萄糖含量較低時,重組菌pET-28a(+)-nir-BL21活菌數隨著葡萄糖含量的提高而增多;當達到一定階段時,又隨著葡萄糖含量的提高而下降。葡萄糖的含量較高時可以抑制細菌的生長。這種現象可能是由于重組菌pET28a-nir-BL21具有反饋抑制體系,不同菌株存在不同單糖轉運與轉化系統有關[12]。圖2B可以看出,在甘油濃度為2.5 g·L-1時,菌量達到最大值2.22×108CFU·mL-1,黏稠狀的甘油可能對B.cereusLJ01生長具有一定的影響。兩種碳源對重組菌的促進作用差異不大,葡萄糖略好于甘油。故選用兩種碳源進行接下來的試驗,選取葡萄糖濃度為2~6 g·L-1,甘油濃度為0~5 g·L-1。
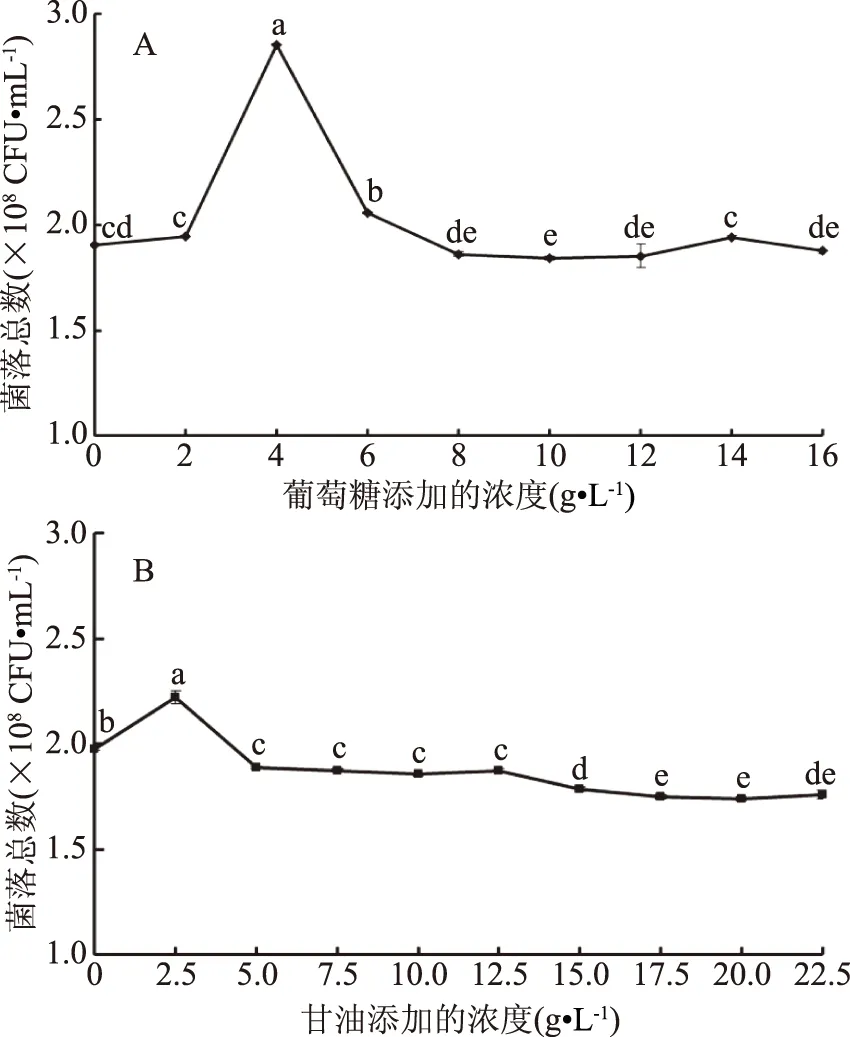
圖2 不同碳源濃度對重組菌pET-28a(+)-nir-BL21生長的影響Fig.2 Effect of different carbon sources concentrations on thegrowth of the recombinant bacteria pET-28a(+)-nir-BL21注:A:葡糖糖;B:甘油;不同小寫字母表示同一組數據之間具有顯著性差異;圖3~圖4同。
2.2.2 氮源對重組菌生長的影響 由圖3A可知,重組菌株pET-28a(+)-nir-BL21的活菌數隨著酵母浸粉加入量濃度的增大而增大,當酵母浸粉濃度達到12.5 g·L-1時,重組菌株pET-28a(+)-nir-BL21的活菌數達到最大值(4.15±0.028)×108CFU·mL-1。由圖3B可知,重組菌株pET-28a(+)-nir-BL21的活菌數呈現出先增長后減少的趨勢,說明過多的氮源會對產生底物抑制作用,不利于其生長。在細菌學蛋白胨濃度達到10 g·L-1時,菌量達到最大值(3.83±0.068)×108CFU·mL-1。由圖3C可知,一定濃度的大豆蛋白肽對重組菌的生長有著促進作用,當大豆多肽濃度達到2.5 g·L-1時,菌量有最大值(3.74±0.011)×108CFU·mL-1。這是因為大豆多肽是大豆蛋白經過蛋白酶水解制得的短肽類混合物,重組菌pET-28a(+)-nir-BL21可以直接利用小分子或氨基酸進行生長代謝,促進生長繁殖[17]。三種氮源對重組菌的生長促進生長作用顯著,故選取三種濃度分別為10~15 g·L-1的酵母浸粉,5~15 g·L-1的細菌學蛋白胨,0~5 g·L-1的大豆蛋白肽進行接下來實驗。
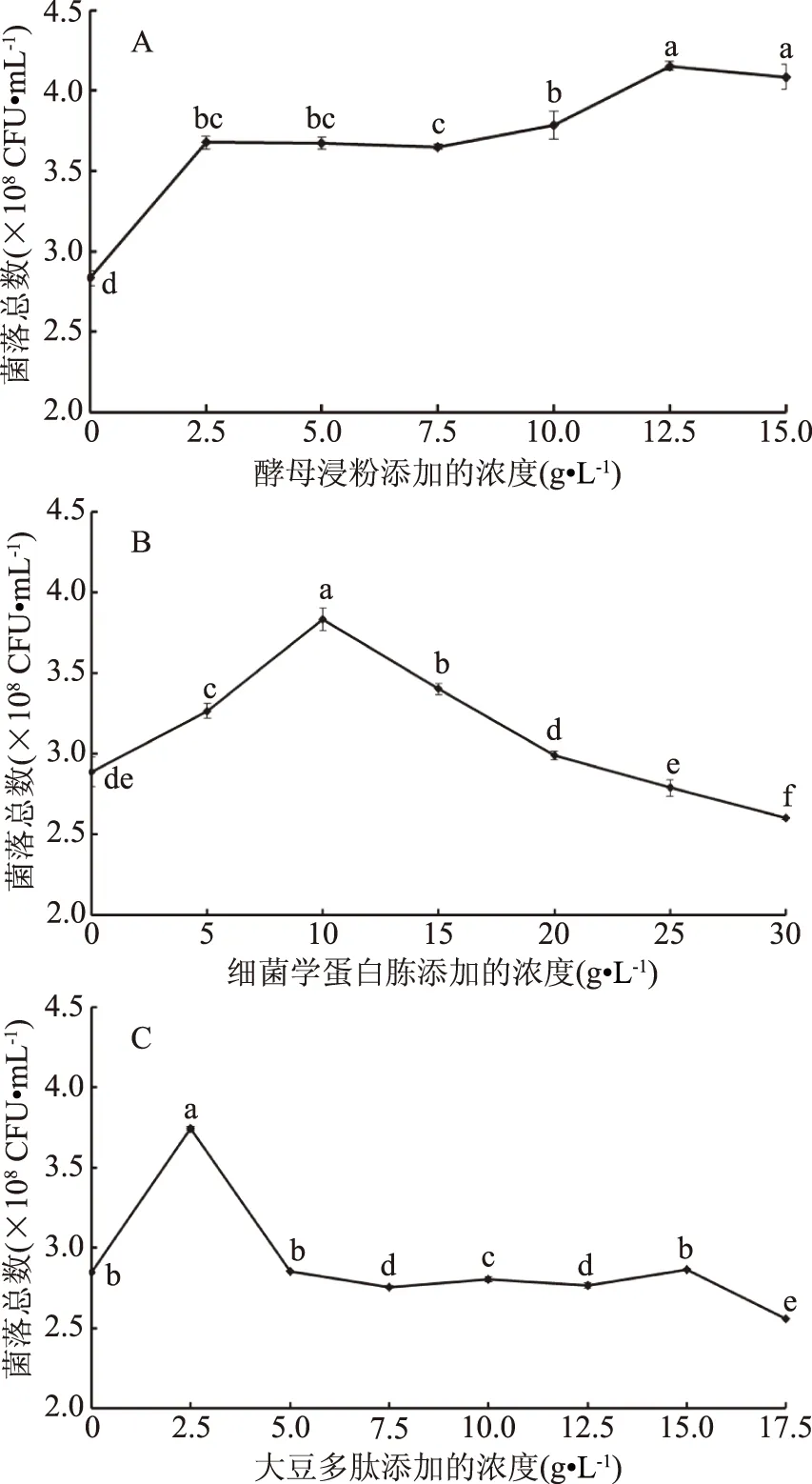
圖3 不同氮源濃度對重組菌pET-28a(+)-nir-BL21生長的影響Fig.3 Effect of different nitrogen sources concentrations on thegrowth of the recombinant bacteria pET-28a(+)-nir-BL21注:A:酵母浸粉;B:細菌學蛋白胨;C:大豆多肽。
2.2.3 無機鹽對重組菌生長的影響 無機鹽主要為生物體提供各種重要的生命元素,具有維持細胞穩定性、內環境pH穩定、調節細胞滲透壓和作為酶的激活劑等[12]。圖4A可以看出重組菌pET-28a(+)-nir-BL21的活菌數隨著KH2PO4濃度的增大而增大,當KH2PO4濃度為4~5 g·L-1達到最大值。這與張媛媛等[18]的結論一致。磷酸鹽中的磷是構成蛋白質和核酸不可缺少的元素,磷濃度對菌體的生長有很大影響。重組菌菌落總數隨著結晶硫酸鎂和CaCl2濃度的增加有先增加后減少的趨勢,當結晶硫酸鎂濃度為0.2 g·L-1,CaCl2濃度為0.2 g·L-1達到最高的菌落總數。這說明過量的Ca2+、Mg2+對重組菌株pET-28a(+)-nir-BL21的生長有抑制作用。整體來說,無機鹽對重組菌的促進作用較碳源和氮源來說并不顯著,故只選取其中影響程度較大的濃度為3~6 g·L-1KH2PO4進行接下來的實驗。
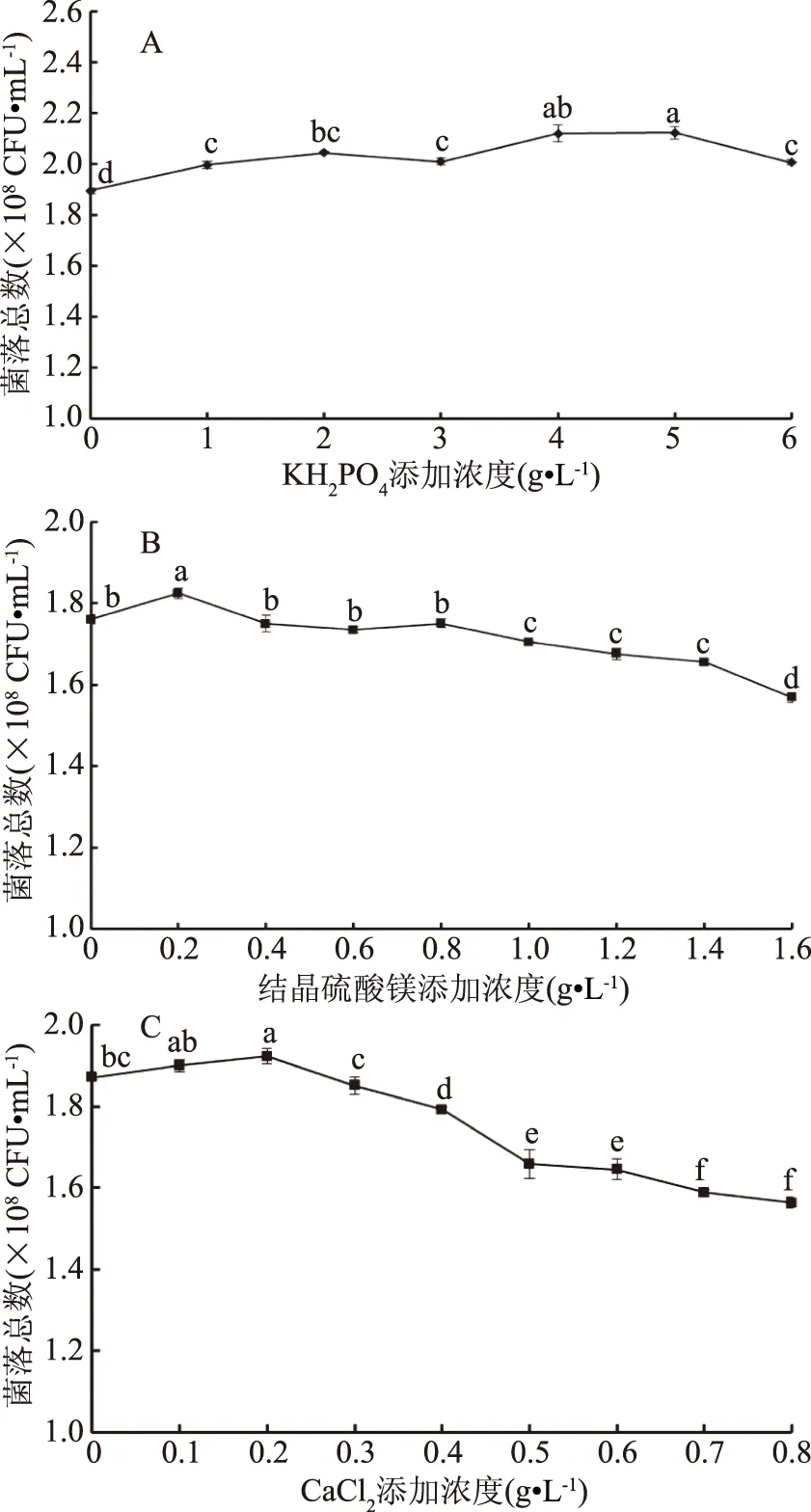
圖4 不同無機鹽濃度對重組菌pET-28a(+)-nir-BL21生長的影響Fig.4 Effect of different inorganic salts concentrations on thegrowth of the recombinant bacteria pET-28a(+)-nir-BL21注:A:KH2PO4;B:結晶硫酸鎂;C:CaCl2。
2.3 Plackett-Burman試驗結果
在前期單因素的基礎上,選取其中六個對重組菌生長具有顯著促進作用的因素,運用Minitab 17軟件設計Plackett-Burman試驗,以發酵液中菌落總數為響應目標。實驗設計及結果見表3,各因子效應及顯著性見表4。

表3 Plackett-Burman設計及結果Table 3 Design and results of Plackett-Burma experiments

表4 Plackett-Burman試驗因子顯著性分析Table 4 Significance analysis of terms in Plackett-Burma experiment
由表4可知,在促進重組菌pET28a-nir-BL21生長方面,葡萄糖、甘油、細菌學蛋白胨的貢獻度較高,分別為25.90%、11.66%和11.09%,其他幾個因素的貢獻值均不高于3%。結果表明,在這六種促進因子中,加入葡萄糖、甘油、細菌學蛋白胨,對重組菌pET28a-nir-BL21生長起促進作用,且葡萄糖、甘油、細菌學蛋白胨的貢獻值遠遠高于其他的因素,因此選擇葡萄糖、甘油、細菌學蛋白胨作為研究對象,進行Box-Behnken優化實驗。
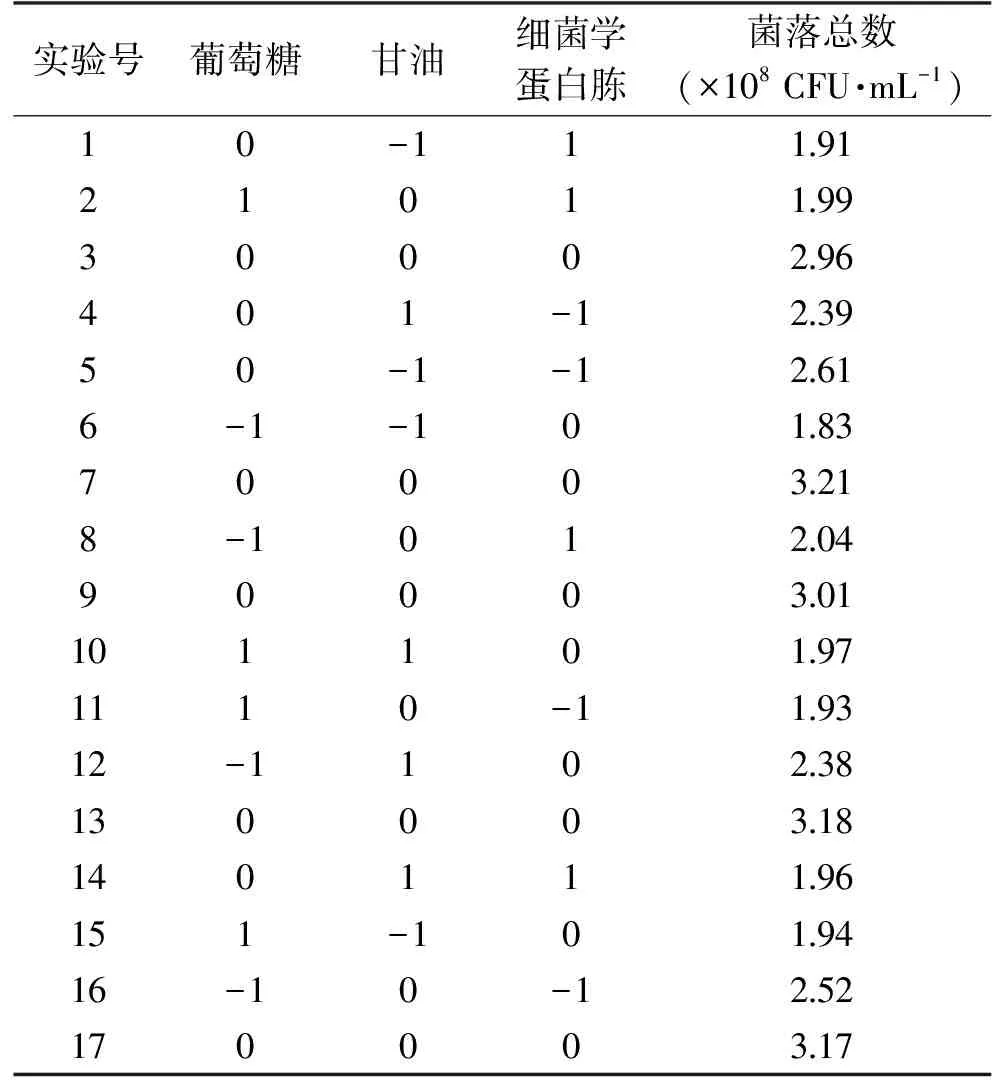
表4 對重組菌生長的響應面分析試驗設計及結果Table 4 Designs and results of response surface experimentson the growth of the recombinant bacteria
2.4 Box-Behnken試驗設計及響應面分析

2.5 響應面因子交互作用結果
將葡萄糖、甘油、細菌學蛋白胨添加量3個參數分別固定,通過Design Expert 8.0.6軟件繪制該模型的各影響因子兩兩交互作用的響應曲面及其等高線圖,如圖5~圖7所示。兩變量交互作用的大小可通過等高線的線間疏密程度和曲面形狀來判斷。曲面呈橢圓形、線間距密,則說明兩因子之間的交互作用對響應值影響顯著,反之,則不顯著。而響應曲面傾斜度大也說明兩因子之間的交互作用大。根據回歸方程的一次項系數及表5分析,各因素對重組菌的影響程度為細菌學蛋白胨>葡萄糖>甘油。根據回歸方程的二次項系數以及圖5~圖7所示,AC、AB交互項對響應值的影響較BC大,但三種因素間的兩兩交互作用對響應值的影響均不顯著,這與表5分析一致[20-21]。
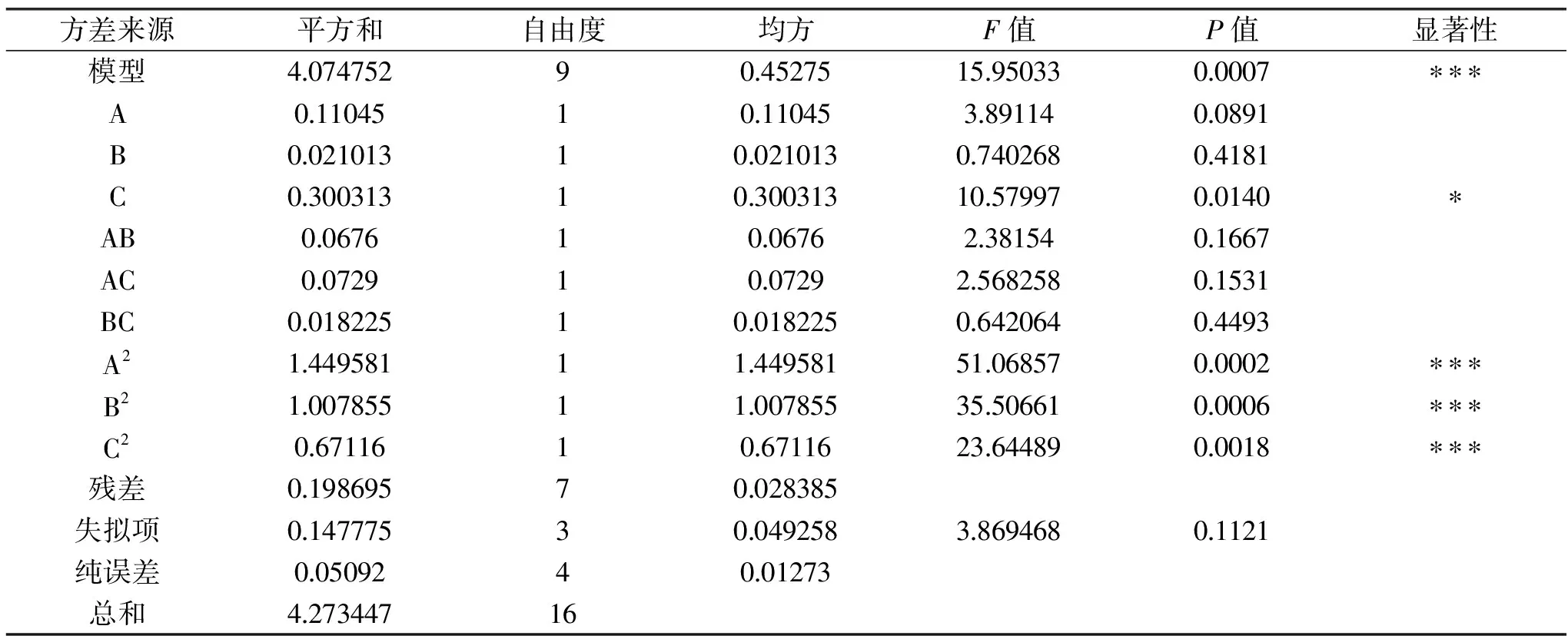
表5 回歸模型方差分析Table 5 Variance analysis of the regression model
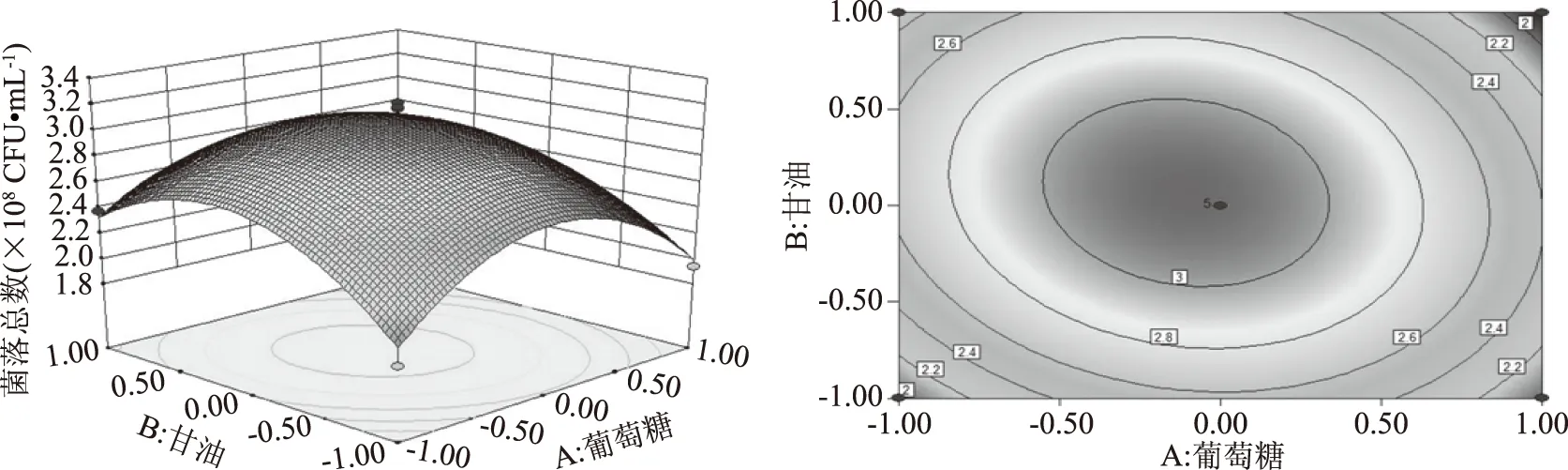
圖5 葡萄糖和甘油對重組菌pET28a-nir-BL21 活菌數的影響Fig.5 Effect of glucose and glycerin on the active bacteria number of the recombinant bacteria pET28a-nir-BL21
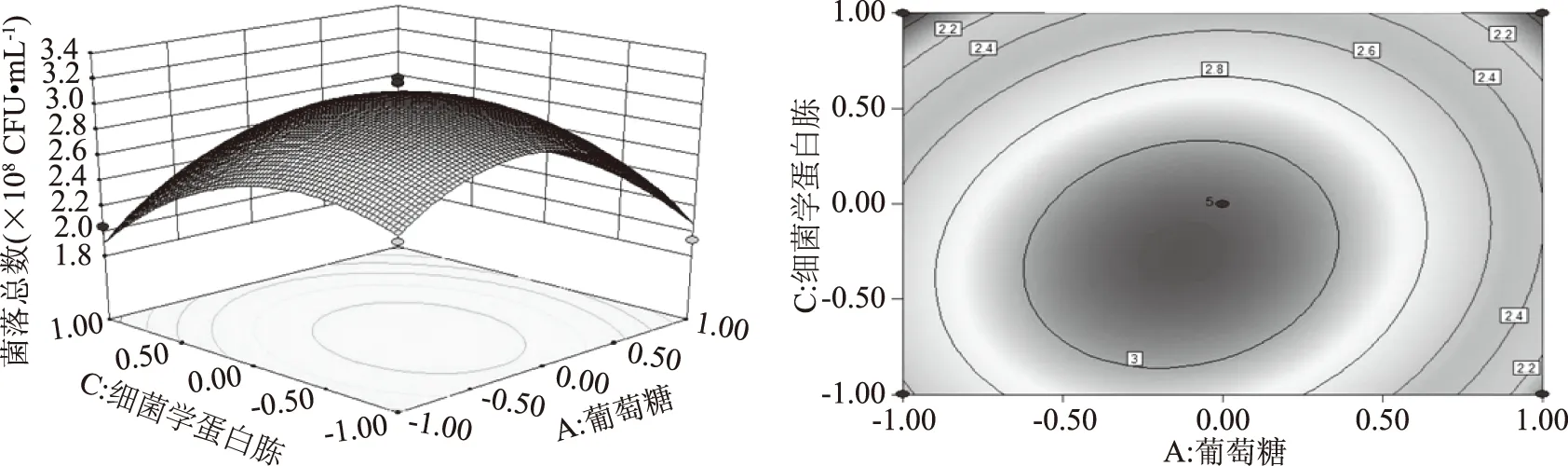
圖6 葡萄糖和細菌學蛋白胨對重組菌pET28a-nir-BL21活菌數的影響Fig.6 Effect of glucose and bacterial protein on the active bacteria number of the recombinant bacteria pET28a-nir-BL21
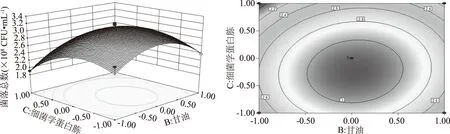
圖7 甘油和細菌學蛋白胨對重組菌pET28a-nir-BL21活菌數的影響Fig.7 Effect of glycerin and bacterial protein on the active bacteria number of the recombinant bacteria pET28a-nir-BL21
2.6 驗證試驗
根據響應面建立的數學模型,對回歸方程求一階偏導,得到對于重組菌菌量達到最大值的最佳培養條件為:以液體LB培養基為基礎,添加葡萄糖3.72 g·L-1,甘油2.63 g·L-1,細菌學蛋白胨8.70 g·L-1,在此條件下的預測的菌量能達到3.14×108CFU·mL-1。為進一步加以驗證預測結果,采用得到的培養基優化最佳配方進行三次平行實驗,計算得到重組菌的菌量為3.02×108CFU·mL-1,與預測值相差不大,擬合率達96.17%,說明通過Box-Behnken試驗設計建立的數學模型是準確可靠的。
3 結論
在基礎LB培養基成分上,通過單因素實驗、Plackett-Burman試驗和Box-Behnken Design(BBD)設計試驗,利用Design-Expert 8.0.6軟件進行數據分析,從培養基成分角度對重組菌pET-28a(+)-nir-BL21活菌數進行初步優化,取得了良好的效果,獲得了最佳培養基成分配方為:以LB 培養基為基礎培養基,添加葡萄糖 3.72 g·L-1、甘油2.63 g·L-1和細菌學蛋白胨 8.70 g·L-1。在此條件下,獲得的重組菌的活菌數為 3.02×108CFU·mL-1,此結果為工業化生產亞硝酸鹽還原酶提供了理論依據。

