高糖對(duì)H9C2心肌細(xì)胞系和乳大鼠心室肌細(xì)胞鈣庫(kù)操縱性鈣內(nèi)流及相關(guān)蛋白的影響
沙勒塔娜提·塔拉別克 孫志朋 王璐琪 油紅捷 羅大力
(首都醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院藥理系,北京 100069)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的以心肌結(jié)構(gòu)改變和功能減退為特征,獨(dú)立于冠狀動(dòng)脈粥樣硬化性心臟病、高血壓、瓣膜病變等原因的特異性心肌病[1]。比較公認(rèn)的是胰島素作用減弱(包括胰島素減少和胰島素抵抗)和慢性血糖升高是DCM發(fā)生發(fā)展的重要原因。能量代謝異常(包括胰島素、血糖、血脂代謝異常)、氧化應(yīng)激和線(xiàn)粒體損傷、腎素-血管緊張素-醛固酮系統(tǒng)的異常激活、交感神經(jīng)和鉀、鈉、鈣等通道電生理紊亂以及多種細(xì)胞因子的調(diào)節(jié)異常也是DCM發(fā)病的致病因素[2],但DCM的發(fā)病機(jī)制目前仍不明確,且治療手段匱乏。近年來(lái)研究[3-4]顯示鈣庫(kù)操縱性鈣內(nèi)流(store operated calcium entry,SOCE)可能參與了DCM心肌肥大發(fā)病過(guò)程,但高糖如何影響SOCE的具體機(jī)制不清。
Ca2+不僅參與肌纖維興奮-收縮耦聯(lián)過(guò)程,還是細(xì)胞內(nèi)重要的第二信使,參與調(diào)節(jié)多種細(xì)胞活動(dòng)。細(xì)胞外Ca2+內(nèi)流的主要通道包括電壓門(mén)控型鈣通道(voltage gated calcium channels,VGCC)、受體門(mén)控型鈣通道(receptor operated calcium channels,ROCC)和由鈣庫(kù)操縱的鈣通道SOCE[5-6]。其中SOCE是包括心肌細(xì)胞在內(nèi)的多種細(xì)胞Ca2+內(nèi)流的重要通道之一,主要由基質(zhì)相互作用分子1(stromal interaction molecule 1,STIM1)和鈣釋放激活鈣通道調(diào)節(jié)分子1(calcium release-activated calcium channel modulator 1,Orai1)組成。STIM1是一種定位在肌漿網(wǎng)(sarcoplasmic reticulum,SR)膜上的單次跨膜蛋白,它的作用為監(jiān)測(cè)SR腔中Ca2+濃度[7],Orai1則主要參與構(gòu)成細(xì)胞膜上的Ca2+通道[8]。當(dāng)SR腔中的Ca2+耗竭,STIM1蛋白會(huì)發(fā)生構(gòu)象變化并聚集到臨近細(xì)胞膜的位置與Orai1相互作用,激活SOCE,介導(dǎo)Ca2+內(nèi)流[9-11]。SOCE參與了多種心血管系統(tǒng)疾病的病理生理過(guò)程。然而,高糖環(huán)境是否影響心肌SOCE介導(dǎo)的Ca2+內(nèi)流并不清楚。因此,本實(shí)驗(yàn)旨在通過(guò)高糖刺激大鼠胚胎心肌細(xì)胞系(H9C2)和培養(yǎng)的乳大鼠心室肌細(xì)胞(neonatal rat ventricular myocytes,NRVMs),探究SOCE的變化以及可能的作用機(jī)制,為深入研究高血糖導(dǎo)致的心肌細(xì)胞鈣信號(hào)紊亂的分子機(jī)制和糖尿病心肌病的發(fā)病原因提供新的研究基礎(chǔ)。
1 材料與方法
1.1 材料
大鼠胚胎心肌細(xì)胞系H9C2購(gòu)自中國(guó)科學(xué)院上海生命科學(xué)研究院,胎牛血清購(gòu)自美國(guó)Gibco公司,DMEM和M199培養(yǎng)基購(gòu)自美國(guó)HyClone公司,葡萄糖購(gòu)自美國(guó)Gibco公司,青-鏈霉素混合液購(gòu)自北京索萊寶公司,毒胡蘿卜素(thapsigargin,TG)購(gòu)自美國(guó)Sigma公司,STIM1以及Orai1單克隆抗體購(gòu)自美國(guó)Santa公司,驢抗兔熒光二抗-FITC購(gòu)自美國(guó)Invitrogen公司,Calnexin以及GAPDH鼠單克隆抗體購(gòu)自美國(guó)Abcam公司,瓊脂糖G珠購(gòu)自美國(guó)Invitrogen公司,F(xiàn)luo-4 AM鈣離子熒光探針購(gòu)自日本Dojindo研究所,膠原酶Ⅱ購(gòu)自美國(guó)Worthington Biochemical公司,胰酶購(gòu)自北京索萊寶公司。
1.2 SD乳大鼠心室肌細(xì)胞的分離培養(yǎng)與純度鑒定
選擇出生48 h內(nèi)SD乳大鼠40只,用手術(shù)剪沿乳大鼠中部偏左剪開(kāi)胸骨,暴露出心臟,剪下心臟,小心去除心房及心臟周?chē)拇笱埽A粜氖也糠郑占?0 mL血清瓶中,將組織剪碎。加入5 mL HBSS消化液[含0.1%(質(zhì)量分?jǐn)?shù))胰蛋白酶和 0.03%Ⅱ型膠原酶],置恒溫磁力攪拌器上,37 ℃恒溫消化5 min。第一次消化結(jié)束后,用玻璃吸管吸出上清丟棄。再加入5 mL HBSS消化液,37 ℃恒溫消化5 min,消化結(jié)束后用玻璃吸管將細(xì)胞懸液吸入15 mL離心管中,并在離心管中加入含10%(體積分?jǐn)?shù))胎牛血清的DMEM終止消化。在血清瓶中再加入5 mL HBSS消化液,按上述步驟依次消化,共計(jì)10次。將15 mL離心管中的細(xì)胞懸液在1 000 r/min條件下離心5 min后棄去上清,加入3 mL含10%(體積分?jǐn)?shù))胎牛血清M199完全培養(yǎng)基重懸細(xì)胞,用200目篩網(wǎng)過(guò)濾細(xì)胞懸液至100 mm細(xì)胞培養(yǎng)皿中,置于37 ℃,5%(體積分?jǐn)?shù))CO2培養(yǎng)箱中靜置2 h,然后利用差速貼壁法去除優(yōu)先貼壁的成纖維細(xì)胞。重新收集細(xì)胞懸液,補(bǔ)充M199完全培養(yǎng)基,并將血清含量調(diào)整至15%(體積分?jǐn)?shù)),放置在培養(yǎng)箱中,37 ℃,5%(體積分?jǐn)?shù)) CO2條件下培養(yǎng)。 24 h 后更換培養(yǎng)基,去除未貼壁的細(xì)胞。繼續(xù)培養(yǎng)進(jìn)行后續(xù)實(shí)驗(yàn)。
NRVMs純度鑒定:取培養(yǎng)48 h的NRVMs心肌細(xì)胞,用橫紋肌肌動(dòng)蛋白(α-actin)單克隆抗體作為一抗進(jìn)行免疫細(xì)胞化學(xué)染色。隨機(jī)選取10個(gè)高倍(20×)視野計(jì)數(shù)陽(yáng)性細(xì)胞及細(xì)胞總數(shù),以陽(yáng)性細(xì)胞數(shù)/細(xì)胞總數(shù)×100%≥95%作為細(xì)胞純度合格指標(biāo)。通過(guò)以上方法分離的心室肌細(xì)胞純度均達(dá)95%以上,此外,在分離細(xì)胞培養(yǎng)至24 h 后可以觀(guān)察到NRVMs心肌細(xì)胞成片自主搏動(dòng)現(xiàn)象,表明本實(shí)驗(yàn)細(xì)胞所產(chǎn)生的反應(yīng)是來(lái)自心肌細(xì)胞。
1.3 鈣離子探針?lè)跤募〖?xì)胞
Fluo4-AM母液的配制:用4 μL二甲基亞砜(DMSO)溶解50μg的Fluo4-AM粉末配制成4 mmol/L的Fluo4-AM母液。-20 ℃避光密封保存。用無(wú)血清的DMEM培養(yǎng)基稀釋Fluo4-AM 母液,配制成4 μmol/L工作液。向共聚焦皿中加入 Fluo4-AM 工作液覆蓋細(xì)胞后37 ℃細(xì)胞培養(yǎng)箱孵育40 min。用有鈣(1.8 mmol/L)臺(tái)氏液(pH=7.35~7.4)輕輕浸洗細(xì)胞3次,以充分去除殘留的Fluo4-AM工作液,然后加入1 mL無(wú)鈣臺(tái)氏液覆蓋細(xì)胞備用。
將負(fù)載好熒光染料的心肌細(xì)胞放在激光共聚焦顯微鏡系統(tǒng)的載物臺(tái)上,設(shè)置參數(shù):激發(fā)波長(zhǎng)488 nm,接收波長(zhǎng)516 nm,40×物鏡,最快速度連續(xù)掃描,所有圖像在同一條件下(針孔大小、光電倍增管增益等)采集。調(diào)節(jié)焦平面位置選取合適的細(xì)胞層面,記錄細(xì)胞內(nèi)鈣離子初始熒光強(qiáng)度值(F0),待細(xì)胞穩(wěn)定后向共聚焦皿中輕輕加入2 μmol/L毒胡蘿卜素,連續(xù)記錄產(chǎn)生的Ca2+釋放熒光強(qiáng)度變化值(F)。待細(xì)胞鈣信號(hào)回到靜息狀態(tài)時(shí),輕輕滴加1.8 mmol/L CaCl2溶液,連續(xù)記錄瞬時(shí)Ca2+內(nèi)流熒光強(qiáng)度變化值(F)至細(xì)胞恢復(fù)靜息狀態(tài)。以上實(shí)驗(yàn)均在室溫條件下進(jìn)行,重復(fù)3次。實(shí)驗(yàn)數(shù)據(jù)分析:以每個(gè)細(xì)胞Ca2+離子熒光強(qiáng)度變化值與Ca2+離子初始熒光強(qiáng)度值的比值,即F/F0作為細(xì)胞Ca2+內(nèi)流或Ca2+釋放的熒光強(qiáng)度值進(jìn)行統(tǒng)計(jì)分析。
1.4 免疫共沉淀
在10 cm培養(yǎng)皿中接種2.4×107個(gè)心肌細(xì)胞,分為2組:對(duì)照組(5.5 mmol/L葡萄糖),高糖組(25 mmol/L葡萄糖),每組共3個(gè)皿。將培養(yǎng)皿置于37 ℃,5% (體積分?jǐn)?shù))CO2的培養(yǎng)箱孵育48 h后收集各組細(xì)胞,加入適量NP-40細(xì)胞裂解液,4 ℃ 搖床緩慢搖晃1 h后離心(12 000 g,15 min)取上清液。加入20 μL Protein G瓊脂糖珠,4 ℃ 搖床緩慢搖晃預(yù)吸附2 h后離心去除珠子,再根據(jù)蛋白濃度加入適量STIM1抗體過(guò)夜。次日取20 μL Protein G瓊脂糖珠加入到細(xì)胞裂解液中,4 ℃ 搖床緩慢搖晃孵育4 h,使抗體與Protein G瓊脂糖珠充分偶聯(lián)。免疫沉淀反應(yīng)后,離心(200 r/min,3 min) 棄上清,用細(xì)胞裂解液輕輕清洗瓊脂糖珠,再離心(200 r/min,3 min),保留瓊脂糖珠沉淀,重復(fù)3次。最后向瓊脂糖珠加入25 μL的1×SDS上樣緩沖液,95 ℃ 5 min,進(jìn)行后續(xù)SDS-PAGE電泳及Western blotting蛋白檢測(cè)。實(shí)驗(yàn)重復(fù)3次。
1.5 化學(xué)交聯(lián)
在6 cm培養(yǎng)皿中接種9×106個(gè)心肌細(xì)胞,分為2組:對(duì)照組(5.5 mmol/L葡萄糖),高糖組(25 mmol/L葡萄糖),每組共3個(gè)皿。將培養(yǎng)皿置于37 ℃,5%(體積分?jǐn)?shù)) CO2的培養(yǎng)箱孵育48 h后用無(wú)鈣臺(tái)氏液輕輕清洗兩遍,然后加入2 μmol/L 毒胡蘿卜素刺激細(xì)胞5 min,再加入1%(質(zhì)量分?jǐn)?shù))多聚甲醛室溫固定蛋白質(zhì)間相互作用6~8 min,最后加入0.1 mol/L甘氨酸冰浴5 min終止甲醛反應(yīng)。收集細(xì)胞加入適量裂解液,超速離心(38 000 g,90 min,4℃)后去除上清,加入適量裂解液溶解蛋白沉淀進(jìn)行BCA測(cè)定濃度。進(jìn)行后續(xù)SDS-PAGE電泳及Western blotting蛋白檢測(cè)。與普通Western blotting實(shí)驗(yàn)不同,該蛋白樣品不經(jīng)過(guò)煮沸處理。實(shí)驗(yàn)重復(fù)3次。
1.6 細(xì)胞免疫熒光
取細(xì)胞培養(yǎng)12孔板,在每個(gè)孔板內(nèi)放置玻璃爬片,在每個(gè)爬片上接種5×105心肌細(xì)胞,分為2組:對(duì)照組(5.5 mmol/L葡萄糖),高糖組(25 mmol/L葡萄糖),將孔板置于37 ℃,5% (體積分?jǐn)?shù))CO2的培養(yǎng)箱孵育48 h。吸去培養(yǎng)基,臺(tái)氏液輕輕浸洗細(xì)胞3次,每次5 min。向孔內(nèi)加入2 μmol/L 毒胡蘿卜素刺激細(xì)胞5 min,然后迅速用4%(質(zhì)量分?jǐn)?shù))多聚甲醛進(jìn)行細(xì)胞固定,室溫20 min。吸去多聚甲醛,臺(tái)氏液浸洗細(xì)胞3次。向孔內(nèi)加入0.1% (體積分?jǐn)?shù))Triton X-100,室溫破膜30 min,使細(xì)胞通透。除去Triton X-100,臺(tái)氏液浸洗3次,每次5 min。用5%(質(zhì)量分?jǐn)?shù))BSA封閉30 min。封閉后無(wú)須清洗,向每孔滴加STIM1抗體[1∶50,5%(質(zhì)量分?jǐn)?shù))BSA稀釋],4 ℃濕盒內(nèi)孵育過(guò)夜12 h。次日,吸去一抗,臺(tái)氏液浸洗細(xì)胞3次,每次5 min。向孔內(nèi)滴加驢抗兔熒光二抗-FITC(綠)[1∶500,5% (質(zhì)量分?jǐn)?shù))BSA稀釋],室溫避光孵育1 h。吸去二抗,臺(tái)氏液浸洗細(xì)胞3次,每次5 min。向玻片上滴加DAPI復(fù)染細(xì)胞核,避光室溫孵育10 min。臺(tái)氏液浸洗細(xì)胞,用鑷子輕輕取出爬片,用抗熒光淬滅劑封片,將爬片反過(guò)來(lái)貼于載玻片上,然后在熒光顯微鏡下觀(guān)察并采集圖像。為了分析STIM1 puncta結(jié)構(gòu)的變化,首先按照相同的成像數(shù)據(jù)采集各組熒光圖像,然后通過(guò)Image J軟件對(duì)puncta面積進(jìn)行計(jì)算。其中將面積>0.5 μm2的顆粒物定義為puncta,每組隨機(jī)選取30~40個(gè)細(xì)胞作為統(tǒng)計(jì)樣本,實(shí)驗(yàn)重復(fù)3次。
1.7 統(tǒng)計(jì)學(xué)方法
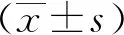
2 結(jié)果
2.1 高糖對(duì)H9C2和NRVMs心肌細(xì)胞SOCE功能的影響
與對(duì)照組相比,高糖組H9C2(圖1A)以及NRVMs (圖1B)心肌細(xì)胞的鈣庫(kù)排空能力差異均無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),但加入CaCl2溶液1.8 mmol/L后,高糖組H9C2產(chǎn)生的Ca2+內(nèi)流強(qiáng)度高于對(duì)照組(P<0.05,圖1A), 高糖組NRVMs產(chǎn)生的Ca2+內(nèi)流強(qiáng)度也增高(P<0.01,圖1B)。不同組別各選取30~40個(gè)狀態(tài)良好的心肌細(xì)胞進(jìn)行Ca2+信號(hào)實(shí)時(shí)記錄并統(tǒng)計(jì),以n=30~40細(xì)胞表示,每個(gè)組別實(shí)驗(yàn)均重復(fù)3次。

圖1 激光共聚焦顯微鏡檢測(cè)高糖對(duì)H9C2和NRVMs心肌細(xì)胞SOCE的影響
2.2 高糖對(duì)H9C2和NRVMs心肌細(xì)胞中SOCE相關(guān)蛋白表達(dá)的影響
與對(duì)照組相比,高糖培養(yǎng)的H9C2(圖2A)和NRVMs(圖2B)心肌細(xì)胞STIM1蛋白表達(dá)均明顯增加 (P<0.01),且在H9C2全細(xì)胞蛋白中Orai1的表達(dá)量也升高(P<0.05)。提示高糖上調(diào)H9C2和NRVMs心肌細(xì)胞SOCE相關(guān)蛋白(STIM1和Orai1)表達(dá),各組實(shí)驗(yàn)均重復(fù)3次。

圖2 Western blotting檢測(cè)高糖對(duì)H9C2和NRVMs心肌細(xì)胞STIM1和Orai1蛋白表達(dá)的影響
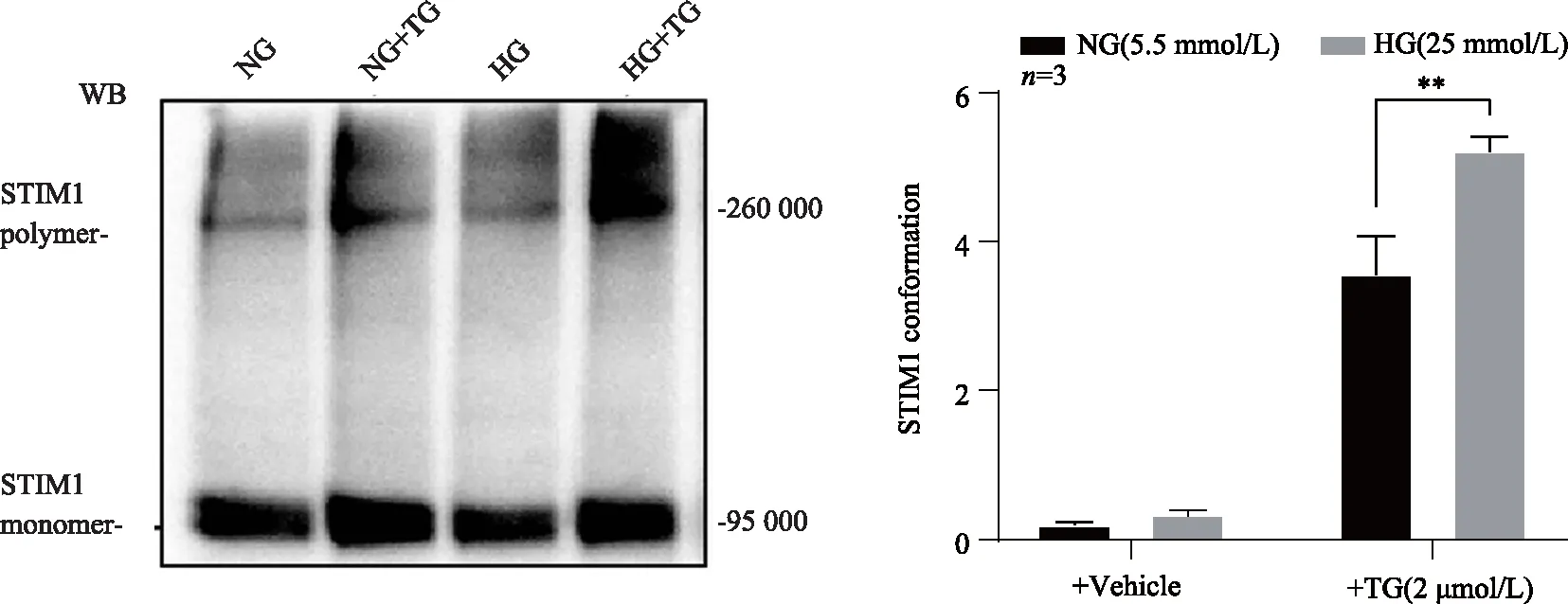
圖3 化學(xué)交聯(lián)法檢測(cè)高糖對(duì)NRVMs 心肌細(xì)胞STIM1蛋白聚集體形成的影響
2.3 高糖對(duì)NRVMs心肌細(xì)胞STIM1蛋白聚集化的影響
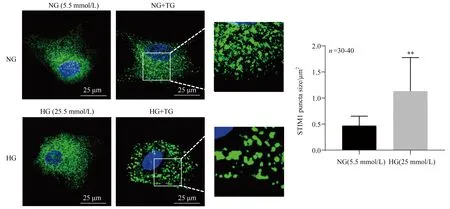
圖4 免疫熒光染色觀(guān)察高糖對(duì)NRVMs細(xì)胞STIM1蛋白聚集體形成的影響
在沒(méi)有經(jīng)TG刺激時(shí),兩組心肌細(xì)胞SR蛋白抽提物中STIM1聚集體(STIM1 polymers)無(wú)明顯差異;接下來(lái),經(jīng)TG刺激排空鈣庫(kù)后,與對(duì)照組相比,高糖組STIM1蛋白高分子量聚集體(約260 000以上)顯著增多(圖3),差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。為了進(jìn)一步驗(yàn)證上述蛋白交聯(lián)結(jié)果,對(duì)兩組NRVMs心肌細(xì)胞STIM1蛋白進(jìn)行免疫熒光檢測(cè)。結(jié)果顯示,在靜息狀態(tài)下,對(duì)照組和高糖組細(xì)胞STIM1蛋白熒光染色差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);但經(jīng)TG刺激排空鈣庫(kù)后,高糖組細(xì)胞STIM1形成的斑點(diǎn)狀蛋白聚集體結(jié)構(gòu)(puncta)與對(duì)照組明顯不同(圖4)。結(jié)果顯示,與對(duì)照組相比,高糖組細(xì)胞STIM1 puncta的單個(gè)面積顯著增大,差異有統(tǒng)計(jì)學(xué)意義(P<0.01),且可見(jiàn)形成的puncta遠(yuǎn)離核周,朝胞膜方向位移。提示鈣庫(kù)排空后高糖過(guò)度促進(jìn)STIM1蛋白激活形成聚集體。
圖5 免疫共沉淀法檢測(cè)正常糖和高糖條件下NRVMs中內(nèi)源性STIM1與Orai1蛋白的相互作用
2.4 高糖對(duì)NRVMs心肌細(xì)胞中STIM1與Orai1相互作用的影響
與STIM1免疫共沉淀的蛋白復(fù)合物中可檢測(cè)到Orai1單體(約34 000)和聚集體(約160 000),說(shuō)明經(jīng)藥物刺激后心肌細(xì)胞內(nèi)STIM1與Orai1蛋白確實(shí)存在相互作用,但對(duì)照組與高糖組間這兩種蛋白相互作用情況并無(wú)明顯差異(圖5)。提示高糖異常激活SOCE的機(jī)制可能不是通過(guò)促進(jìn)STIM1和Orai1直接相互作用。
3 討論
STIM1和Orai1是構(gòu)成 SOCE的重要蛋白分子。STIM家族由兩種蛋白亞型組成:STIM1和STIM2,在研究[12]顯示STIM1是定位于SR膜上的單次跨膜蛋白,具有監(jiān)測(cè)SR腔內(nèi)Ca2+濃度的傳感作用。其N(xiāo)H2末端位于SR腔內(nèi),包括典型的EF-hand結(jié)構(gòu)域 (canonical EF-hand domain,cEF)、非Ca2+結(jié)合EF-hand結(jié)構(gòu)域 (non-Ca2+binding hidden EF-hand domain,hEF) 和α卷曲模體結(jié)構(gòu)域(sterile alpha motif domain,SAM)[13-14]。雖然Ca2+只與cEF結(jié)構(gòu)域結(jié)合,但是hEF-hand-SAM結(jié)構(gòu)域的穩(wěn)定性對(duì)Ca2+傳感作用非常重要。在靜息狀態(tài)下,Ca2+與STIM1的cEF-hand結(jié)合,STIM1通過(guò)螺旋結(jié)構(gòu)域間的相互作用形成二聚體[15]。當(dāng)SR Ca2+存儲(chǔ)減少時(shí),Ca2+從STIM1的cEF結(jié)構(gòu)域脫離,導(dǎo)致hEF-hand-SAM復(fù)合物中的疏水殘基暴露,啟動(dòng)STIM1聚集反應(yīng)[16]。然而與STIM1相比,STIM2具有明顯不同的NH2末端區(qū)域[17],STIM2在SOCE調(diào)節(jié)中的作用目前尚不清楚。Orai家族成員包含三個(gè)高度保守的同系物:Orai1,Orai2和 Orai3,其中Orai1是位于細(xì)胞膜上包含四個(gè)跨膜結(jié)構(gòu)域的通道蛋白[18],是最重要的SOCE效應(yīng)蛋白。已知Orai1在靜息條件下以均二聚體或四聚體形式存在[19]。激活后,形成六聚體[20]并介導(dǎo)鈣釋放激活的鈣離子通道(calciumrelease-activated calcium,CRAC)開(kāi)放。當(dāng)SR充盈時(shí),STIM1與Ca2+結(jié)合并散在分布于SR膜上。一旦SR內(nèi)Ca2+排空,STIM1發(fā)生構(gòu)象變化,迅速寡聚化并遷移到與質(zhì)膜緊密靠近的區(qū)域形成斑點(diǎn)狀puncta結(jié)構(gòu)。STIM1的重新定位觸發(fā)Orai1向SR-PM接觸位點(diǎn)的募集,最終通過(guò)STIM1與Orai1相互作用,激活SOCE,介導(dǎo)Ca2+內(nèi)流[21-26]。
研究[27-30]表明,SOCE功能障礙與心肌疾病的發(fā)生發(fā)展有密切聯(lián)系。與非興奮細(xì)胞一樣,乳大鼠心室肌細(xì)胞能夠?qū){網(wǎng)Ca2+儲(chǔ)備的耗竭做出反應(yīng),通過(guò)不同于VGCC的通道引起細(xì)胞外Ca2+內(nèi)流,這種途徑已被證明是SOCE[31]。Voelkers等[32]也證實(shí)了乳大鼠心肌細(xì)胞中有STIM1和Orai1蛋白表達(dá)以及SOCE介導(dǎo)的Ca2+內(nèi)流參與心肌細(xì)胞病變過(guò)程;Ohba等[33]發(fā)現(xiàn)敲除STIM1能夠抑制NRVMs中SOCE效應(yīng)。上述研究表明,心肌細(xì)胞存在SOCE途徑及其效應(yīng)蛋白STIM1和Orai1可以調(diào)控這種Ca2+內(nèi)流通道。在此基礎(chǔ)上,已有研究[34]顯示高糖可以引起心肌細(xì)胞損傷,其機(jī)制可能是高糖增加細(xì)胞內(nèi)Ca2+濃度,引起Ca2+超載。有研究[35]表明,體外高糖環(huán)境可抑制H9C2心肌細(xì)胞增生,上調(diào)STIM1、Orai1及瞬時(shí)受體電位陽(yáng)離子通道蛋白(transient receptor potential cation channel,TRPC1)的表達(dá),提示高糖誘導(dǎo)的H9C2心肌損傷中有SOCE的參與;相反地,Pang等[36]在5.5 mmol/L葡萄糖條件下培養(yǎng)NRVMs,加入TG后胞質(zhì)Ca2+濃度立即升高,而在30 mmol/L 高糖中培養(yǎng)20 h后NRVMs對(duì)TG刺激的反應(yīng)減弱,表明高糖降低了NRVMs由血管緊張素II(angiotensin II,Ang II)或TG誘導(dǎo)的SOCE。此外,Correll等[37]發(fā)現(xiàn),STIM1過(guò)表達(dá)的心肌細(xì)胞SOCE增強(qiáng),且小鼠早在6周齡就表現(xiàn)出心臟性猝死,而存活超過(guò)12周的小鼠則出現(xiàn)心力衰竭伴肥大,胎兒基因程序啟動(dòng),組織病理學(xué)和線(xiàn)粒體結(jié)構(gòu)改變,心室功能喪失和肺水腫。與此同時(shí),近期有項(xiàng)研究[38]表明,主動(dòng)脈弓縮窄術(shù)(transverse aortic constriction,TAC)誘導(dǎo)的小鼠表現(xiàn)出心肌細(xì)胞肥大,SOCE過(guò)度激活,但在突變Orai1的R91W16位點(diǎn)后,SOCE趨于正常。以上研究結(jié)果說(shuō)明,SOCE功能障礙以及STIM1、Orai1表達(dá)改變均可能誘發(fā)心肌細(xì)胞鈣信號(hào)紊亂,然而在高糖條件下心肌細(xì)胞SOCE的變化比較矛盾,其機(jī)制也尚不清楚。
心肌細(xì)胞功能障礙既是心肌病變的始動(dòng)原因,也是促進(jìn)疾病發(fā)展的重要因素,而且高血糖以心肌細(xì)胞為靶點(diǎn),損害心臟的機(jī)械性能[39]。因此,保護(hù)心肌細(xì)胞對(duì)維護(hù)心臟健康有重要意義。糖尿病患者合并心血管疾病的發(fā)病率較非糖尿病者明顯增高,為正常者的約2.5倍,其致病機(jī)制與離子通道密切相關(guān)[40]。近年的研究[41]證實(shí),糖尿病患者在慢性發(fā)展過(guò)程中心肌細(xì)胞內(nèi)靜息Ca2+升高,心臟收縮舒張功能受損,其中涉及的Ca2+超載機(jī)制復(fù)雜。筆者以高糖對(duì)心肌細(xì)胞Ca2+內(nèi)流的影響作為出發(fā)點(diǎn),從細(xì)胞功能變化到分子層面的內(nèi)在機(jī)制進(jìn)行探究。TG是一種肌漿網(wǎng)鈣泵(Ca2+-ATPase)的抑制劑,可促進(jìn)細(xì)胞內(nèi)鈣庫(kù)排空及誘導(dǎo)SOCE。在本研究中,對(duì)照組H9C2心肌細(xì)胞和NRVMs與高糖組兩種細(xì)胞的鈣庫(kù)排空能力(Ca2+release)均差異無(wú)統(tǒng)計(jì)學(xué)意義,說(shuō)明高糖可能沒(méi)有改變肌漿網(wǎng)內(nèi)Ca2+含量。但高糖組兩種心肌細(xì)胞由SOCE介導(dǎo)的Ca2+內(nèi)流強(qiáng)度均顯著高于對(duì)照組。另外,根據(jù)Western blotting結(jié)果可知,在H9C2心肌細(xì)胞及NRVMs中構(gòu)成SOCE的兩種主要蛋白STIM1及Orai1均有表達(dá),這與之前的研究[32-33]一致,且用高糖培養(yǎng)以上兩種心肌細(xì)胞48 h后,STIM1及Orai1的表達(dá)明顯上調(diào)。已知鈣庫(kù)排空能夠誘發(fā)肌漿網(wǎng)膜上STIM1蛋白變構(gòu)激活發(fā)生聚集反應(yīng),形成斑點(diǎn)狀蛋白聚體體結(jié)構(gòu)(puncta)[42-43],在本實(shí)驗(yàn)中發(fā)現(xiàn)高糖可以促進(jìn)STIM1蛋白的這種激活反應(yīng),形成更豐富的聚集體,而這種現(xiàn)象有助于激活質(zhì)膜上的Orai1鈣離子通道,過(guò)度開(kāi)放SOCE,這與筆者在檢測(cè)Ca2+信號(hào)時(shí)看到的高糖增強(qiáng)Ca2+內(nèi)流的結(jié)果相一致。為了進(jìn)一步驗(yàn)證高糖對(duì)心肌細(xì)胞SOCE的影響,筆者用免疫共沉淀實(shí)驗(yàn)對(duì)NRVMs心肌細(xì)胞內(nèi)源性STIM1及Orai1的相互作用進(jìn)行檢測(cè),發(fā)現(xiàn)對(duì)照組與高糖組STIM1免疫沉淀的Orai1單體及類(lèi)聚集體并無(wú)明顯差異。根據(jù)以上實(shí)驗(yàn)結(jié)果,筆者猜測(cè):等同的時(shí)間與空間里,在充足外Ca2+環(huán)境下,高糖組心肌細(xì)胞SOCE介導(dǎo)的Ca2+內(nèi)流顯著增多,是由于高糖誘導(dǎo)STIM1和Orai1蛋白表達(dá)上調(diào),使單位時(shí)間內(nèi)SOCE啟動(dòng)所需的開(kāi)放通道增多,而不是通過(guò)增強(qiáng)STIM1與Orai1之間的相互作用,然而這一猜想有待后續(xù)研究。
糖尿病是世界范圍內(nèi)最常見(jiàn)的慢性病之一。這文重點(diǎn)關(guān)注的是糖尿病患者中一種特殊的心臟合并癥——糖尿病性心肌病變。本文首先探究了高糖對(duì)心肌細(xì)胞SOCE功能的影響。接下來(lái),重點(diǎn)放在高糖如何改變心肌細(xì)胞的SOCE,并發(fā)現(xiàn)是通過(guò)上調(diào)組成SOCE的蛋白表達(dá),同時(shí)促進(jìn)STIM1蛋白變構(gòu)聚集,從而誘導(dǎo)SOCE異常激活,增加Ca2+內(nèi)流,這可能是糖尿病導(dǎo)致的心肌細(xì)胞鈣信號(hào)紊亂的機(jī)制之一,為SOCE參與糖尿病心肌疾病的發(fā)病機(jī)制提供了新的依據(jù)。

