甲烷水合物6分子14面體(4668)籠型結構
蘇金昌
蘇金昌1
(大慶水合物研究中心,黑龍江 大慶 163453)
水分子簇;甲烷水合物;可燃冰;氫能;氫氣水合物;水分子;氫鍵
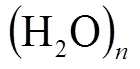
1 H2O分子的結構
一般認為,在O原子參與分子組成時,與基態(tài)O原子(1s22s22p4)最外層6個電子密切相關,所以將2s22p4稱作O原子價電子組態(tài),其中的6個電子稱作價電子,6個價電子中未參與成鍵的電子(非鍵電子)被視為處于價層能量最高的非鍵軌道里.按照這樣的觀點,CO,NO分子結構中O原子的端基各有1對非鍵電子(孤對電子),而H2O分子的O原子價層有2對非鍵電子.這樣一來,CO,NO分子結構中O原子將作為質子的受體,與H2O分子中作為質子給體的H原子能形成分子間氫鍵(O—H┄O),理論上CO,NO都應該是易溶解于水的氣體.但是,實驗事實是CO,NO都是難溶解于水的氣體,說明對CO,NO分子結構的認識可能與實際情況不符.再從軌道能角度看,O原子基態(tài)2s與2p軌道能量分別為-32.4,-15.6 eV,相差1倍多,不可能發(fā)生2s與2p軌道的雜化(不符合能量相近的軌道才能雜化的觀點),O原子2s軌道內的電子不但很難參與成鍵,一般也不會成為價層內能量最高的電子.這樣從實驗事實和軌道能兩方面表明,將O原子2s軌道電子視為價電子有失合理性,不能根據(jù)O原子有6個價電子描述有關含氧分子的結構.
雜化軌道理論認為,在多原子分子里,中心原子能量相近的軌道發(fā)生軌道雜化能提高成鍵能力,有利于形成相對穩(wěn)定的分子.為此,在分析H2O分子的價鍵結構時,基于軌道能相差1倍的2s與2p軌道之間發(fā)生sp3雜化有失合理性,考慮O原子2p與3s軌道雜化成為必然的選擇.按照H2O分子里的O原子發(fā)生p3s不等性雜化(2p43s0→(p3s)2(p3s)1(p3s)1(p3s)0),O原子用2個各占有1個電子的雜化軌道分別與2個H原子占有1個電子的1s軌道重疊,形成2個O—H鍵,而O原子另外2個雜化軌道沒有參與成鍵,即水分子中氧原子的價層里有1個占有2個電子的非鍵軌道和1個非鍵空軌道(見圖1).這樣的結構特點,使H2O分子既能作為電子的接受體,又能作為電子的給予體.長期以來,人們一直機械地套用C原子2s與2p軌道的雜化方式,認為H2O分子里的O原子價層有2對非鍵電子,而忽視了O原子基態(tài)2s與2p軌道能相差1倍的事實.

圖1 H2O的三維結構(O發(fā)生p3s雜化)
對于2個原子的分子,其軌道重疊成鍵沒有空間阻礙,一般無需考慮軌道雜化的需要.當把O2分子里的O原子看成價層只有4個電子時,2個O原子直接用各自的3個2P軌道彼此重疊,就能分析出其分子結構里有1個2電子的鍵和2個3電子的π23鍵,而沒有能量最高的非鍵電子對.這樣的結構說明其不是質子的受體,不能與水分子形成氫鍵,與氧氣不易溶于水的事實吻合.其中,3電子π23鍵的存在與其有順磁性吻合.同樣,對于CO,NO,O原子3個2P軌道(4個價電子)與C原子3個2P軌道(2個電子)、N原子3個2P軌道(3個電子)重疊時,CO分子里有1個2電子的鍵和2個2電子的π22鍵、沒有孤對電子,NO分子里有1個2電子的鍵和1個2電子的π22鍵、1個3電子π23鍵、沒有孤對電子,不是質子的受體,它們都不能與H2O分子形成氫鍵,與它們很難溶于水的事實是吻合的.
有關O4分子結構的認識一直存在爭論,無論是四邊形還是四面體結構[4],用已有理論都難做出合理的解釋.認為在一定的條件下,通過誘發(fā)O原子發(fā)生p2s等性雜化(2p43s0→(p1(ps)1(ps)1(ps)1),則能形成三角形構型的O4分子.在這樣的O4分子里,位于三角形中心的O原子與位于頂點的3個O原子形成3個O—O鍵、1個∏44鍵.很明顯,這樣的結構有較好的穩(wěn)定性,特定條件下可以人工合成穩(wěn)定的O4分子.有了這種高密度的氧就能為航天火箭提供更高效的助推劑.所以,合成穩(wěn)定的O4分子有非常重要的意義.
由此可見,O原子價層里有4個電子的觀點,將影響到對有關含O原子的分子結構的認識,也將影響到對有關物質性質的解釋和合成方法的選擇.這個觀點的理論意義在未來的相關研究和應用中或許能表現(xiàn)出來.
氫橋鍵[5]觀點認為,1個分子的X原子的X—H鍵的1對電子能與另1個分子X原子的空軌道共用,形成3原子、2電子(3c-2e)的X—H—X氫橋鍵.按照這樣的觀點,由于H2O分子新結構中氧原子有空軌道,水的H2O分子之間也能形成3c-2e的O—H—O氫橋鍵.但是,文獻[6]在介紹氫的新鍵型和非常規(guī)氫鍵都沒有提到2個O原子作橋頭的3c-2e的O—H—O氫橋鍵.這其中的原因或許是受到了O原子按照sp3不等性雜化給出H2O分子的價鍵結構有2對非鍵電子的傳統(tǒng)認知所束縛,使O—H—O氫橋鍵一直沒有被發(fā)現(xiàn).
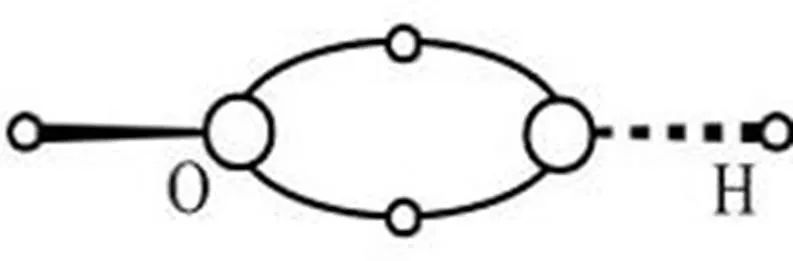
圖2 的氫橋鍵結構(O發(fā)生p3s雜化)
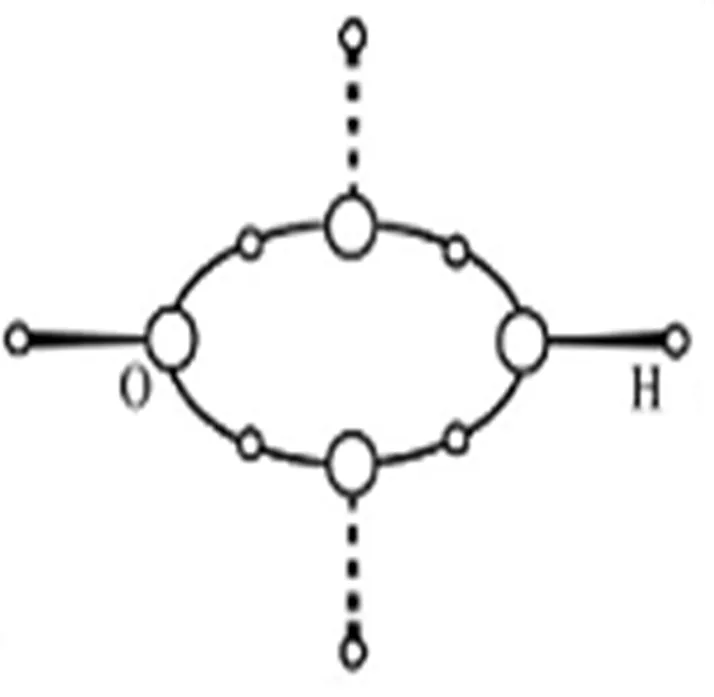
圖3 的氫橋鍵結構(O發(fā)生p3s雜化)
按照氫鍵理論,1個H2O分子周圍最多能被4個H2O分子包圍而形成5H2O分子的水分子團,而江穎[8]團隊的研究拍攝到了4個H2O分子的聚集態(tài).對于這種4個H2O分子的聚集態(tài),用氫橋環(huán)結構觀點解釋更合理.
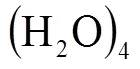
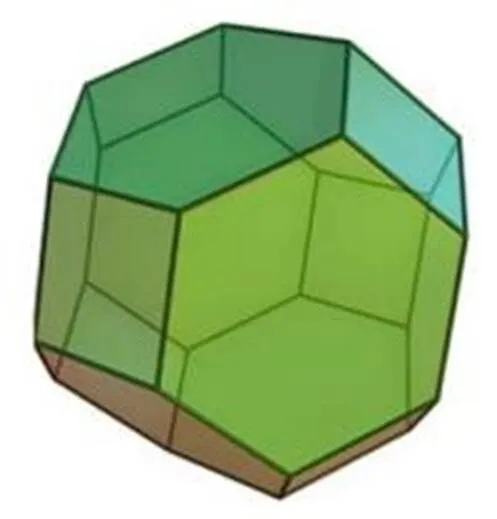
圖4 6分子14面體(4668)籠型結構
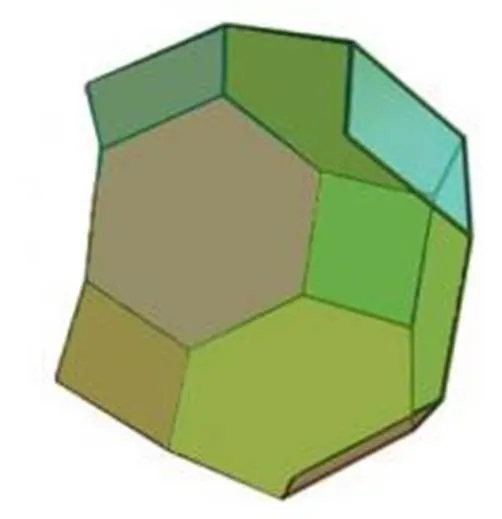
圖5 5分子10面體(4564121)籠型結構
4 結語
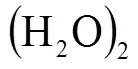
[1] 樊栓獅,趙勇.天然氣水合物研究現(xiàn)狀與發(fā)展趨勢[J].中國科學院院刊,2001(2):106
[2] 張建平,趙林,王林雙.水分子簇中氫鍵的作用[J].化學通報,2005(68):137-142
[3] P Sylwia,D Jozef,M Leszek.Formation of Water Dimers in Exp andingAir Flows[J].Vacuum,2003,70:403
[4] 張秀杰,吳禮清,張宗.氧分子O4的結構性能的密度泛函數(shù)理論研究[J].計算機與應用化學,2011(4):481-486
[5] 陳光亞,胡滿成,魏朔.無機化學(下冊)[M].北京:北京師范大學出版社,2011
[6] 周公度.氫的新鍵型[J].大學化學,1999(14):8-17
[7] 北京大學.無機化學[M].4版.北京:高等教育出版社,2003
[8] 江穎.我國科學家拍攝到水分子內部結構[EB/OL].北京:科學網(wǎng)(2014-01-14)[2019-06-12].http://news.sciencenet.cn/htmlnews/2014/1/287617.shtm
[9] 胡春.甲烷水合物生成動力學研究[D].杭州:浙江工業(yè)大學,2000
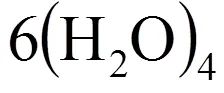
SU Jinchang
(Daqing Hydrate Research Center,Daqing 163453,China)
water cluster;methane clathrate;flammable ice;hydrogen energy;hydrogen hydrate;water molecule;hydrogen bon
O611.2
A
10.3969/j.issn.1007-9831.2020.04.015
1007-9831(2020)04-0069-05
2019-12-07
蘇金昌(1962-),男,黑龍江哈爾濱人,研究員,從事氣體水合物研究.E-mail:273638023@qq.com

