藥物源性腎損傷生物標志物
錢星凱 潘秋莎 楊凌


摘要 生物標志物是評判臟器的損傷和狀態尤為重要的指標,其建立是生理和功能改變后所衍生出的化學或物理改變。藥物性腎損傷是臨床中常見的,通常腎損傷隱秘性強,在早期不容易發現,因此腎損傷標志物對于評價腎臟結構和功能的意義是至關重要的。本綜述擬對腎臟結構以及藥物對腎損傷進行分類,總結現有評價腎損傷的標志物,以期對藥物在腎損傷評價中標志物的使用作出評價依據。
關鍵詞 生物標志物;臟器損傷;損傷類型;腎臟;藥物;毒性種類;種屬;中藥
Drug-induced Kidney Injury Biomarkers
QIAN Xingkai,PAN Qiusha,YANG Ling
(Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Abstract Biomarkers are particularly important indicators for judging the damage and state of organs.Their establishment is a chemical or physical change derived from physiological and functional changes.Drug-induced renal injury is common in clinics.Kidney injury is usually very secretive and not easy to find in the early stage.Therefore,renal injury markers are essential for evaluating the significance of kidney structure and function.This paper intends to classify the structure of kidney and function of the drugs,and summarize the existing markers for evaluating kidney damage,in order to make an evaluation basis for the use of drugs in the evaluation of kidney damage.
Keywords Biomarkers; Organ damage; Type of damage; Kidneys; Drugs; Toxicity classification; Species; Chinese medicine
中圖分類號:R285文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2020.23.003
生物標志物通常是指生物體狀態或狀況的可測量指示劑。生物標志物一般有2類不同的特征:1)器官、組織或細胞的專屬性,它也指某體系或部分會將獨特的化學物質(包括DNA)釋放到環境中,以證明它們存在于特定位置;2)關鍵功能的特征性,后者往往與內外源性的代謝有關,是內源性代謝或外源性的關鍵作用步驟,常常因該關鍵反應的限速性導致代謝障礙、引發損傷、炎性反應、衰竭等。通過測量和評估標志物的變化,以檢查正常的生物過程,致病過程,或對治療干預的藥理學反應[1]。
作為檢測人體臟器損傷的標志物應該具備以下條件:1)標志物的來源具有專一性,可追溯至臟器、組織甚至細胞來源,并最好有亞細胞器精確定位;2)標志物在臟器中的表達應達到一定的豐度,并相對于其他組織或臟器有特異性的高豐度,可專屬性地作為檢測某一臟器、組織或細胞標志;3)除了以上條件外,檢測方法的靈敏性、便捷性以及抗干擾性與穩定性也應納入考慮范圍。生物標志物對于藥物的合理發展至關重要,但是在基礎研究、臨床實踐與應用中,其基本定義和概念仍然存在重大混淆。并且大多數臨床標志物已經不適合于現代醫療的精細化檢測及診斷。因此,清晰不同生物標志物的定義并更好地理解其適當應用,對于今后的研究和臨床實踐中更有利[2]。
1 腎臟結構功能
藥物進入體內后在靶點位置發揮效應,然后再腎臟中匯集經尿液排出,在腎臟中常常容易發生急性腎損傷(AKI)。著眼于腎臟排泄,腎小球濾過和腎小管分泌這2個主要途徑(或這2種途徑的某種組合)介導了藥物清除。因此,腎小管細胞(和周圍的間質)通過游離面接觸和細胞攝取或從基底外側循環通過細胞的運輸而暴露于潛在的腎毒性藥物中,隨后其游離面外排進入尿液。隨著藥物從近端管狀內腔移入亨利回路和遠端管狀內腔,可能會引起腎小管間質損傷。由于管狀腔內藥物晶體的沉淀和含有藥物的阻塞性鑄型的形成,腎單位遠端可能發生損傷。藥物相關的炎性損傷引起的腎小管間質損傷是多種藥物誘發AKI的另一種機制[3-4]。
腎臟是藥物毒性產生重要的器官之一,其原因如下:1)腎臟接受靜息心輸出量的20%~25%,這使其比其他器官系統接觸更多的循環藥物;2)腎小管濃縮濾液,從而暴露于較高濃度的藥物;3)轉運蛋白可進一步增加細胞內藥物的濃度,并且4)小管具有較高的能量需求,這使其容易受到腎毒性損傷[3]。對于靜脈給藥的藥物,腎臟可以稱為是這些藥物毒性的第一大屏障。藥物引起的近端腎小管損傷可能是由導致細胞凋亡,壞死和其他細胞死亡方式的各種機制(線粒體損傷,氧化損傷,DNA損傷)引起的。臨床上,近端腎小管病變表現為低血鉀,低磷血癥或完全性Fanconi綜合征,而孤立的AKI常常并發高血鉀和高磷血癥。合并的AKI和近端腎小管病變可表現為低,正常或升高的血清電解質。Fanconi綜合征和部分近端腎小管病變通常是可逆的,恢復通常需要幾個月的時間,但在極少數情況下可以永久存在。腎小管損傷引起的腎小球濾過率下降的機制尚不清楚,但可能是由于傳入的小動脈血管收縮(腎小球反饋),濾液的腎小管回漏以及凋亡/壞死細胞和蛋白質引起的腎小管阻塞所致。某些患者(但并非所有患者)的腎功能得以恢復。這可能是由于炎性反應引起的重塑不正常,伴有腎小管萎縮和間質纖維化[5]。
2 主要藥物分類
藥物進入腎臟后引起的毒性主要分為以下幾類[6-7]:1)經藥物轉運的近端管狀損傷;2)近端腎小管損傷經基底外側藥物運輸;3)結晶誘導管損傷;4)藥物引起的腎病;5)藥物致急性小管間質性腎炎。下表列舉了引起腎損傷的藥物分類。見表1。
2.1 經藥物轉運的近端管狀損傷 藥物或代謝物經腎小球過濾后,進入近端管狀腔空間會使管狀細胞的游離面暴露于各種腎毒素。藥物如氨基糖苷,各種復合糖和淀粉以及多種重金屬進入腎小管細胞。對于陽離子氨基糖苷,它們的正電荷將這些藥物吸引到帶負電荷的頂膜,這是由于帶負電荷的膜磷脂[8]。然后,這些藥物與內吞受體復合物巨蛋白Cubicin結合,并在其中轉移到溶酶體區室。這種游離面吸收途徑導致細胞內一定濃度的氨基糖苷積累,從而觸發級聯損傷,導致細胞損傷和死亡,臨床表現為近端腎小管病變或AKI[9]。損傷主要是由于溶酶體積累和形成髓鞘小體,髓鞘小體是由于氨基糖苷抑制溶酶體酶而形成的膜碎片和受損的細胞器[10]。與巨蛋白Cubicin復合物的內吞攝取相反,過濾后的復合糖(例如葡聚糖和蔗糖)以及淀粉(例如羥乙基淀粉)被近端腎小管細胞吞噬。與氨基糖苷類似,在胞飲作用后,這些物質被溶酶體吸收并收集在它們中。溶酶體和細胞質的積累部分是由于缺乏能夠代謝這些物質的細胞酶引起的。最終,羥乙基淀粉的這種積累會引起急性小管細胞損傷和AKI,導致所謂的滲透性腎病。從組織學上講,病變的特征是存在腫脹的,空泡的細胞,這些細胞損害并閉塞了近端的管狀腔[11]。
2.2 近端腎小管損傷經基底外側藥物運輸 與通過游離面攝取(內吞和胞飲作用)過濾進入近端小管細胞的藥物不同,一些藥物通過基底外側循環運輸進入尿液[12]。潛在的腎毒性藥物由管周毛細血管輸送,然后通過活性轉運蛋白家族被近端腎小管細胞攝取,這是腎臟排泄的第一步。基底外側轉運體的種類很多,包括2種重要的藥物轉運體:用于負電荷藥物的人體有機陰離子轉運體(OAT)和用于正電荷藥物的人體有機陽離子轉運體(OCT)。然而,藥物不僅通過這些轉運體運輸,內源性產生的陰離子和陽離子物質通過這些途徑競爭轉運[13]。替諾福韋(Tenofovir Dysproxil Fumarate)是一種已知的腎毒素,是一種無環核苷酸膦酸鹽,通過OAT-1轉運。替諾福韋一旦進入管狀細胞細胞質,就會通過各種調控的載體蛋白通過細胞內空間,最終與游離面外排轉運蛋(多藥耐藥蛋白、p-糖蛋白)結合進入尿路空間。替諾福韋是一種線粒體毒素,其濃度升高會增強線粒體功能障礙,最終導致急性小管細胞凋亡和壞死[12]。類似的,順鉑通過OCT-2進入細胞質,在排泄前通過載體蛋白在細胞內穿梭進入外排轉運體[14]。與替諾福韋一樣,細胞外轉運減少或細胞進入增多可導致近端管損傷和AKI。細胞內順鉑的增
加與活性硫醇化合物和單羥基復合物的形成有關,這些化合物對近端管狀細胞具有強毒性。中毒性腎小管損傷是通過氧化應激、活性氮、誘導促凋亡和炎性反應途徑介導的。活性氧(ROS)直接影響蛋白質的合成和結構、DNA的合成和細胞修復機制,而TNF-α、轉化生長因子-β和單核細胞趨化蛋白-1的增加也對細胞具有毒性。事實上,TNF-α通過誘導腎細胞凋亡、ROS和多種細胞因子的產生,在誘導順鉑介導的細胞損傷中發揮核心作用[15]。對于這2種藥物,當其他危險因素隨之而來時,這些藥物的廣泛販運會增加腎管暴露和潛在腎毒性藥物濃度升高的風險。
2.3 結晶誘導管損傷 腎臟排泄的各種藥物及其代謝產物不溶于尿液,引起結晶性腎病。藥物包括甲氨蝶呤,茚地那韋,阿昔洛韋,阿扎那韋,磺胺嘧啶,環丙沙星,氨苯蝶啶和口服磷酸鈉。尿流率降低,藥物劑量過多和快速輸注速率增加了管狀腔內藥物/代謝物的不溶性[16]。例如,真正有效的容量消耗會促進腎臟灌注不足和腎前生理,在不溶性藥物尿流速度緩慢的情況下,通過促進藥物過量和增強遠端管狀腔內藥物/代謝產物晶體的沉淀來增強腎毒性。此外,根據藥物pKa改變尿液pH值的代謝紊亂也會增加某些藥物引起的腎小管內晶體沉積的風險。尿液的pH值低于5.5會增加藥物(如磺胺嘧啶,甲氨蝶呤和氨苯蝶啶)的腎小管內晶體沉積,而尿液的pH值高于6.0會增加諸如茚地那韋,阿扎那韋和環丙沙星等藥物引起的管腔內晶體沉淀[17]。由于遠端腎小管腔內的晶體沉淀,腎小管血流受阻,周圍的間質性炎性反應發展,導致腎臟損傷。本節將重點研究甲氨蝶呤作為藥物性結晶性腎病的原因。當以大劑量(>1 g/kg)給藥時,甲氨蝶呤是一種有效的抗癌藥。AKI的總發生率約為2%,范圍為0%~12%,這取決于所研究的人群和所采用的AKI定義。如上所述,AKI的產生是由于母體藥物及其代謝產物在管狀腔腔中的沉淀。發生這種情況的2個主要危險因素是真實的或有效的體積消耗以及酸性尿液的存在。除腎小管內晶體沉積外,甲氨蝶呤已顯示可誘導氧自由基的形成,繼而引起細胞損傷,并伴隨腺苷脫氨酶活性降低[18],這也可能導致腎臟損傷。當發生AKI時,尿液顯微鏡檢查通常會顯示出腎小管上皮細胞和粒狀鑄型。在酸性尿液中可以看到藥物晶體(單獨的和結晶的),但在堿性pH值下不太可能觀察到。甲氨蝶呤水平過高和系統性終末器官毒性常伴隨嚴重的AKI。
2.4 藥物引起的腎病 萬古霉素是一種廣泛應用于多種感染的糖肽類抗生素。50多年前,萬古霉素被認為是一種腎毒素,因為早期的制劑由于雜質是棕色的。然而,在20世紀70年代,隨著純度的提高,新的萬古霉素劑型的發展,萬古霉素作為許多微生物的有效制劑的使用量大大增加,其中包括耐甲氧西林葡萄球菌。目前,雖然萬古霉素耐受性良好,但與AKI發生率增加有關,估計發生率為5%~20%[19]。萬古霉素主要由腎臟排出,并被認為通過腎小球濾過和活躍的腎小管分泌進入尿道。萬古霉素相關腎毒性的機制尚不清楚,但存在多種可能的腎毒性途徑。這種抗生素的劑量依賴性腎毒性包括誘導氧化應激,補體激活炎性反應損傷和線粒體損傷。這些損傷途徑主要導致急性腎小管損傷/壞死。急性腎小管間質性腎炎(ATIN)是萬古霉素誘導AKI的另一機制[20]。最近報道的萬古霉素相關腎損傷的一種新的、獨特的機制是一種藥物誘導的梗阻性腎小管鑄型。研究了在萬古霉素治療背景下因AKI接受腎活檢的患者。采用免疫組織學染色技術檢測萬古霉素在腎組織中的含量;阻塞管狀鑄型的非晶體,納米球形萬古霉素聚集物與尿調素糾纏被發現。這些鑄型讓人想起骨髓瘤輕鏈鑄型,因為它們周圍有單核細胞和細胞反應。患者血漿中高萬古霉素谷水平,部分伴有腎毒素暴露。類似的萬古霉素鑄型在小鼠實驗中復制。因此,納米圈萬古霉素聚集物與尿調素相互作用形成阻塞型鑄型,可能是暴露于過量萬古霉素水平下的急性腎小管損傷的另一種形式[21]。
2.5 藥物致急性小管間質性腎炎 藥物誘導的急性腎小管間質腎病(ATIN)被認為主要是T細胞介導的4型遲發性超敏反應,盡管免疫復合物沉積(反管基底膜抗體)和未處理藥物與T細胞直接相互作用導致T細胞活化也可能在藥物超敏中發揮作用[22]。腎臟對藥物過敏特別敏感,部分原因是腎臟高血流量和局部藥物代謝導致ATIN的產生。藥物誘導的ATIN的發病機制一般分為4個階段。抗原識別階段開始于腎臟內的藥物,通過充當原半抗原或半抗原,破壞腎臟蛋白并將其轉化為新抗原,或通過分子模擬,使腎臟組織呈現抗原。在抗原腎組織形成后,常駐的樹突狀細胞、腎小管上皮和間質巨噬細胞隨后作為抗原提呈細胞發揮作用。藥物誘導的抑制素會導致腎臟免疫調節階段的紊亂,免疫檢查點抑制劑等藥物會降低腎臟的免疫耐受。最后,藥物誘導的ATIN的效應期以淋巴細胞、巨噬細胞、嗜酸性粒細胞、肥大細胞等細胞浸潤腎臟為特征,引起小管間質炎性反應和損傷[22]。
3 損傷標志物
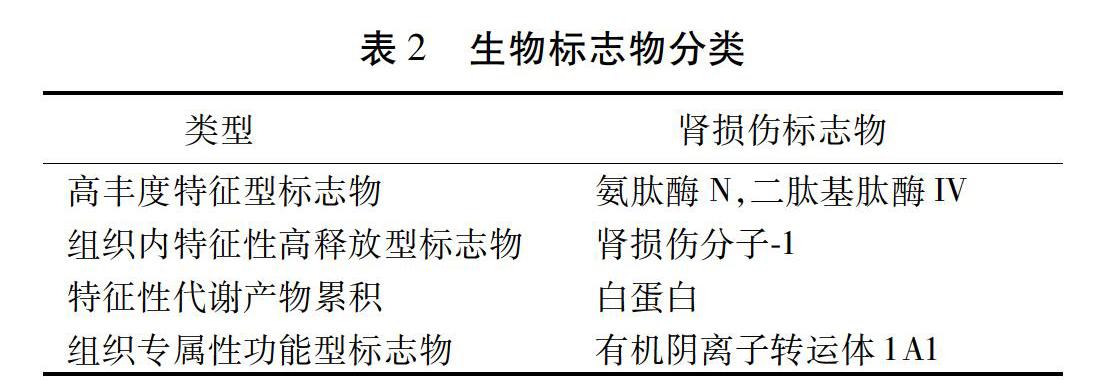
按照損傷類型,不同的臟器損傷后其標志物的類型可以分為4種類型。見表2。4個分類分別是:1)器官、組織或細胞內其分子組成相對高豐度特征型標志物,膜蛋白尤其常見;2)器官、組織或細胞破壞后,向血清內特征性高釋放型標志物;3)器官、組織或細胞功能下降后,特征性代謝產物累積;4)器官、組織或細胞專屬性代謝催化特征的功能型標志物[23-24]。
3.1 傳統腎損傷標志物 腎臟中標志物血液尿素氮(BUN)和血清肌酐是腎功能的不完善標志,因為它們受許多獨立于腎功能的腎臟和非腎臟因素的影響。腎臟響應損傷而直接釋放到血液或尿液中的生物標志物可能比BUN和血清肌酐是藥物誘導的腎臟毒性的更好的早期標志物。美國食品和藥物管理局(FDA)和歐洲藥品管理局(European Medicines Agency)已接受尿白蛋白和尿蛋白,以及尿標記物腎損傷分子1(KIM-1),β2-微球蛋白(B2M),胱抑素C(CysC),簇蛋白和三葉因子3(TFF-3)作為高度敏感和特定的尿液生物標志物,已在臨床前研究和臨床試驗中監測藥物誘導的腎臟損傷。將來,功能性和損傷性標志物的組合使用可能會促進藥物腎毒性的生物標志物領域。在臨床研究中,較早發現具有腎臟特異性生物標記物的藥物誘發的腎毒性可能會避免使用腎毒性藥物,并且可能允許較早的干預來修復受損的腎臟[25]。
CysC是一種由所有有核細胞合成并被腎小球自由過濾的小分子半胱氨酸蛋白酶抑制劑。過濾后,它不會被小管分泌或再吸收,而是會完全分解代謝,因此在血液中測量時會反映出真正的GFR。臨床前,盡管缺乏一致的劑量反應關系,CysC似乎是動物早期近端腎小管損傷的最敏感標志物。CysC適合于總體上評估腎臟功能,而與特定病變部位無關,因為該標志物缺乏腎小球間隙清除,生產變異性和適用于BUN和血清肌酐的敏感性有限。有人提出,血液中的CysC可能是合適的翻譯生物標記,因為它避免了動物費力的尿液收集。CysC的可能缺點是它僅依賴于腎功能下降以外的其他因素,例如年齡,性別,體質量和身高,吸煙和高血清C反應蛋白濃度。在臨床上,CysC已被證明是缺血性損傷后早期腎功能不全的敏感標志物[26]。
嗜中性粒細胞明膠酶相似脂質運載蛋白(NGAL)是一種急性期蛋白,可作為對近端和遠端腎小管上皮細胞急性損傷的反應而分泌。它被腎小球自由過濾,然后通過受體結合和胞吞作用迅速清除。據報道,NGAL是臨床前環境中近端腎小管損傷最敏感的標志物。大鼠慶大霉素暴露后,最早在暴露后24 h即可檢測到清晰的信號。但是,由于在嚙齒動物的腎小球損傷模型中還觀察到NGAL濃度升高,因此必須質疑對損傷部位的特異性。臨床研究表明,在幾種形式的慢性腎臟損傷和尿路感染患者中,尿NGAL升高[27]。
白細胞介素18(IL18)是由白細胞和腎實質細胞(例如腎小管上皮細胞,足細胞和腎小球系膜細胞)產生的促炎細胞因子。它在急性腎小管壞死的加重中起重要作用,并且部分闡明了涉及的炎性反應途徑。IL18受體(IL-18R)在順鉑誘導的急性腎臟損傷中在這些細胞上表達,尿IL18的排泄已被證明是人類尤其是重癥患者急性腎臟損傷的早期診斷指標[28]。但是,目前尚不清楚IL18是否反映了特定部位的損傷,因此尚不清楚其在藥物開發中的臨床前和臨床用途的潛力。一個明顯的缺點是,在許多形式的炎性反應中,不僅限于腎臟,還可以觀察到IL18濃度升高。
N乙酰氨基葡萄糖酶(NAG)是一種溶酶體酶,大量存在于腎小管上皮細胞中,并參與黏多糖和糖蛋白的降解。它的大小可防止腎小球濾過,尿液濃度升高被認為反映了腎小管功能障礙。在臨床前研究中,與血清肌酐比較,NAG的敏感性更高,與BUN相當。NAG響應曲線取決于導致近端小管損傷的毒素。例如,慶大霉素在給藥后會觸發持續8 h的早期反應,而鉻在8 h后會觸發反應,而汞根本不會觸發NAG的顯著增加。然而,臨床證據支持NAG作為輕度腎小管損傷的早期標志物的有用性,并證明它對急性腎小管壞死的發展具有預測性[29]。
谷胱甘肽S轉移酶(αGST)是一種在許多組織中產生的解毒酶。在生理條件下,尿中的αGST濃度非常低,但是大量排泄在各種形式的腎小管損傷中,包括順鉑和慶大霉素誘導的毒性,以及氯化汞和重鉻酸鉀暴露后的急性腎小管壞死[30]。αGST似乎是檢測上皮壞死發作的足夠的臨床前早期毒性生物標志物,但不太適合監測可逆性。與NAG,BUN和血清肌酐比較,在順鉑和慶大霉素的藥物誘導的近端小管細胞損傷中,αGST與組織病理學證實的損傷更緊密相關。在僅限于近端小管細胞直腸的腎小管損傷的臨床前模型中,已證明αGST的排泄反映出低毒性時的損傷,優于許多其他標志物,并且對KIM-1的敏感性相同。但是,收集導管的損傷與αGST降低有關,目前尚不清楚。結果表明,該生物標志物的鑒定必須等待進一步的結果。盡管可獲得的信息有限,但臨床證據表明,αGST可提供有關腎小管功能障礙或損傷的信息[30-31]。
KIM-1是近端腎小管上皮細胞表達的跨膜蛋白。KIM-1發揮磷脂酰絲氨酸受體的功能,并具有吞噬能力。響應損傷,表達明顯上調。與BUN,血清肌酐或尿NAG比較,即使在低度毒性的情況下,尿中KIM-1的濃度在11種成熟的急性腎損傷大鼠模型中也提供了更敏感的組織病理學證實損傷的預測指標。一項研究報道,尿中KIM-1的濃度還與不同級別的腎小管組織病理學相關。在片段特異性毒性模型中發現了KIM-1基因的劑量依賴性上調。αGST似乎是上皮壞死的良好早期毒性生物標志物,而KIM-1和簇蛋白的濃度在再生過程中持續存在,并似乎反映了修復過程的觸發和繼續[32]。KIM-1反應似乎取決于毒素,例如Prozialeck等[33]報道說,順鉑暴露后3 d后KIM-1增加(與簇蛋白和aGST一起),而在使用2-溴乙胺氫溴酸鹽KIM-1濃度的乳頭狀壞死模型中(連同簇蛋白,白蛋白和骨橋蛋白)早在暴露后第1天就增加。有趣的是,尿中KIM-1的測定還可以檢測出亞慢性和慢性損傷,并與組織病理學密切相關。這項研究還表明,CysC和NGAL是早期腎損害的近端腎小管損害最敏感的標志物,但亞慢性或慢性損傷最好通過KIM-1濃度反映出來。與尿KIM-1可能是動物慢性腎毒性的早期標志的觀點相一致,在使用鎘的實驗中,尿KIM-1的濃度升高了。目前,將動物實驗結果轉化為人類的臨床證據十分有限。KIM-1確實在急性腎損傷后顯示出明顯的信號,盡管在本研究中對KIM-1的采樣相當晚,從而排除了對其作為早期標志物的適用性的評估[34]。
B2M由表達主要組織相容性復合體(MHC)I類抗原的所有細胞產生。在正常情況下,主要來源是活化的淋巴細胞,其通過蛋白水解作用從MHC的細胞表面脫落。在以淋巴樣細胞增生為特征的各種條件下會刺激合成,這種增生在各種疾病狀態下發生,例如腫瘤,(自身)免疫疾病或感染[35]。B2M在腎小球上自由過濾,近端腎小管細胞完全吸收。腎小管攝取受損會導致B2M尿排泄增加。腎小球蛋白的丟失也可能會增加尿液中B2M的排泄,因為B2M與其他蛋白具有共同的限速腎小管重吸收途徑。在臨床前環境中,B2M在檢測腎小球損傷(以及尿總蛋白和CysC)方面比BUN和血清肌酐具有更好的診斷性能。由于無腎小球損害的腎小管功能障礙也增加了B2M,僅使用B2M損傷部位的特異性值得懷疑。有趣的是,與其他標記比較,B2M可能通過其他途徑排泄,這可以從乳頭狀壞死模型的發現中得出結論。這種巨大的傷害導致KIM-1,簇蛋白,白蛋白和骨橋蛋白的顯著增加,但B2M的濃度仍接近正常水平。在臨床環境中,B2M已被證明是常染色體多囊腎疾病的疾病嚴重程度標記和富馬酸酯對腎臟的損害標記[36]。
簇蛋白是與細胞凋亡和細胞碎片清除相關的糖基化蛋白,可以在幾種組織中發現。在腎臟細胞中,簇蛋白已被建議具有抗凋亡特性,并促進細胞保護,脂質循環和細胞附著以及聚集[37]。簇蛋白由于其大小不能被腎小球過濾,因此尿液濃度對腎損傷具有特異性。簇蛋白在檢測近端腎小管損傷方面比CysC,B2M和總蛋白更好,證據表明它可以用作早期標記,其輪廓與KIM-1相似。無論位置如何,簇蛋白反應都與腎小管損傷密切相關,特別是當存在再生時。簇蛋白的濃度在再生過程中持續存在,并且似乎反映了修復過程的觸發和繼續。關于腎損傷的尿簇蛋白的臨床數據尚不廣泛。然而,已經表明,在腎損傷和囊性疾病中簇蛋白的表達增加。
TFF3是由黏液產生和其他上皮細胞分泌的一種小肽激素。在腎臟中,它是由收集管的細胞產生/分泌的[38]。TFF3參與許多功能,包括腸上皮的恢復,但其在腎臟內的生理功能仍然難以捉摸。因為在衰老大鼠中發現腎臟TFF3的量減少,所以已經暗示TFF3可能具有一般的保護功能。在不同的大鼠近端腎小管損傷模型中觀察到TFF3的濃度明顯降低。與傳統標記比較,將TFF3與尿白蛋白結合使用可提高對早期損傷的敏感性。但是,缺乏將TFF3與其他新型生物標志物進行比較的研究。在人類中,據報道某些人群(非洲人后裔,糖尿病和降壓藥物的使用)的基線尿液TFF3濃度較高,并且尿液水平升高可能表明腎臟的慢性損傷正在不斷修復[39]。藥物腎毒性和伴隨的生物標志物見表3。
3.2 二肽基肽酶IV 二肽基肽酶IV(DPP IV,Dipeptidyl-Peptidase IV,CD26 EC 3.1.14.5)是一種寡肽酶家族的細胞表面蛋白酶。DPP IV水解肽鏈N端倒數第二個氨基酸為脯氨酸和丙氨酸的二肽,它在血液中和尿液中以游離的形式存在,并通過水解生物活性肽在體內發揮著重要作用。除催化活性外,它還與多種蛋白質相互作用,例如腺苷脫氨酶、HIV gp120蛋白、纖連蛋白、膠原蛋白、趨化因子受體CXCR4和酪氨酸磷酸酶CD45[40]。它也在多種組織中表達,其中以腎臟中表達最豐富,主要在內皮細胞和上皮細胞上高表達。在腎臟中,DPP IV主要表達在近端小管S1-S3節段的細胞游離面刷狀緣的膜表面上,當腎臟腎小管細胞損傷時,DPP IV會大量釋放到原尿中,最終由尿液排出,Mitic等[41]和Sun等[42]報道,尿液中DPP IV的活性可以作為糖尿病腎損傷的標志物。同時,DPP IV還可以作為急性腎小管損傷標志物。
DPP IV最初被描述為T細胞激活分子,一種胸腺細胞和T淋巴細胞的表面標記物,所以也命名魏分化抗原簇一員CD26,表面表達的DPP IV現在被認為是免疫系統中細胞激活的一般標記物。T細胞刺激后,DPP IV表達水平升高,CD26+T細胞百分比升高。DPP IV在靜息B細胞和NK細胞上缺失,刺激后在細胞表面誘導[43]。因此,DPP IV被認為是多種組織損傷、腫瘤、血液惡性腫瘤、免疫、炎性反應、精神神經內分泌疾病和病毒感染的診斷或預后標志物。圖1顯示了DPP IV亞型探針的設計及應用[44-45]。
4 藥物腎毒性的種屬特征
腎臟中主要是轉運體發揮著重要功能,而轉運體在嚙齒動物,狗,猴子和人之間在同樣也存在底物特異性,組織分布和轉運蛋白的相對豐度方面存在顯著差異。這些差異使跨物種外推復雜化,這在嘗試預測候選藥物的人藥代動力學(PK)并評估藥物與藥物相互作用(DDI)的風險時很重要[46]。
以底物特異性和對糖蛋白(P-gp)的表達的物種差異為例。人的MDR1基因與猴和狗不同,小鼠和大鼠的基因組包含編碼P-gp的2個旁系基因(Mdr1a和Mdr1b),其氨基酸序列具有83%的同一性[47]。根據mRNA分析,小鼠Mdr1a主要在腸,腦和睪丸中表達,而Mdr1b的表達在腎上腺,卵巢,胎盤和腎臟中最高。Mdr1a和Mdr1b也在肝臟和心臟中表達[48]。在人體中,MDR1 mRNA主要在腎上腺和腎臟中表達,并在肝臟中大量表達。與其他器官比較,與人,狗和大鼠比較,MDR1/Mdr1基因的mRNA表達在猴子和小鼠的肝臟和腎臟中似乎較少,而和人比較猴子,狗和和嚙齒動物的胃腸道中表達更高[49]。盡管人,小鼠和大鼠腦冷凍切片的免疫熒光染色已證實這些物種中P-gp的蛋白表達,但由于不同物種中抗體識別出的不同表位的潛力,這種比較是定性的而不是定量的[50]。基于液相色譜/串聯質譜(LC-MS/MS)的蛋白質定量方法已用于評估各種組織和不同物種中P-gp的絕對蛋白質表達水平。這提供了一種了解P-gp表達中物種差異的新穎方法。結果顯示,人腦微血管中的P-gp蛋白表達比小鼠低約3倍,但與猴相似[51]。由此可見,當底物由P-gp轉運時,猴子可能是比小鼠更好的模型。
無論是代謝酶還是轉運體的種屬差異,對于我們在評價藥物毒性或療效時,模式動物的選擇顯得尤為重要。根據藥物特征選擇合適的模式動物或者用人源性的體外體系作為檢測手段是藥物在評價毒性的時候需要優先考慮的因素。
5 結論
中藥植物中也有很多藥物會引起腎損傷,典型的腎毒性中藥,如馬兜鈴酸,雷公藤,大黃,朱砂主要破壞腎近端小管或引起間質性腎炎。腎近端小管中的轉運蛋白被認為對異生物素的處理至關重要。研究證明,施用腎毒性中藥時,腎臟轉運蛋白的表達或功能會發生改變,尤其是有機陰離子轉運蛋白1和3。這些轉運蛋白的改變可能會增強毒性藥物的蓄積或內源性毒素的功能障礙,進而使腎臟過敏、受傷。必要的轉運蛋白相關的藥物組合和臨床生物標志物監管,避免毒性的風險是中藥增效減毒的現代化研究的方向[52-54]。
藥物性損傷在臨床治療中是很常見的,對排泄作用的腎容易產生毒性,往往還會在不同的人體身上發生特異質反應,所以診斷和預后往往難以確定,特別是對于特異反應。因此,生物標志物的選擇在藥物毒性評判時顯得尤為重要,不僅在評判臟器損傷時,標志物能對損傷程度進行評判,更重要的是所選擇的標志物能夠對臟器功能以及藥物所能產生的特異質毒性進行評判。
參考文獻
[1]Califf RM.Biomarker definitions and their applications[J].Exp Biol Med(Maywood),2018,243(3):213-221.
[2]Allinson J L.Clinical biomarker validation[J].Bioanalysis,2018,10(12):957-968.
[3]Griffin BR,Faubel S,Edelstein CL.Biomarkers of Drug-Induced Kidney Toxicity[J].Ther Drug Monit,2019,41(2):213-226.
[4]Roh JS,Sohn DH.Damage-Associated Molecular Patterns in Inflammatory Diseases[J].Immune Netw,2018,18(4):e27.
[5]Perazella MA.Drug-induced acute kidney injury:diverse mechanisms of tubular injury[J].Curr Opin Crit Care,2019,25(6):550-557.
[6]Perazella MA.Renal vulnerability to drug toxicity[J].Clin J Am Soc Nephrol,2009,4(7):1275-1283.
[7]Perazella MA.Pharmacology behind Common Drug Nephrotoxicities[J].Clin J Am Soc Nephrol,2018,13(12):1897-1908.
[8]Rougier F,Ducher M,Maurin M,et al.Aminoglycoside dosages and nephrotoxicity:quantitative relationships[J].Clin Pharmacokinet,2003,42(5):493-500.
[9]Nagai J,Takano M.Entry of aminoglycosides into renal tubular epithelial cells via endocytosis-dependent and endocytosis-independent pathways[J].Biochem Pharmacol,2014,90(4):331-337.
[10]Nagai J,Takano M.Molecular aspects of renal handling of aminoglycosides and strategies for preventing the nephrotoxicity[J].Drug Metab Pharmacokinet,2004,19(3):159-170.
[11]Orbach H,Tishler M,Shoenfeld Y.Intravenous immunoglobulin and the kidney--a two-edged sword[J].Semin Arthritis Rheum,2004,34(3):593-601.
[12]Perazella MA.Tenofovir-induced kidney disease:an acquired renal tubular mitochondriopathy[J].Kidney Int,2010,78(11):1060-1063.
[13]Sprowl JA,Lancaster CS,Pabla N,et al.Cisplatin-induced renal injury is independently mediated by OCT2 and p53[J].Clin Cancer Res,2014,20(15):4026-4035.
[14]Hucke A,Ciarimboli G.The Role of Transporters in the Toxicity of Chemotherapeutic Drugs:Focus on Transporters for Organic Cations[J].J Clin Pharmacol,2016,56(Suppl 7):S157-172.
[15]Perazella MA,Izzedine H.New drug toxicities in the onco-nephrology world[J].Kidney Int,2015,87(5):909-917.
[16]Stratta P,Lazzarich E,Canavese C,et al.Ciprofloxacin crystal nephropathy[J].Am J Kidney Dis,2007,50(2):330-335.
[17]Guo X,Nzerue C.How to prevent,recognize,and treat drug-induced nephrotoxicity[J].Cleve Clin J Med,2002,69(4):289-290,293-294,296-297.
[18]Pinheiro FV,Pimentel VC,De Bona KS,et al.Decrease of adenosine deaminase activity and increase of the lipid peroxidation after acute methotrexate treatment in young rats:protective effects of grape seed extract[J].Cell Biochem Funct,2010,28(1):89-94.
[19]Nolin TD.Vancomycin and the Risk of AKI:Now Clearer than Mississippi Mud[J].Clin J Am Soc Nephrol,2016,11(12):2101-2103.
[20]Hall RG 2nd,Yoo E,Faust A,et al.Impact of piperacillin/tazobactam on nephrotoxicity in patients with Gram-negative bacteraemia[J].Int J Antimicrob Agents,2019,53(3):343-346.
[21]Luque Y,Louis K,Jouanneau C,et al.Vancomycin-Associated Cast Nephropathy[J].J Am Soc Nephrol,2017,28(6):1723-1728.
[22]Krishnan N,Perazella MA.Drug-induced acute interstitial nephritis:pathology,pathogenesis,and treatment[J].Iran J Kidney Dis,2015,9(1):3-13.
[23]Best W R.Wintrobes Clinical Hematology[J].JAMA,1993,270(19):2382-2383.
[24]Devarbhavi H.An Update on Drug-induced Liver Injury[J].J Clin Exp Hepatol,2012,2(3):247-259.
[25]Dieterle F,Sistare F,Goodsaid F,et al.Renal biomarker qualification submission:a dialog between the FDA-EMEA and Predictive Safety Testing Consortium[J].Nat Biotechnol,2010,28(5):455-462.
[26]Vassalos A,Young D,MacArthur K,et al.Cystatin C:influence of perfusion and myocardial injury on early(<24 h)renal function after pediatric cardiac surgery[J].Paediatr Anaesth,2011,21(12):1185-1191.
[27]Lee JW,Park JS,Park KB,et al.Prediction of renal cortical defect and scar using neutrophil-to-lymphocyte ratio in children with febrile urinary tract infection[J].Nuklearmedizin,2017,56(3):109-114.
[28]Nozaki Y,Kinoshita K,Yano T,et al.Signaling through the interleukin-18 receptor α attenuates inflammation in cisplatin-induced acute kidney injury[J].Kidney Int,2012,82(8):892-902.
[29]Ouchi M,Suzuki T,Hashimoto M,et al.Urinary N-acetyl-β-D-glucosaminidase levels are positively correlated with 2-hr plasma glucose levels during oral glucose tolerance testing in prediabetes[J].J Clin Lab Anal,2012,26(6):473-480.
[30]Feinfeld DA,Fuh VL,Safirstein R.Urinary glutathione-S-transferase in cisplatin nephrotoxicity in the rat[J].J Clin Chem Clin Biochem,1986,24(8):529-532.
[31]Swain A,Turton J,Scudamore C,et al.Nephrotoxicity of hexachloro-1:3-butadiene in the male Hanover Wistar rat;correlation of minimal histopathological changes with biomarkers of renal injury[J].J Appl Toxicol,2012,32(6):417-428.
[32]Sasaki D,Yamada A,Umeno H,et al.Comparison of the course of biomarker changes and kidney injury in a rat model of drug-induced acute kidney injury[J].Biomarkers,2011,16(7):553-566.
[33]Prozialeck WC,Vaidya VS,Liu J,et al.Kidney injury molecule-1 is an early biomarker of cadmium nephrotoxicity[J].Kidney Int,2007,72(8):985-993.
[34]Chiusolo A,Defazio R,Zanetti E,et al.Kidney injury molecule-1 expression in rat proximal tubule after treatment with segment-specific nephrotoxicants:a tool for early screening of potential kidney toxicity[J].Toxicol Pathol,2010,38(3):338-345.
[35]Tsoukas CM,Bernard NF.Markers predicting progression of human immunodeficiency virus-related disease[J].Clin Microbiol Rev,1994,7(1):14-28.
[36]Dieterle F,Perentes E,Cordier A,et al.Urinary clusterin,cystatin C,beta2-microglobulin and total protein as markers to detect drug-induced kidney injury[J].Nat Biotechnol,2010,28(5):463-469.
[37]Dvergsten J,Manivel JC,Correa-Rotter R,et al.Expression of clusterin in human renal diseases[J].Kidney Int,1994,45(3):828-835.
[38]Chinery R,Poulsom R,Elia G,et al.Expression and purification of a trefoil peptide motif in a beta-galactosidase fusion protein and its use to search for trefoil-binding sites[J].Eur J Biochem,1993,212(2):557-563.
[39]Yu Y,Jin H,Holder D,et al.Urinary biomarkers trefoil factor 3 and albumin enable early detection of kidney tubular injury[J].Nat Biotechnol,2010,28(5):470-477.
[40]Vanderheyden M,Bartunek J,Goethals M,et al.Dipeptidyl-peptidase IV and B-type natriuretic peptide.From bench to bedside[J].Clin Chem Lab Med,2009,47(3):248-252.
[41]Mitic B,Lazarevic G,Vlahovic P,et al.Diagnostic value of the aminopeptidase N,N-acetyl-beta-D-glucosaminidase and dipeptidylpeptidase IV in evaluating tubular dysfunction in patients with glomerulopathies[J].Ren Fail,2008,30(9):896-903.
[42]Sun AL,Deng JT,Guan GJ,et al.Dipeptidyl peptidase-IV is a potential molecular biomarker in diabetic kidney disease[J].Diab Vasc Dis Res,2012,9(4):301-308.
[43]Gorrell MD,Wickson J,McCaughan GW.Expression of the rat CD26 antigen(dipeptidyl peptidase IV)on subpopulations of rat lymphocytes[J].Cell Immunol,1991,134(1):205-215.
[44]Ma H,Qian X K,Zhang J,et al.Accurate and sensitive detection of dipeptidyl peptidase-IV activity by liquid chromatography with fluorescence detection[J].Analytical Methods,2020,12(6):848-854.
[45]Zou LW,Wang P,Qian XK,et al.A highly specific ratiometric two-photon fluorescent probe to detect dipeptidyl peptidase IV in plasma and living systems[J].Biosens Bioelectron,2017,90:283-289.
[46]Chu X,Bleasby K,Evers R.Species differences in drug transporters and implications for translating preclinical findings to humans[J].Expert Opin Drug Metab Toxicol,2013,9(3):237-252.
[47]Devault A,Gros P.Two members of the mouse mdr gene family confer multidrug resistance with overlapping but distinct drug specificities[J].Mol Cell Biol,1990,10(4):1652-1663.
[48]Chen C,Liu X,Smith BJ.Utility of Mdr1-gene deficient mice in assessing the impact of P-glycoprotein on pharmacokinetics and pharmacodynamics in drug discovery and development[J].Curr Drug Metab,2003,4(4):272-291.
[49]Bleasby K,Castle JC,Roberts CJ,et al.Expression profiles of 50 xenobiotic transporter genes in humans and pre-clinical species:a resource for investigations into drug disposition[J].Xenobiotica,2006,36(10-11):963-988.
[50]Warren MS,Zerangue N,Woodford K,et al.Comparative gene expression profiles of ABC transporters in brain microvessel endothelial cells and brain in five species including human[J].Pharmacol Res,2009,59(6):404-413.
[51]Ito K,Uchida Y,Ohtsuki S,et al.Quantitative membrane protein expression at the blood-brain barrier of adult and younger cynomolgus monkeys[J].J Pharm Sci,2011,100(9):3939-3950.
[52]Feng X,Fang SN,Gao YX,et al.Current research situation of nephrotoxicity of Chinese herbal medicine[J].China Journal of Chinese Materia Medica,2018,43(3):417-424.
[53]Shen QQ,Wang JJ,Roy D,et al.Organic anion transporter 1 and 3 contribute to traditional Chinese medicine-induced nephrotoxicity[J].Chin J Nat Med,2020,18(3):196-205.
[54]Yang B,Xie Y,Guo M,et al.Nephrotoxicity and Chinese Herbal Medicine[J].Clin J Am Soc Nephrol,2018,13(10):1605-1611.
(2020-11-19收稿 責任編輯:王明)

