電針對高血脂合并腦缺血大鼠巢蛋白和增殖細胞核抗原表達的影響
係夢琪 李曉碩 葛東宇 董瑞娟 任秀君

摘要 目的:觀察電針對高血脂合并腦缺血大鼠側腦室外側壁巢蛋白(Nestin)和增殖細胞核抗原(PCNA)表達的影響。方法:41只成年雄性SD大鼠隨機分為正常組和高脂飼料喂養組,高脂飼料喂養組大鼠用高脂飼料喂養42 d造成高脂血癥模型后,隨機分為假手術組、模型組、電針1組、電針2組。電針1組電針“豐隆”,1次/d,連續7 d。第50天,電針組和模型組用FeCl3化學誘導造成腦缺血,術后電針組電針“豐隆”“百會”,1次/d,連續14 d。用神經功能缺損評分評定行為學變化,生物化學法檢測血脂四項,HE染色觀察缺血半暗帶形態學改變,免疫組化檢測缺血側側腦室外側壁Nestin和PCNA的表達。結果:術后14 d模型組TC、LDL升高(P<0.01),HDL降低(P<0.01);電針組TC、LDL降低(P<0.05),HDL升高(P<0.05)。模型組神經功能缺損評分增高,HE染色組織形態呈腦缺血改變,Nestin、PCNA陽性細胞個數增多(P<0.05);電針治療可降低神經功能缺損評分(P<0.05),缺血半暗帶細胞形態接近正常,Nestin、PCNA陽性細胞數升高(P<0.05),術后7 d時達到高峰,且電針1組高于電針2組(P<0.05)。結論:電針“豐隆”“百會”可調節血脂,促進缺血側側腦室外側壁Nestin、PCNA的表達,改善神經功能,且在高血脂階段進行針刺干預效果更佳。
關鍵詞 電針;腦缺血;高脂血癥;側腦室;神經干細胞
Effect of Electroacupuncture on the Expression of Nestin and Proliferating Cell Nuclear Antigen of Rats with Hyperlipemia and Cerebral Ischemia
XI Mengqi1,LI Xiaoshuo1,GE Dongyu2,DONG Ruijuan2,REN Xiujun1
(1 School of Acupuncture-Moxibustion and Tuina,Beijing University of Chinese Medicine,Beijing 100029,China; 2 School of Traditional Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objective:To observe the effect of electroacupuncture(EA)on the expression of Nestin and proliferating cell nuclear antigen(PCNA)in the lateral ventricle wall(LVW)of rats with hyperlipemia and cerebral ischemia.Methods:A total of 41 adult male SD rats were randomly divided into a normal group and a high fat diet group(HFD).Rats in HFD group were fed with HFD for 42 days to establish hyperlipidemia model,and then randomly divided into a sham-operation group,a model group,a EA1 and EA2 group.Rats in EA1 group were needled at ST40 with EA(2/100 Hz,1~3 mA)20 minutes,once daily for 7 days.On the 50th day,rats in model and EA groups were induced to cerebral ischemia by 50% FeCl3.Rats in EA groups were needled at ST40 and GV20,once daily for 14 days.The behavior was assessed by neurological deficit score(NDS).Four items of blood lipids were detected by biochemical method.HE staining was used to observe the morphological changes of ischemic penumbra.Immunohistochemistry was used to detect the expression of Nestin and PCNA in the lateral ventricle wall.Results:After 14 d operation,TC,LDL increased(P<0.01)and HDL decreased(P<0.01)in model group.TC,LDL reduced(P<0.05)and HDL rose(P<0.05)in EA group.Rats in model group had higher NDS.HE stained tissue morphology showed cerebral ischemic changes,and the number of Nestin and PCNA positive cells increased(P<0.05).Electroacupuncture treatment could reduce the neurological deficit score(P<0.05),the morphology of ischemic penumbra cells was close to normal,the number of Nestin and PCNA positive cells increased(P<0.05),7 days after operation,and the number of Nestin and PCNA positive cells in EA group 1 was higher than that in EA 2 group(P<0.05).Conclusion:EA at Fenglong(ST40)and Baihui(GV20)can regulate blood lipid metabolism,promote Nestin and PCNA expression in lateral ventricle wall of ischemic lateral ventricle,improve nerve function.And EA at hyperlipemia stage is more effective than EA after hyperlipemia with cerebral ischemia.
Keywords Electroacupuncture; Cerebral ischemia; Hyperlipemia; Lateral ventricles; Neural stem cell
中圖分類號:R245-33文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2020.23.015
缺血性腦中風是世界范圍內三大主要致死疾病之一,發病率、致殘率、死亡率均高,給人們的工作和生活造成了嚴重的影響[1]。腦缺血主要是腦內血液供應障礙引起的大腦局部缺血缺氧,以大腦中動脈梗阻最為常見[2]。有大量證據表明高脂血癥與缺血性神經血管損傷密切相關,血脂異常會引起氧化應激,內皮功能障礙,血腦屏障紊亂和血管炎性反應等一系列與腦缺血損傷密切相關的血管事件[3-4]。因此,改善血脂異常,可以有效預防缺血性腦血管病的發生。
西醫治療中風常用溶栓、降壓、調脂、改善腦循環等方法,但在實際臨床應用中仍有一定風險[5]。針灸作為中醫藥的一部分,其治療缺血性中風的作法可以追溯到中國古代,且目前在世界范圍內仍然普遍存在[6]。針灸治療中風及其后遺癥具有方便快捷,效果顯著,不良反應較小等特點[7]。研究表明,針灸在血液供應中斷后可調節腦血流量,促進神經發生,以及缺血性損傷后的神經可塑性[8-9]。臨床上治療中風的針灸處方有很多,我們根據“化痰開竅”理論選擇“豐隆”“百會”兩穴相配。前期實驗結果表明,在高血脂階段電針“豐隆”,高血脂合并腦缺血術后電針“豐隆”“百會”可通過調節血脂水平改善高血脂合并腦缺血大鼠神經功能,減小腦梗死體積,促進側腦室室管膜下區(Subventricular Zone,SVZ)的神經細胞增殖[10]。
巢蛋白(Nestin)又名神經上皮干細胞蛋白,是第VI類中間絲蛋白,Nestin主要在神經干細胞中表達,因此常作為神經干細胞的標志物[11]。增殖細胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)是一種DNA修復蛋白,在增殖細胞的細胞核中表達,因而成為評價細胞增殖狀態和DNA修復的重要指標[12]。本實驗通過高血脂合并腦缺血模型,研究在高血脂階段進行電針“豐隆”預處理,腦缺血術后電針“豐隆”“百會”對模型大鼠缺血側側腦室外側壁Nestin、PCNA表達的影響。
1 材料與方法
1.1 材料
1.1.1 動物 SPF級成年雄性SD大鼠41只,體質量(200±20)g,均由北京維通利華實驗動物技術有限公司提供,動物許可證號:SCXK(京)2012-0001。大鼠飼養于北京中醫藥大學針灸推拿學院實驗室,保持12 h光照/12 h黑暗的自然生物節律,實驗室溫度(24±1)℃,濕度(50±10)%,自由攝食飲水。
1.1.2 試劑與儀器 一次性使用無菌針灸針(北京中研太和醫療器械有限公司,型號:0.30 mm×25 mm),韓氏穴位神經刺激儀(北京華衛產業開發公司,型號:LH202H),低溫高速離心機(Eppendorf公司,德國,型號:Centrifuge 5810R),石蠟切片機(Leica公司,德國,型號:Leitz-1516),顯微鏡(Olympus公司,日本,型號:BX40F4),數碼相機(Olympus公司,日本,型號:E-330)。Nestin抗體(Abcam公司,美國,批號:GR3149934-4),PCNA抗體(武漢博士德生物工程有限公司,批號:PC10),聚合HRP標記抗小鼠IgG(武漢博士德生物工程有限公司,批號:13L10A01),DAB顯色液(武漢博士德生物工程有限公司,批號:13K30C22)。
1.2 方法
1.2.1 分組與模型制備 將大鼠隨機分為普通飼料喂養組(正常組)5只,高脂飼料喂養組(High Fat Diet,HFD)36只。參照前期工作,HFD大鼠用特殊配比的高脂飼料連續喂養造成高血脂模型[13]。同期喂養42 d后,根據隨機數字表法將HFD大鼠分為假手術組、模型組、電針1組、電針2組各9只。43~49 d電針1組大鼠電針雙側“豐隆”,1次/d,其余各組每天抓取一次,不做其他處理。第50天,模型組和電針1、2組用FeCl3化學誘導造成腦缺血模型[14]:用戊巴比妥鈉溶液(40 mg/kg)腹腔注射麻醉大鼠,將其固定于右側臥位上,從左眶上緣與外耳道連線的中點縱向切開一個2 cm左右的切口,暴露顳骨,用咬骨鉗咬除部分左側顳骨,做一個直徑為3~5 mm的骨窗,暴露大腦中動脈(Middle Cerebral Artery,MCA),將浸有50%FeCl3(用0.1 mol/L HCL配置)溶液約10 μL的定量濾紙敷于暴露的MCA上20 min,去掉濾紙,逐層縫合,局部使用少許青霉素粉消炎抗菌。假手術組用生理鹽水濾紙貼敷,其余操作同模型組。腦缺血術后電針1、2組電針“豐隆”“百會”,1次/d,治療14 d。除正常組外,其余每組分為腦缺血術后1、7、14 d 3個時間點,生存期滿后取材。
1.2.2 干預方法 大鼠腧穴按《實驗針灸學》[15]所附的常用實驗動物針灸穴位圖定位。豐隆(ST40):膝關節后外側,腓骨正中,在腓骨小頭下約7 mm處。百會(GV20):頂骨正中處。“豐隆”直刺7 mm,“百會”及“百會”前2 mm各向后斜刺2 mm;雙側“豐隆”“百會”及“百會”前2 mm處分別接電針,連續波,頻率為2/100 Hz交替,刺激強度1-2-3 mA,以大鼠肢體輕微顫動為度,時間20 min。
1.2.3 檢測指標與方法
1.2.3.1 神經功能缺損評分(Neurological Deficit Score,NDS) 腦缺血后24 h用改良的Bederson5分級評分法[16]對大鼠進行神經功能缺損評分。完全正常,無運動功能缺損(正常)為0分;提尾時對側前肢不能伸展(輕度)為1分;向對側轉圈(中度)為2分;不能向對側運動(重度)為3分;不能自主運動,意識水平低下(極重度)為4分。評分大于或等于1分,納入實驗。
1.2.3.2 血脂4項 腦缺血術后14 d,大鼠戊巴比妥鈉腹腔麻醉后,腹主動脈取血2 mL,取血12 h前禁食,自由飲水。在4 ℃下離心15 min(轉速3 000 r/min,離心半徑12 cm),取上清液-20 ℃冷凍保存。由北京中醫藥大學東直門檢驗科檢測血清中血脂四項。用酶法測定總膽固醇(Total Cholesterol,TC),GPO-POD法測定三酰甘油(Triglycerides,TG),直接法測定低密度脂蛋白(Low-density Lipoprotein,LDL)和高密度脂蛋白(High-density Lipoprotein,HDL)。
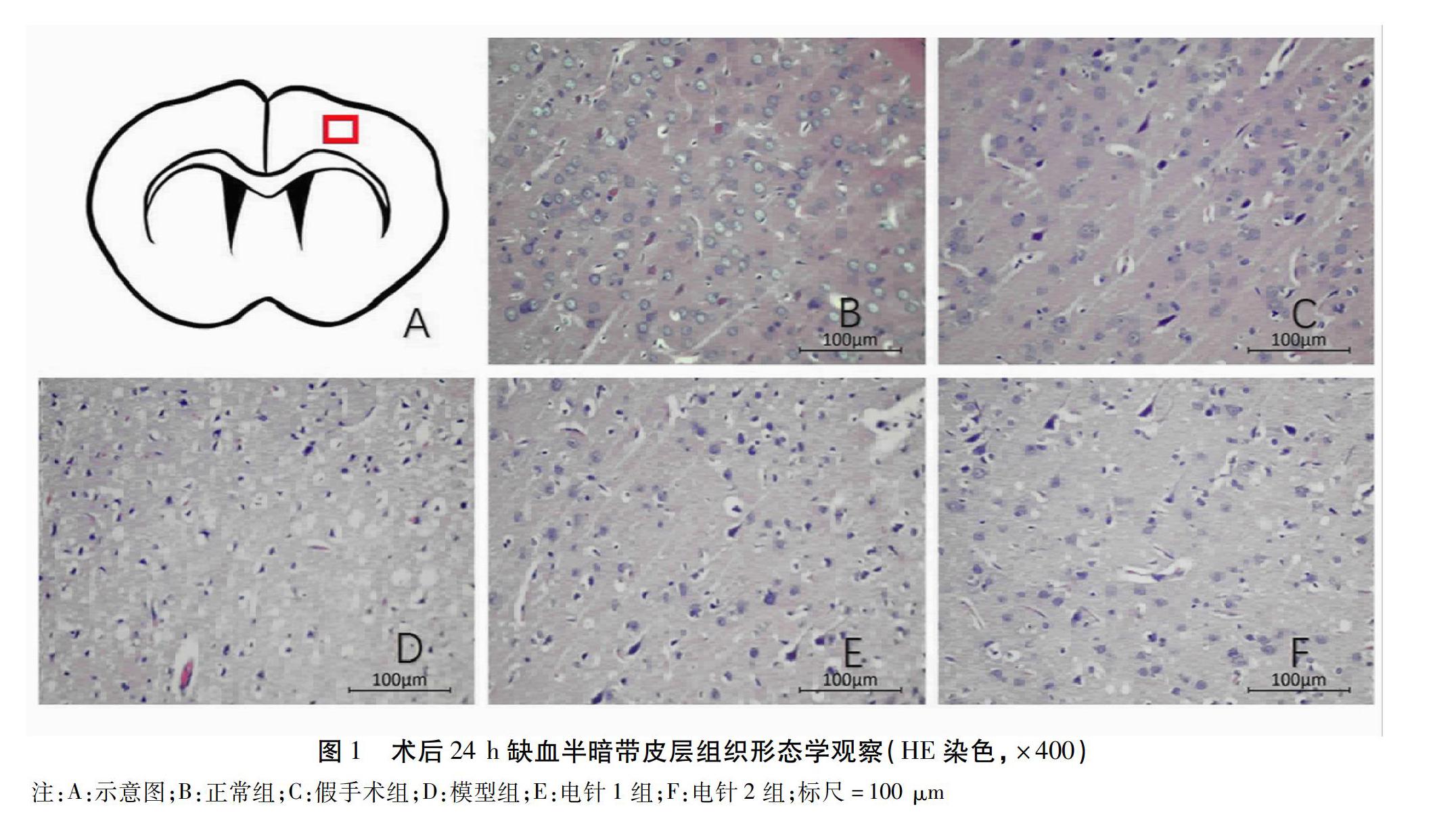
1.2.3.3 缺血后組織形態觀察 大鼠存活期滿后,經戊巴比妥鈉腹腔麻醉,開胸,暴露心臟和升主動脈,先用灌注針灌注生理鹽水約300 mL沖洗血管,大鼠血液顏色變淡、肝肺顏色變白后,用預冷的4%多聚甲醛繼續灌注,至大鼠肢體僵硬。斷頭取腦,浸入10%中性甲醛中固定,石蠟浸潤、包埋,制備蠟塊,常溫保存備用。每只動物于腦缺血術后24 h隨機選取2張在側腦室水平的切片(片厚5 μm),蘇木精-伊紅染色法(Hematoxylin-eosin Staining,HE)觀察缺血后細胞的形態變化。
1.2.3.4 Nestin、PCNA免疫組織化學檢測 石蠟切片脫蠟至水,PBS磷酸鹽緩沖液沖洗3 min×3次,用3% H2O2室溫孵育10 min,消除內源性過氧化物酶活性。切片放入配好的0.01 mol/L PBS-枸橘酸緩沖液中做抗原熱修復45 min,自然冷卻至室溫后滴加5%BSA封閉液,37 ℃孵育30 min后甩干,勿洗。分別滴加Nestin抗體(1∶400)、PCNA抗體(1∶100),在濕盒中4 ℃孵育過夜,PBS沖洗3 min×3次,滴加聚合HRP標記抗鼠IgG,37 ℃孵育30 min,PBS浸泡3 min×3次,DAB顯色,顯微鏡下控制顯色時間,終止反應后用自來水沖洗,梯度乙醇脫水,二甲苯透明,中性樹脂封片。用0.01 mol/L的PBS緩沖液做陰性對照。染色結果以缺血側側腦室外側壁為主要觀察部位,每個時間點2只大鼠,隨機選取9個視野,統一放大400倍。用光學顯微鏡BX40F4鏡下觀察,用E-330型照相機采集圖片,胞質染成棕黃色顆粒的為Nestin陽性細胞,細胞核染成棕褐色顆粒的為PCNA陽性細胞。應用Image Pro Plus軟件獲得每100 μm×100 μm視野中陽性細胞個數。
1.3 統計學方法 采用SPSS 20.0統計軟件進行分析。NDS以中位數(四分位區間)[Md(P25,P75)]表示,用Kruslal-Wallis H秩和檢驗,兩兩比較采用Dunn′s multiple comparison test。其他數據以均值±標準差(±s)表示。血脂用單因素方差分析,免疫組化用析因設計方差分析,組間兩兩比較用LSD-t法、Dunnett-t法或Dunn′s multiple comparison test。以P<0.05為差異有統計學意義。
2 結果
2.1 神經功能缺損評分 腦缺血術后24 h,模型組大鼠體質量減輕,右側上肢不能伸展,個別向右側轉圈,未見神志不清、不能進食等癥狀。與模型組比較,電針1組、電針2組神經功能缺損評分均有所降低(P<0.05),且電針1組較電針2組更為明顯。見表1。
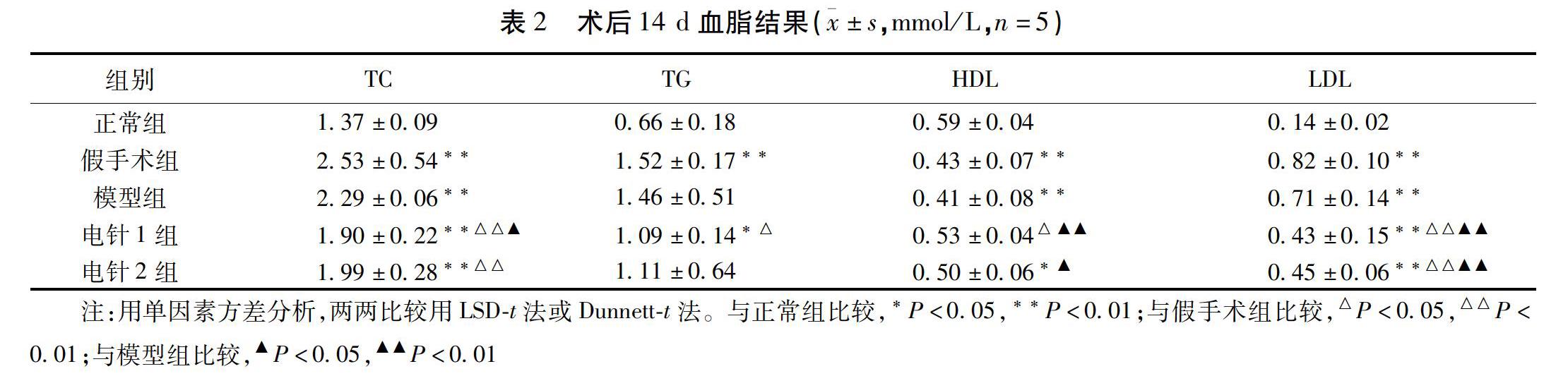
2.2 血脂結果 與正常組比較,腦缺血術后14 d模型組TC、LDL顯著升高(P<0.01),HDL降低(P<0.01)。與模型組比較,術后14 d電針1組TC、LDL降低(P<0.05),HDL升高(P<0.01);電針2組LDL降低(P<0.01),HDL升高(P<0.05)。見表2。
2.3 HE染色結果 術后24 h,假手術組缺血半暗帶皮層神經元呈圓形或橢圓形,結構完整,排列整齊,分層明顯,細胞核淡染,核仁清晰,與正常組形態基本一致。模型組神經元排列散亂,層次不清,可見大量皺縮的神經元,細胞核固縮,染色較深,核周出現空泡,血管中有紅細胞滲出,組織形態整體上呈腦缺血改變。電針1組形態結構接近正常,缺血區附近正常神經元明顯增多,偶見皺縮的細胞核。電針2組可見少量皺縮的神經元,組織間偶見空泡樣結構,整體上趨于正常。見圖1。
2.4 Nestin陽性細胞個數 假手術組Nestin陽性細胞數量少,染色淺。模型組Nestin陽性細胞分布比較密集,染色較深,在側腦室室管膜下區聚集。電針組Nestin陽性表達明顯增多,在側腦室外側壁呈深棕色,排列緊密,7 d時表達增多最明顯。見圖2。
模型組腦缺血術后1、7 d,Nestin陽性表達升高(P<0.05)。與模型組比較,電針1組Nestin陽性細胞個數在術后1、7、14 d均增多(P<0.05),電針2組在術后7 d時增高(P<0.05)。電針1組Nestin陽性細胞個數比電針2組高,且在腦缺血后7 d增高,差異有統計學意義(P<0.01)。側腦室外側壁Nestin陽性細胞計數顯示時間和組間存在交互作用(P<0.05),時間因素的作用隨分組的不同而不同。見表3。
2.5 PCNA陽性細胞個數 假手術組PCNA陽性細胞數量較少,染色較淺,分布稀疏。模型組PCNA陽性細胞在側腦室外側壁排列比較密集,染色加深。與模型組比較,電針2組PCNA陽性細胞數量明顯增多,顏色呈棕黑色,電針1組表達更為明顯,尤其是術后7 d。見圖2。
模型組腦缺血術后1、7、14 d,PCNA陽性表達較假手術組均升高,且在1 d時差異有統計學意義(P<0.05)。與模型組比較,電針1組PCNA陽性細胞個數在術后1、7、14 d均增多(P<0.05),電針2組在術后7、14 d時增高(P<0.05)。電針1組PCNA陽性細胞個數較電針2組高,且在腦缺血后1 d增高,差異有統計學意義(P<0.05)。側腦室外側壁PCNA陽性細胞計數顯示時間和組間無交互作用(P>0.05)。見表4。
3 討論
腦缺血中風與高脂血癥關系密切,高達70%的中風是血栓阻塞動脈引起大腦局部缺血造成的,研究表明高血脂是引起腦中風的獨立危險因素,人體血脂含量過高,血液中的脂肪易于在動脈中層出現沉積形成粥樣斑塊,造成頸動脈狹窄、大腦缺血,當斑塊脫落堵塞腦血管,大腦血流中斷,出現腦卒中[17]。血脂異常是腦血管病發病的重要危險因素,血清中TC、LDL濃度增高,HDL濃度降低,明顯增加缺血性卒中的風險[18-19]。因此,改善血脂異常,降低血脂濃度對于缺血性中風患者的治療和預后有積極意義,在高血脂階段進行針刺干預可能是預防中風的有效手段。
豐隆為足陽明經絡穴,別走于足太陰脾經,具有通經活絡、祛濕化痰、醒腦安神等功效,被古今醫家公認為治痰要穴。百會位于頭頂正中,是督脈與手足三陽經、足厥陰經的交會穴,具有醒腦開竅、安神定志、通督定癇等作用。將具有化痰作用的豐隆與具有開竅作用的百會兩穴相配,體現出“化痰通絡、醒腦開竅”的配穴原則[20]。
神經干細胞在神經系統中主要作為一種儲備細胞存在,當神經系統受到損傷時,如急性缺血性腦梗死、神經退行性疾病等,這些細胞便開始增殖、遷移及分化為相應的組織細胞,以便實現結構和功能的代償[21]。成年哺乳動物大腦中的神經發生主要集中在2個區域:側腦室室管膜下區SVZ和海馬齒狀回的顆粒下層(Subgranular Zone,SGZ)[22]。巢蛋白在成年神經干細胞,未成熟的神經祖細胞中瞬時表達,并在細胞轉化為分化細胞后消失,被廣泛用作胚胎和成年大腦中神經干細胞的標記物[11]。局灶性腦缺血后SVZ區Nestin陽性細胞數目迅速升高并在7 d達到高峰,神經干細胞在缺血發作后立即被激活[23-24]。電針治療后腦缺血大鼠室管膜下區Nestin免疫陽性細胞明顯增多[25]。作為增殖標志物,PCNA通常用于標記積極分裂的細胞,實驗性腦缺血后,腦室下區PCNA陽性細胞個數增多,針刺可能通過增強腦缺血大鼠側腦室室管膜下區PCNA的表達,促進神經細胞增殖,從而改善神經功能[26]。Nestin和PCNA免疫熒光雙染陽性是增殖神經干細胞的標志[27]。研究發現腦缺血損傷后缺血側側腦室室管膜下區Nestin和PCNA表達增多[28],術后7 d達到高峰,14 d時有所下降[29],SVZ區神經干細胞增殖并參與了損傷后大腦的自我修復過程。然而,內源性神經發生不能提供足夠的細胞來修復中風等重大事件造成的神經損傷,因此,采取能夠刺激內源性神經干細胞增殖和分化的措施是非常重要的[30]。研究發現,電針可以改善局灶性腦缺血大鼠神經功能缺損,促進內源性神經干細胞增殖和分化[31]。前期實驗結果表明,電針可以促進高脂血癥合并腦缺血大鼠缺血側側腦室室管膜下區神經干細胞增殖,從而減輕腦缺血術后腦組織損傷[32]。
本實驗結果顯示,腦缺血術后缺血側側腦室外側壁Nestin、PCNA陽性細胞從1 d開始增加,一直持續到術后7 d,14 d時出現回落趨勢,與其他研究結果相似[23-24],提示腦缺血可能誘導缺血側側腦室外側壁神經干細胞增殖。在高脂血癥狀態下電針“豐隆”,腦缺血后電針“豐隆”“百會”可增強側腦室外側壁Nestin和PCNA的表達,在術后7 d達到高峰,14 d時仍處于較高水平。腦缺血后電針“豐隆”“百會”治療同樣可促進側腦室外側壁Nestin、PCNA陽性表達,但僅在術后7 d陽性細胞增多顯著。提示連續電針治療可使側腦室外側壁神經干細胞在腦缺血后一段時間內處于持續增殖狀態,且在7 d時增殖達到高峰,與其他研究結果一致[31]。
總之,電針豐隆、百會可調節血脂代謝,減輕腦缺血損傷,改善神經功能,促進側腦室外側壁神經干細胞增殖,從而達到腦損傷后神經的自我修復作用,在高血脂階段就進行電針干預作用更明顯,體現了中風早期防治的重要性。
參考文獻
[1]Verma R,Ritzel RM,Crapser J,et al.Evaluation of the Neuroprotective Effect of Sirt3 in Experimental Stroke[J].Transl Stroke Res,2019,10(1):57-66.
[2]張藺珊,李娟娟,吳春云.腦缺血的損傷機制及相關信號通路的研究進展[J].神經解剖學雜志,2014,30(6):729-732.
[3]Cao XL,Du J,Zhang Y,et al.Hyperlipidemia exacerbates cerebral injury through oxidative stress,inflammation and neuronal apoptosis in MCAO/reperfusion rats[J].Exp Brain Res,2015,233(10):2753-2765.
[4]Yan BC,Park JH,Ahn JH,et al.Effects of high-fat diet on neuronal damage,gliosis,inflammatory process and oxidative stress in the hippocampus induced by transient cerebral ischemia[J].Neurochem Res,2014,39(12):2465-2478.
[5]Barrett KM,Lal BK,Meschia JF.Stroke:advances in medical therapy and acute stroke intervention[J].Curr Cardiol Rep,2015,17(10):79.
[6]Zhu W,Ye Y,Liu Y,et al.Mechanisms of Acupuncture Therapy for Cerebral Ischemia:an Evidence-Based Review of Clinical and Animal Studies on Cerebral Ischemia[J].J Neuroimmune Pharmacol,2017,12(4):575-592.
[7]Shin S,Yang SP,Yu A,et al.Effectiveness and safety of electroacupuncture for poststroke patients with shoulder pain:study protocol for a double-center,randomized,patient-and assessor-blinded,sham-controlled,parallel,clinical trial[J].BMC Complement Altern Med,2019,19(1):58.
[8]Chen B,Tao J,Lin Y,et al.Electro-acupuncture exerts beneficial effects against cerebral ischemia and promotes the proliferation of neural progenitor cells in the cortical peri-infarct area through the Wnt/β-catenin signaling pathway[J].Int J Mol Med,2015,36(5):1215-1222.
[9]Huang J,Ye X,You Y,et al.Electroacupuncture promotes neural cell proliferation in vivo through activation of the ERK1/2 signaling pathway[J].Int J Mol Med,2014,33(6):1547-1553.
[10]李曉碩,葛東宇,董瑞娟,等.電針對高血脂合并腦缺血大鼠腦梗死體積及SVZ形態學影響[J].環球中醫藥,2018,11(4):502-508.
[11]Bernal A,Arranz L.Nestin-expressing progenitor cells:function,identity and therapeutic implications[J].Cell Mol Life Sci,2018,75(12):2177-2195.
[12]Bártová E,Suchánková J,Legartová S,et al.PCNA is recruited to irradiated chromatin in late S-phase and is most pronounced in G2 phase of the cell cycle[J].Protoplasma,2017,254(5):2035-2043.
[13]于若凡,于雪,任秀君.電針對高血脂合并腦缺血大鼠血脂和腦梗死體積的影響及其機制探討[J].北京中醫藥大學學報,2018,41(3):227-234.
[14]Spasov AA,Kucheryavenko AF,Kosolapov VA,et al.Antithrombogenic activity of antioxidant compounds[J].Bull Exp Biol Med,2013,155(6):775-777.
[15]張露芬,盧峻,嵇波.實驗針灸學[M].北京:化學工業出版社,2010:219-224.
[16]Huang Z,Huang PL,Panahian N,et al.Effects of cerebral ischemia in mice deficient in neuronal nitric oxide synthase[J].Science,1994,265(5180):1883-1885.
[17]鐘躍,邱偉,廖珍蘭,等.缺血性腦卒中患者頸動脈粥樣硬化斑塊的超聲檢查與CT血管造影的影像表現分析[J].中國CT和MRI雜志,2018,16(9):2.
[18]熊學輝,翟丹霞.不同類型腦卒中與血脂的關系及相互影響[J].河北醫藥,2016,38(11):1632-1635.
[19]曹承蘭,余年,林興建,等.腦卒中高危人群的相關危險因素[J].臨床神經病學雜志,2014,27(5):335-337.
[20]李曉碩,于若凡,任秀君,等.“化痰開竅”辨證配穴的理論探討[J].環球中醫藥,2017,10(5):607-610.
[21]Boese AC,Le QE,Pham D,et al.Neural stem cell therapy for subacute and chronic ischemic stroke[J].Stem Cell Res Ther,2018,9(1):154.
[22]Ruddy RM,Morshead CM.Home sweet home:the neural stem cell niche throughout development and after injury[J].Cell Tissue Res,2018,371(1):125-141.
[23]Huang D,Liu H,Qu Y,et al.Non-invasive remote ischemic postconditioning stimulates neurogenesis during the recovery phase after cerebral ischemia[J].Metab Brain Dis,2017,32(6):1805-1818.
[24]Krishnasamy S,Weng YC,Thammisetty SS,et al.Molecular imaging of nestin in neuroinflammatory conditions reveals marked signal induction in activated microglia[J].J Neuroinflammation,2017,14(1):45.
[25]王光義,趙沁慧.電針對局灶性腦缺血再灌注大鼠腦組織Nestin及bFGF表達的影響[J].醫學信息,2013,26(21):298-299.
[26]胡光強,余錄,張豐正,等.醒腦開竅針刺法對腦缺血再灌注損傷大鼠PCNA表達的影響[J].瀘州醫學院學報,2014,37(5):488-491.
[27]陳偉,陳嵐芬,張夢蓓,等.不同褪黑素治療方案對缺氧缺血性腦損傷新生大鼠內源性神經干細胞增殖的影響[J].中國當代兒科雜志,2019,21(8):830-835.
[28]唐曉洪,來青偉,李青云,等.Ro25-6981對缺血再灌注大鼠腦室下區神經干細胞增殖的影響[J].解剖學雜志,2017,40(4):425-428.
[29]來青偉,唐曉洪,李青云,等.缺血再灌注損傷對成年大鼠腦室下區神經干細胞增殖和NMDA受體亞單位2A表達的影響[J].神經解剖學雜志,2016,32(3):380-384.
[30]Lapchak PA,ZHANG JH.Cellular and Molecular Approaches to Regeneration and Repair[M].Cham:Springer International Publishing,2018:101-112.
[31]Tao J,Xue XH,Chen LD,et al.Electroacupuncture improves neurological deficits and enhances proliferation and differentiation of endogenous nerve stem cells in rats with focal cerebral ischemia[J].Neurol Res,2010,32(2):198-204.
[32]任秀君,馬惠芳,圖婭.電針對高脂血癥合并腦缺血大鼠側腦室室管膜下區神經干細胞增殖的影響[J].針刺研究,2010,35(3):175-181.
(2020-02-21收稿 責任編輯:王明)

