浙南壇紫菜實驗品系與傳統品系遺傳多樣性的AFLP分析
劉穎,張鵬,王鐵桿*,任鵬
(1.浙江省海洋水產養殖研究所,浙江 溫州 325005; 2.浙江省近岸水域生物資源開發與保護重點實驗室,浙江 溫州 325005)
壇紫菜(Pyropiahaitanensis)屬于紅藻門(Rhodophyta),紅藻綱(Rhodophyceae),紅毛菜目(Bangiales),紅毛菜科(Bangiaceae),法紫菜屬(Pyropia)[1]。主要棲息在潮間帶,是我國特有暖溫帶性種類,分布于浙江、福建和廣東三省沿海[2],其產量約占全國紫菜總產量的75%[3]。浙江壇紫菜產業位居全國第二,壇紫菜是浙江省第一大經濟海藻,栽培面積6 667 hm2,養殖品種主要以原有的野生型為主。近年來氣候變化明顯加劇,本地養殖品系連續發生嚴重病爛,養殖減產,所以推廣具有優良性狀的新品系對壇紫菜產業的健康發展具有重要意義。然而對于篩選推廣的新品系的遺傳多樣性水平及其與傳統的本地養殖品系壇紫菜的遺傳多樣性差異尚不清楚。遺傳多樣性是生物對復雜環境適應能力的一種反應[4],是評價生物資源狀況的重要依據。因此,對壇紫菜新品系遺傳多樣性水平的研究具有重要意義。
擴增片段長度多態性(amplified fragment length polymorphism,AFLP)是迄今最有效的分子標記之一,已被大量運用在大型海藻的種質鑒定[5-6]、遺傳多樣性分析[7-8]、連鎖圖譜構建等領域[9],因此,本研究選用AFLP標記技術對不同品系的壇紫菜進行遺傳多樣性分析,以了解其遺傳多樣性和遺傳特征等信息,為壇紫菜種質資源的遺傳背景信息積累提供參考[10]。
1 材料與方法
1.1 材料
本實驗所用壇紫菜樣品浙南3號和玉環當地養殖種于2017年11月8日隨機采自浙江省臺州市玉環市箬笠礁海域中的養殖網簾,各取30株用于AFLP分析。
1.2 基因組DNA的提取
使用“DN14-植物基因組DNA快速提取試劑盒”(北京艾德萊生物科技有限公司,DN1401)按照操作說明提取壇紫菜基因組DNA,經1%瓊脂糖凝膠電泳檢測其完整性后,利用微量分光光度計(Nano-400)測定DNA的質量與濃度,將DNA濃度調至20 ng·μL-1,-20 ℃保存備用。
1.3 AFLP分析
用于AFLP分析的內切酶(EcoRⅠ和MseⅠ)和T4 DNA連接酶為Fermentas公司生產;實驗所用的接頭和引物由英濰捷基(上海)公司合成,序列見表1。毛細管電泳檢測由生工生物工程(上海)股份有限公司完成。反應步驟和反應體系如下:

表1 AFLP引物與接頭序列
酶切體系:模板DNA(20 ng·μL-1)5 μL,EcoRⅠ(10 U·μL-1)0.1 μL,MseⅠ(10 U·μL-1)0.1 μL,10×Tango Buffer 4 μL,滅菌純凈水補齊至20 μL。反應條件:37 ℃酶切4 h,接著65 ℃酶切4 h,80 ℃滅活20 min。
連接體系:酶切產物5 μL,T4連接酶0.5 μL,10×T4 Buffer 1 μL,50% PEG4000 1 μL,EcoRⅠ接頭(5 μmol·L-1)0.5 μL,MseⅠ接頭(50 μmol·L-1)0.5 μL,滅菌純凈水補齊至10 μL,22 ℃連接1 h,70 ℃滅活5 min。
預擴增:連接產物1 μL,Taq酶(5 U·μL-1)0.2 μL,10×PCR Buffer(Mg2+)2 μL,EcoRⅠ preamp primer(10 μmol·L-1)0.5 μL,MseⅠ preamp primer(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)0.4 μL,滅菌雙蒸水補齊至20 μL。反應程序:94 ℃預變性2 min;進行20個循環(94 ℃變性30 s,53 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸10 min。
選擇擴增:將預擴增產物稀釋10倍進行選擇性擴增。預擴增產物稀釋液2 μL,Taq酶(5 U·μL-1)0.2 μL,10×PCR Buffer(Mg2+)2 μL,EcoRⅠ引物(10 μmol·L-1)0.5 μL,MseⅠ引物(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)0.4 μL,滅菌雙蒸水補齊至20 μL。反應程序:94 ℃預變性2 min;以每個循環降1 ℃的梯度從65 ℃退火到56 ℃退火(94 ℃變性30 s,65 ℃~56 ℃退火30 s,72 ℃延伸30 s);然后進行27個循環(94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸10 min。
選擇性擴增產物送至生工生物工程(上海)股份有限公司進行毛細管電泳。用ABI 3730XL自動測序儀(Applied Biosystems, USA)對PCR產物進行基因分型,用GeneMapper Software 5進行等位基因大小分析。
1.4 數據分析
根據毛細管電泳結果選取片段大小在0~500 bp的片段進行統計,構建“0、1”矩陣,運用PopGen 3.2軟件計算種群內部的觀測等位基因數(Na)、有效等位基因數(Ne)、 Nei’s基因多樣性指數(H)以及Shannon’s多樣性信息指數(I)、種群總遺傳變異(Ht)、種群內遺傳變異(Hs)、種群間遺傳分化系數(Gst)、種群間基因流動系數(Nm)。用AFLP data analyzer[11]計算各群體間的相似系數和遺傳距離,根據遺傳距離,采用MEGA 7.0分析2個品系之間的聚類關系,構建UPGMA和NJ系統發育樹。
2 結果與分析
2.1 AFLP擴增多態性
用16對引物組合對壇紫菜樣品進行擴增,共篩選出以下8對多態性好的引物組合:E-AAC/M-CAG、E-AAC/M-CTC、E-AAC/M-CTG、E-AAG/M-CAG、E-AAG/M-CTC、E-AAG/M-CTG、E-AGG/M-CAA、E-ACC/M-CTG。用篩選出的8對引物對2個群體ZN3(n=30)和YH(n=30)進行AFLP分析(圖1),共得到964個有效位點。每對引物擴增位點在53~181個,平均每對引物擴增出120.5個AFLP位點。擴增位點最多的引物對是E-AAG/M-CTC。每對引物擴增的多態位點比例均大于97%(表2)。
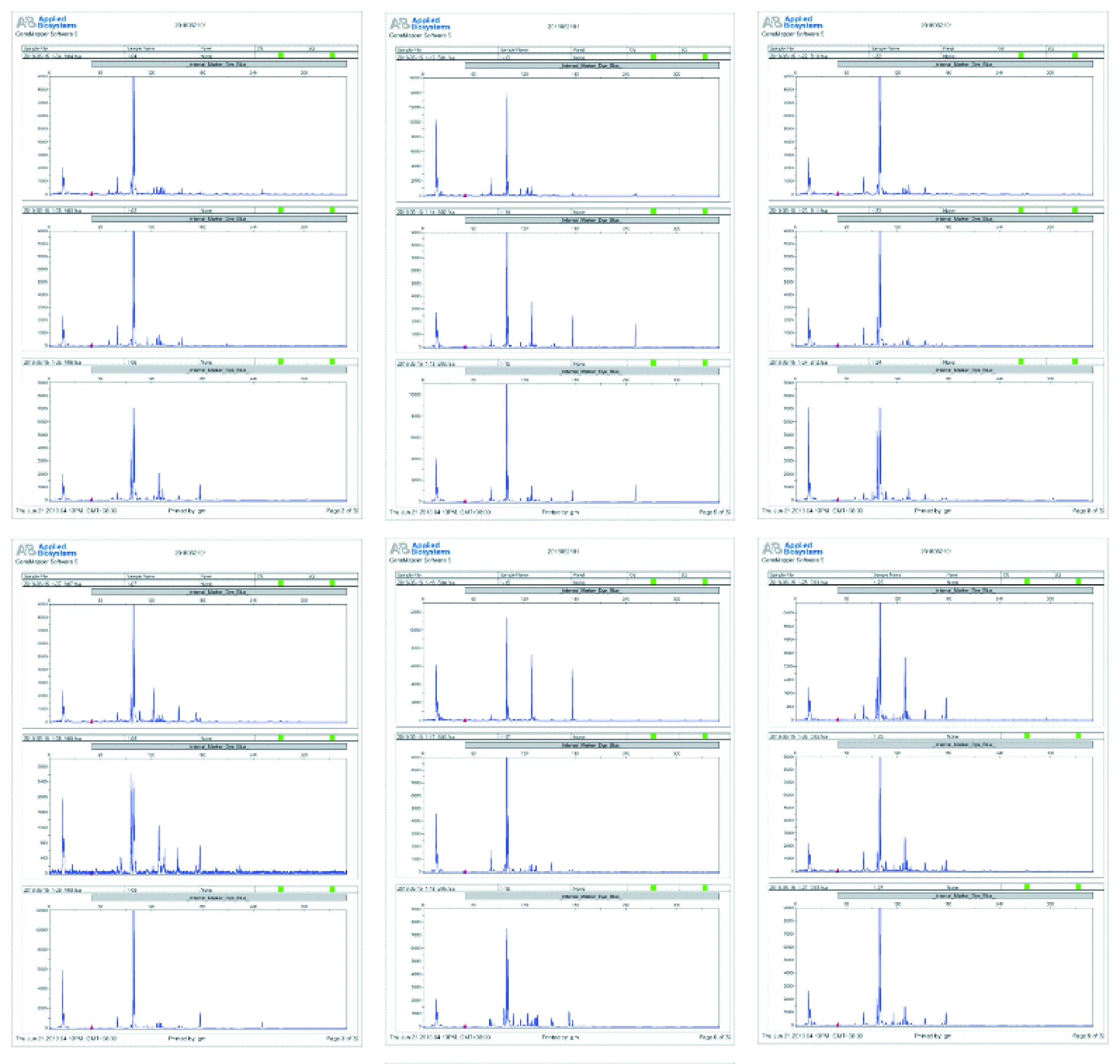
圖1 壇紫菜部分AFLP選擇性擴增結果
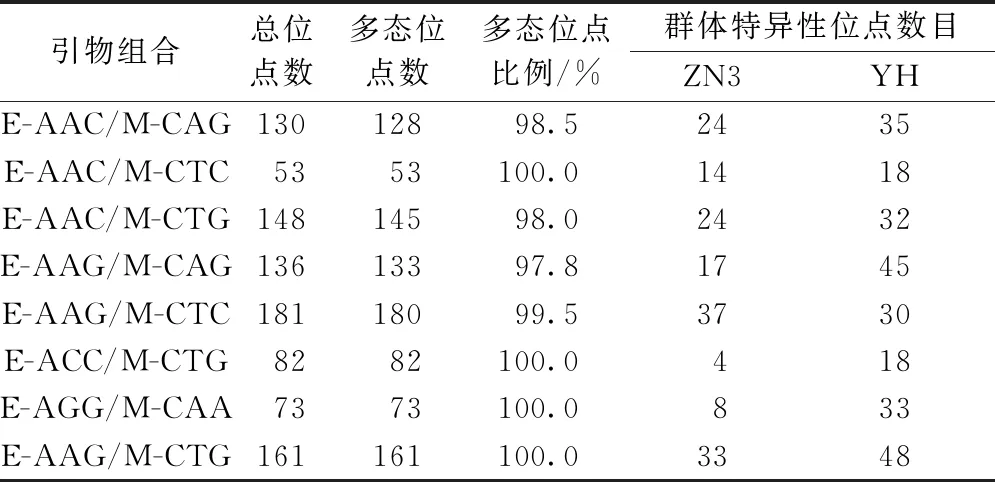
表2 AFLP選擇性引物的擴增結果
2.2 遺傳多樣性
遺傳多樣性是生物對復雜環境適應能力的一種反應,是評價生物資源狀況的重要依據。本實驗中8對引物在ZN3和YH群體中檢出多態位點數及比例(PPL)分別是665個(69.0%)和786個(81.5%),其中ZN3的多態位點數低于YH群體,Nei’s遺傳多樣性指數(H)和Shannon’s信息指數(I)也低于YH群體(表3),因此,認為YH本地壇紫菜具有較高的遺傳多樣性。
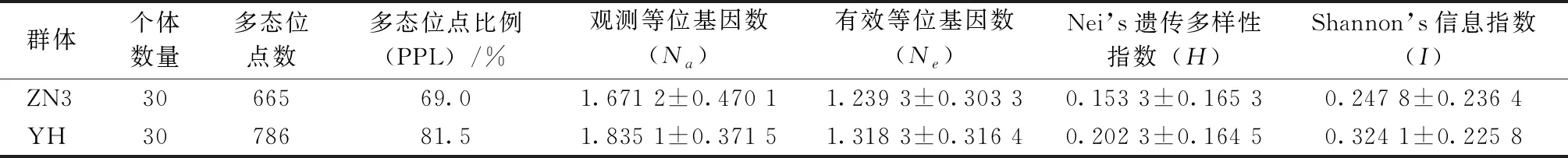
表3 2個壇紫菜品系的遺傳多樣性參數
2.3 遺傳結構
2個壇紫菜群體的種群總遺傳變異(Ht)和群體內遺傳變異(Hs)分別為0.240 2和0.177 8,群體間遺傳分化系數(Gst)為0.252 6,即群體間遺傳變異占總變異的25.3%,群體內遺傳變異占總變異的74.7%,表明不同品系的群體間遺傳分化程度較低。2個壇紫菜群體間基因流動系數(Nm)為1.593 0,表明壇紫菜不同品系間存在一定的基因交流。壇紫菜群體間遺傳相似度和遺傳距離見表4。
2.4 2個品系壇紫菜聚類分析
基于個體間的遺傳距離構建UPGMA和NJ聚類圖(圖2)。聚類分析表明,60個壇紫菜個體分成 2支,ZN3號的30個個體聚成一支,YH的30個個體聚成另外一支。
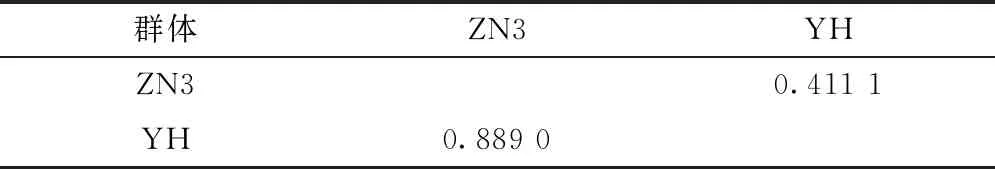
表4 群體間遺傳相似度和遺傳距離
注:對角線上為遺傳相似度;對角線下為遺傳距離。
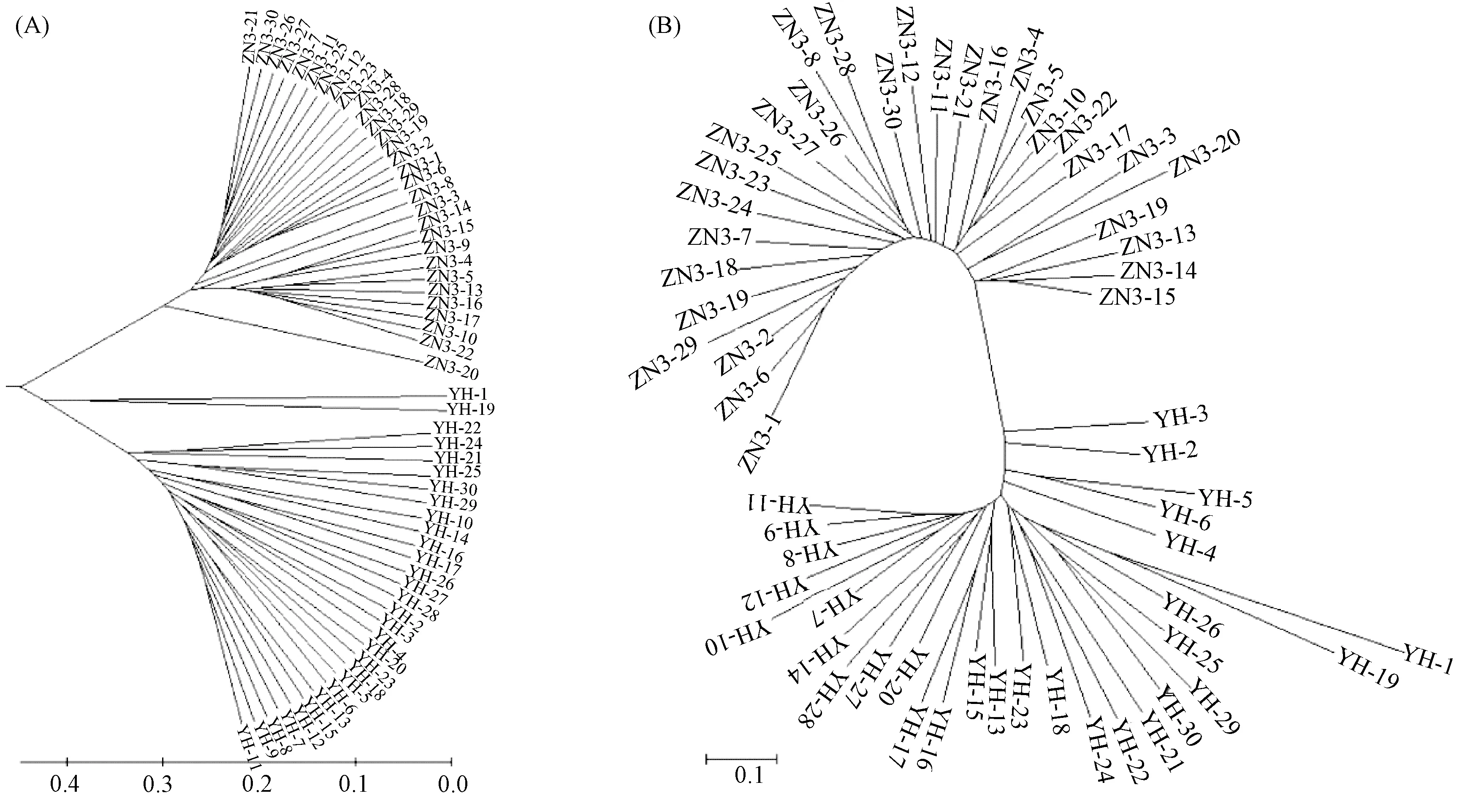
圖2 基于遺傳距離的壇紫菜UPGMA(A)和NJ(B)聚類樹
3 討論
3.1 壇紫菜的遺傳多樣性
物種或群體通過長期的進化積累豐富的遺傳變異,這些遺傳變異的總和構成了物種或群體的遺傳多樣性[12]。國內已有多位學者利用分子標記技術探討壇紫菜種質資源多樣性和遺傳差異[13-16],這些研究結果表明,壇紫菜的種質資源多樣性是極為豐富的。而相對于其他DNA標記技術,AFLP標記多態帶比例高、實驗結果穩定,不受基因組來源和復雜程度影響,重復性好并呈孟德爾遺傳的標記,且在生物基因組信息未知的條件下,就能夠檢測親緣關系非常近的材料之間的差異[17-18]。
本實驗利用AFLP技術分析了ZN3和YH 2個群體共60個樣本,結果顯示,2個群體的多態位點百分率分別是69.0%和81.5%;其中YH群體的多態位點比例高于ZN3群體,這可能是因為YH本地傳統養殖品系的種菜來源多樣且范圍大,而ZN3選育品系的種菜來源范圍較小,所以YH群體的遺傳多樣性較高。
3.2 壇紫菜群體的遺傳結構
壇紫菜的遺傳結構是由基因流和遺傳漂變2因素綜合決定的,基因流動程度會對群體的遺傳結構產生重要影響,理論上,若Nm>1,則說明群體間有一定程度的基因流動;若Nm<1,則說明群體間分化明顯[12]。本研究中,2個壇紫菜群體間基因流動系數Nm為1.593 0,表明其群體間存在一定的基因交流。目前紫菜養殖品種(系)間相互混雜,海區風浪較大,這都增加了品種(系)間基因交流的機會[7]。從UPGMA和NJ聚類圖中可以看出,ZN3和YH 2個群體明顯分為2大支,群體之前并沒有個體混雜情況出現,說明本次樣品采集有效合理,實驗結果可靠。
綜上所述,本研究結果揭示了浙南傳統養殖壇紫菜和選育壇紫菜品系間的遺傳多樣性差異,為了解浙南周圍壇紫菜資源提供了一定的理論支持。后續的實驗將會對更多浙南地區不同品系的壇紫菜樣品進行遺傳多樣性分析。

