化學(xué)反應(yīng)速率在高考命題中的常見題型研究
化學(xué)反應(yīng)速率作為化學(xué)反應(yīng)進(jìn)行程度的衡量,對(duì)于化工生產(chǎn)、實(shí)際生活以及科學(xué)制造等領(lǐng)域存在著關(guān)鍵性的意義。因此,在高考命題中應(yīng)當(dāng)以化學(xué)反應(yīng)速率的特點(diǎn)為基礎(chǔ),注重與實(shí)際生產(chǎn)、健康以及環(huán)境等相結(jié)合,實(shí)現(xiàn)化學(xué)反應(yīng)速率真正被人類研究與應(yīng)用。本文將通過分析不同典型與化學(xué)反應(yīng)速率有關(guān)的例題,從而為學(xué)生學(xué)習(xí)以及教師的教學(xué)活動(dòng)提供建議。
一、有關(guān)化學(xué)反應(yīng)速率的計(jì)算
例1:在一定條件下,體積為20L的密閉容器中,1 mol X和1 mol Y進(jìn)行反應(yīng):2X(g) +Y(g)=Z(g),經(jīng)60 s達(dá)到平衡,生成0.4 mol Z,下列說法正確的是( ?)。
A.以X濃度變化表示的反應(yīng)速率為0.0004mol/L/s
B.將容器體積變?yōu)?0 L,Z的平衡濃度變?yōu)樵瓉淼?倍
C.達(dá)平衡后,化學(xué)反應(yīng)速率關(guān)系是V正(X)=2V逆(Z)
D.若升高溫度,X的體積分?jǐn)?shù)增大,則該反應(yīng)的△H>0
●正確答案:C
解析:計(jì)算以X濃度變化表示的反應(yīng)速率,根據(jù)方程式前的計(jì)量系數(shù)之比,生成0.4mol的Z,則消耗0.8mol的X,那么V(X)=0.8mol/20L/60s=0.0007mol/L/s,A選項(xiàng)錯(cuò)誤;容器體積變?yōu)?0L,此化學(xué)平衡向著體積方向減小的方向進(jìn)行,即向右進(jìn)行,所以Z的平衡濃度大于原來的2倍,所以B選項(xiàng)錯(cuò)誤;不同組分之間的化學(xué)反應(yīng)速率的比值符合化學(xué)反應(yīng)方程式前的計(jì)量系數(shù)之比,所以V正(X)/V逆(Z)=2,所以C選項(xiàng)正確;X的體積分?jǐn)?shù)增大是由于平衡左移,升高溫度,平衡左移,則該反應(yīng)的正反應(yīng)為吸熱反應(yīng),△H<0,所以D選項(xiàng)錯(cuò)誤。
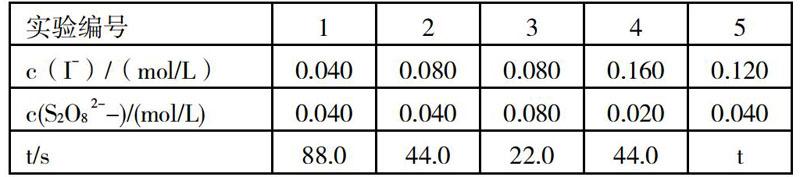
二、速率與平衡關(guān)系的應(yīng)用
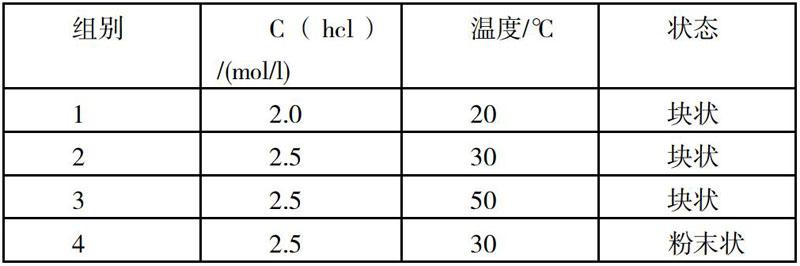
例2:等物質(zhì)量的鐵均與過量的稀鹽酸反應(yīng),相同的條件下使反應(yīng)同時(shí)進(jìn)行,四組產(chǎn)生相同體積氣體所用時(shí)間為a>b>c>d,同的實(shí)驗(yàn)條件下進(jìn)行反應(yīng),測定在不同時(shí)間t產(chǎn)生氣體體積V,則a、b、c、d所對(duì)應(yīng)的組別可能正確的是( ??)。

